1. 引言
蚊虫是最常见和分布最广泛的昆虫之一,在世界范围内发现37属3600种,主要分布在温带和热带地区 [1] {Hiroshige, 2017 #22} {Hiroshige, 2017 #22} {Hiroshige, 2017 #22} 。我国蚊虫种类繁多,在华南、华中和西南地区蚊虫多样性最高,分别有229种、188种和148种蚊虫,分布最广泛的蚊属是按蚊、库蚊和伊蚊 [2] {Wang, 2022 #23} {Wang, 2022 #23} {Wang, 2022 #23} 。白纹伊蚊(Aedes albopictus)又名“亚洲虎纹”,起源于亚洲,如今已扩散至全球70多个国家和地区。白纹伊蚊在中国分布广泛,北至辽宁省,南至海南省,西至西藏自治区均有白纹伊蚊分布,其中北纬30˚以南地区该蚊种密度更高 [3] [4] 。雄性蚊虫不吸血,只以吸花蜜、植物汁液等为食,而雄蚊虽也吸花蜜、植物汁液等,但除了自育性蚊种外,还必须吸食人或动物的血液,才能使其卵巢发育、产卵和延续后代 [4] 。由于蚊虫所吸食血液的重量与身体的重量大致相同,因此在吸食血液后无法长距离飞行,需要在附近停留一段时间来消化血液,以提供卵子成熟所必需的营养物质 [5] 。
近年来,犯罪分子反侦察意识越来越高,在作案过程中有意识地采取自我保护措施,对犯罪现场采取针对性的清理,减少了现场遗留物证信息的可能性,为物证的发现和提取以及案件的侦破带来了新的挑战。利用蚊虫分布广泛以及吸血特性,案发现场存留的蚊虫为法医物证DNA的提取以及个人识别提供了可能性,最终可为案件的侦破提供帮助。Soghigian等 [6] 经过长达40年的调查研究,对收集到的42种共177833只雌性蚊子进行研究发现,白纹伊蚊具有较高的人类特异性咬人意愿(HSBW)和相对咬人风险指数(RBRI),是理想的法医调查目标。本研究以白纹伊蚊为研究对象,通过Chelex-100法和硅膜纯化法提取白纹伊蚊吸食人血后体内消化物DNA,测定OD值,对DNA进行定量分析,并采用PCR-STR分型技术对D3S1358等21个基因座进行分型,探讨白纹伊蚊吸血后不同时间段提取人类DNA的可能性,并探究用于个人识别的可行性,供法医工作者参考。
2. 材料与方法
2.1. 试剂及耗材
500 mL烧瓶、TIANamp Genomic DNA Kit-DP304试剂盒(中国,天根生化科技(北京)有限公司)、QIAamp DNA Investigator Kit试剂盒(德国,QIAGEN公司)、PowerPlex® 21 System试剂盒(美国,Promega公司)、3130自动遗传分析仪(美国,AB公司)。
2.2. 血源的确定
选择一名成年身体健康的男性,获得其知情同意后,采集其指尖血,将血样涂于定性滤纸上,在室温下干燥并冷藏。
2.3. 白纹伊蚊的捕捉、鉴别和处理
在重庆市綦江区殡仪馆附近,选择一避光背风、阴暗潮湿的区域 [7] 。准备一个500 mL烧瓶作为简易捕蚊器,12.5 cm × 11.5 cm × 13.5 cm规格昆虫箱一个。志愿者暴露小腿皮肤,当蚊虫飞落至小腿时,根据蚊虫的花纹和体型等,参考白纹伊蚊的形态学特征初步判定是否为白纹伊蚊。初步认定为白纹伊蚊后,用捕蚊器罩住蚊子并记录吸血时间,当蚊子主动拔出口器(约2 min后),立即捕捉并转移至昆虫箱中,不再喂食。共捕捉到100只蚊子,随机选取35只蚊子作为实验组。根据禁食时间长短将35只蚊子随机分为7组:吸血后0 h组、12 h组、24 h组、36 h组、48 h组、60 h组以及72 h组,每组5只蚊子,再随机抽取5只蚊子(W1~W5)做基因种属鉴定。另捕捉10只未吸血的蚊子,随机选取5只作为空白对照组。用乙醚处理实验组和空白对照组蚊子,使用剃须刀片将蚊子腹部后端切下,用牙签将蚊子腹内消化物涂于定性滤纸上,阴干。滤纸上的每个样品都编号并密封在纸质证据袋中。在提取DNA之前,所有样品在室温下干燥并冷藏。进行种属鉴定的5只蚊子,处死后置于1.5 mL离心管中,加入1 mL无水乙醇,−20℃保存。
2.4. 白纹伊蚊种属鉴定
使用TIANamp Genomic DNA Kit-DP304试剂盒提取W1~W5共5只蚊子的DNA。基于NCBI网站白纹伊蚊线粒体16S rDNA序列设计引物。PCR扩增体系为12.3 μL,配比如下:10%海藻糖7.2 μL,ddH2O 2.4 μL,10 × Buffer (含Mg2+) 1.2 μL,dNTP 0.6 μL,BSA 0.6 μL,Primer 1 (正向) 0.12 μL,Primer 2 (反向) 0.12 μL,Taq酶0.06 μL。扩增循环步骤为:① 97℃,5 min;② 94℃,1 min,58℃,1 min,72℃,1 min,共28个循环;③ 72℃,7 min。扩增产物送上海基康生物技术有限公司(上海)进行测序。测序结束后,将序列与NCBI网站(https://blast.ncbi.nlm.nih.gov/)上的标准序列进行比较,以确定捕捉到的蚊子是否为白纹伊蚊 [8] 。
2.5. 白纹伊蚊体内人血源DNA STR分型
采用Chelex-100法提取志愿者血样、实验组蚊子的DNA。此外,采用QIAamp DNA Investigator Kit试剂盒提取吸血后72 h组和空白对照组蚊子的DNA。不同方法提取的DNA均用PP21试剂盒进行扩增,反应体系选择10 μL体系,配比如下:mixture 2 μL,物种特异性引物2 μL,DNA模板 1.0 μL,ddH2O 5.0 μL。扩增循环步骤为:① 97℃,5 min;② 94℃,1min;③ 58℃,1min;④ 72℃,1 min,共28个循环;⑤ 72℃,7 min。扩增产物经3130自动遗传分析仪电泳检测,电泳结果用GeneMapper ID v3.2分析。
3. 结果与分析
对W1~W5共5只蚊子mtDNA 16S rDNA进行测序,经数据库比对,确定5只蚊子均为白纹伊蚊。可推断出实验样本中的35只蚊子均为白纹伊蚊,测序结果见图1。实验组中,用Chelex-100法提取不同时间段白纹伊蚊体内消化物中的DNA,其DNA的浓度在59.9~90.3 ng/μL之间,OD 260/280在0.75~1.68之间。白纹伊蚊体内消化物DNA浓度随吸血后时间延长而呈下降趋势,如图2所示。经过对样本DNA荧光标记复合扩增和毛细管电泳分离,所得结果显示:采用Chelex-100法提取的蚊子吸血后0 h组、12 h组、24 h组、36 h组、48 h组和60 h组样本DNA均获得完整STR基因分型图谱。吸血后72 h的样本只有1例做出部分STR基因图谱,且峰值偏低(20~400),其余4例均无结果。因此,本课题研究人员又用硅膜法重新提取纯化吸血后72 h组中5例样本的DNA。经过对该样本DNA荧光标记复合扩增和毛细管电泳分离,所得结果显示:吸血后72 h组中,5例样本均得出完整STR基因图谱。Chelex-100法和硅膜法提取蚊子吸血后不同时间段STR基因分型结果及志愿者STR表型见表1。经比对,实验组蚊子获得的STR基因图谱与志愿者DNA STR基因图谱相同。综上所述,白纹伊蚊在吸血后72 h以内,其体内消化物能够做出人血源DNA的完整STR基因分型图谱。
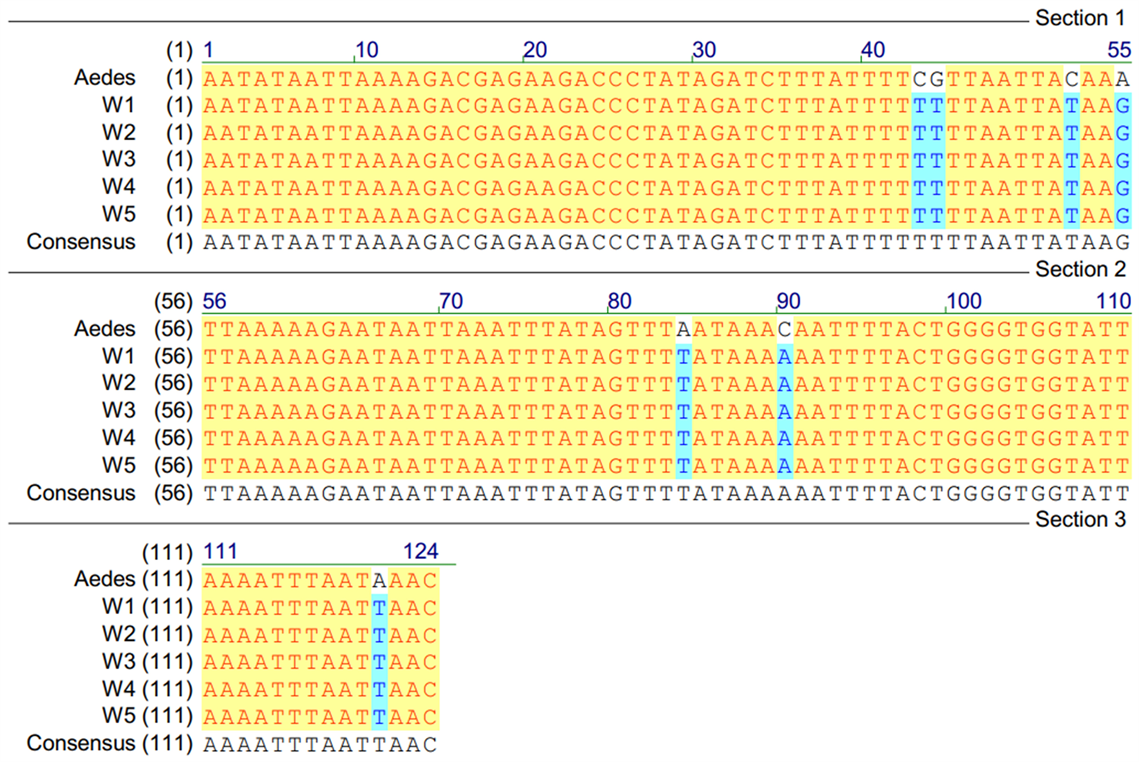
Figure 1. Comparison of 16S rDNA and Ae reference sequences in W1~W5 mosquitoes. Ae: Aedes albopictus sequences in gene bank
图1. W1~W5蚊子16S rDNA与Ae参考序列比较。Ae:基因库中的白纹伊蚊序列
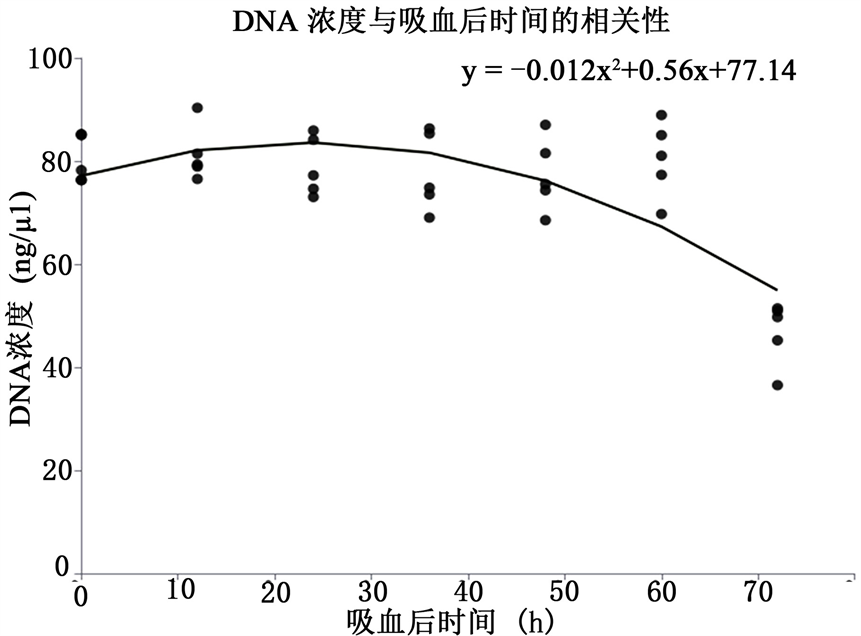
Figure 2. Linear relationship between post-feeding time and DNA concentrations
图2. 吸血后时间与DNA浓度线性关系

Table 1. STR typing results of human blood-derived DNA in mosquitoes
表1. 蚊子体内人血源DNA STR分型结果
注:-表示未检出。
4. 讨论
本研究以白纹伊蚊为研究对象,探讨吸血后白纹伊蚊体内检测人类DNA的可能性,以及用于个体识别的可行性。本研究对捕捉的蚊子进行了种属鉴定和吸血后不同时间段白纹伊蚊体内人类DNA浓度检测及STR分析。蚊子活动有早晨和傍晚两个高峰期,通常多出现于早晨日出前1~2小时及日落前2~3小时。根据白纹伊蚊整体呈黑色、有银白色斑纹、中胸盾片上有一条白色纵纹等形态学特征,可对蚊子种属进行初步鉴定 [9] [10] [11] 。目前已开发出多种物种鉴定方法,如线粒体细胞色素氧化酶亚基Ⅰ (COI)的DNA序列、DNA条形码等技术。结合本研究的实际情况,最终选择16S rDNA测序技术,在分子学水平上最终确认所捕捉蚊子为白纹伊蚊 [12] [13] 。明确蚊子为白纹伊蚊后,我们采用Chelex-100法和硅膜法提取各组蚊子体内人血源DNA,并进行PCR扩增及STR基因分型,将蚊子体内人血源DNA STR分型图谱与志愿者STR图谱进行对比。结果显示,Chelex-100法提取获得的STR图谱中,除72 h组,其余各组均获得完整的STR分型图谱,STR分型结果与志愿者DNA分型结果比对完全相同。而72 h组DNA通过硅膜法提取并用相同条件扩增和分型后,也得到了完整的与志愿者相同的STR图谱。我们的研究还发现,蚊子体内DNA浓度随吸血后时间的推移逐渐下降,随着蚊子吸血后时间延长,DNA被逐渐降解,大片段的基因位点检测出来的可能性越来越低,如Penta E 、D21S11、FGA等。Mukabana等 [14] 对冈比亚按蚊(Anopheles gambiae (Diptera: Culicidae))的研究发现,蚊子吸血后时间与获得PCR产物的成功概率之间存在显著的负相关关系(P < 0.001)。Curic等 [15] 通过对按蚊亚科和库蚊科蚊子的研究也发现,吸血后时间对获得完整DNA图谱存在显著的负相关关系,吸血后间隔时间每增加8小时,获得完整轮廓的可能性降低15.5%。Oshaghi等 [16] 也通过对20只按蚊和库蚊体内人线粒体DNA细胞色素b(cytB)基因进行PCR扩增,成功在蚊子体内获得了吸血后36小时的人血源DNA分型,并且随着消化时间的延长,蚊子体内人血源DNA的含量也随之下降。因此,白纹伊蚊体内消化物中的人类DNA浓度与吸血后时间之间存在负相关性。
分析72 h组通过Chelex-100法提取DNA无法获得完整STR图谱原因主要有以下两点。交配后的雌蚊在吸血时,血液储存于背支囊和腹支囊中,吸血完成后,支囊中的血液由马氏管浓缩后转至蚊胃中消化,在多种消化酶以及胃肠道细菌的作用下,血红蛋白转化为所需营养吸收,以促进受精卵发育。消化吸收的程度则取决于蚊子消化酶的活性和胃肠道细菌的活动 [14] [17] 。在消化吸收过程中,蚊子体内会产生许多代谢物,如金属阳离子(Fe3+等)、腐殖酸等,在用Chelex-100法提取DNA时可能被引入,导致DNA纯度不高,扩增受到抑制,从而影响了吸血后72 h组的分型结果。除以上结果外,在蚊子消化吸收吸入的人血过程中,血液中的DNA也会随之降解成小片段 [18] 。消化时间越长,人血源DNA降解程度越大,Chow-Shaffer等 [19] 通过实验发现,在29℃环境下,蚊子体内的人血源DNA在吸血后8小时平均降低67%,吸血后24小时平均降低90%。运用荧光标记符合扩增技术对白纹伊蚊体内人血源DNA的STR基因检测,结果主要受DNA降解程度的影响,这也可能是本实验研究中采用Chelex-100法提取吸血后72 h组蚊子的DNA进行检测,未获得完整STR分型图谱的另外一个原因 [15] 。
蚊子是一种广泛分布于世界各地的昆虫,在众多案发现场可以看见蚊子的踪迹。研究表明,蚊子消化道中提取到的人血源DNA可以协助调查在封闭环境(如房间或车辆)中实施的犯罪活动 [15] [20] 。在犯罪分子反侦察意识增强的今天,外加刑事侦查技术的普及,在犯罪现场提取到有效的生物物证并成功进行个人识别变得越来越困难。本研究从分布广泛并有吸血特性的白纹伊蚊出发,为案发现场提取DNA物证并完成个人识别的调查提供了突破口和新的工作思路。
本研究表明,白纹伊蚊体内提取的人血源DNA可作为法医学证据,对犯罪现场中的蚊子血进行DNA检测,可获得人类DNA分型结果,并可用于个人识别。此外,我们的研究发现,蚊子吸血后消化时间会影响STR分型图谱完整性。从犯罪现场的蚊子体内采集的血液,有助于确定犯罪现场人员的身份,为识别涉案人员开辟一条新的途径。
基金项目
国家自然科学基金项目(81660232);昆明医科大学研究生教育创新基金(2022S150)。
NOTES
*共同第一作者。
#通讯作者。