摘要: 目的:建立山豆根配方颗粒HPLC指纹图谱分析方法,并比较山豆根药材及配方颗粒的差异性,为山豆根药材及配方颗粒的质量控制提供参照。方法:采用高效液相色谱法,色谱柱为Diasonsil C18 (4.6 mm × 250 mm, 5 μm),流动相为乙腈-0.1%磷酸水溶液(梯度洗脱),柱温为25℃,检测波长为210 nm。结果:山豆根药材相似度在0.903~0.979之间,有31个共有峰,10批山豆根配方颗粒相似度在0.995~1.000之间,有23个共有峰,山豆根药材与配方颗粒之间的相似度在0.853~0.958之间,山豆根药材与配方颗粒有19个共有峰。结论:该方法稳定、重复性较好、分离度较好及专属性较强,可以有效地对山豆根药材及配方颗粒进行质量控制,从而探索山豆根药材及配方颗粒的差异性,为临床使用山豆根配方颗粒提供参考。
Abstract:
Objective: To establish an HPLC fingerprint analysis method for Sophorae tonkinensis Radix et Rhizoma formula granules, and compare the differences between Sophorae tonkinensis Radix et Rhizoma medicinal herbs and formula granules, providing reference for the quality control of Sophorae tonkinensis Radix et Rhizoma medicinal herbs and formula granules. Method: Using high- performance liquid chromatography (HPLC) for detection, the chromatographic column is Diasonsil C18 (4.6 mm × 250 mm, 5 μm). The mobile phase was acetonitrile 0.1% phosphoric acid aqueous solution (gradient elution), with a column temperature of 25˚C and a detection wavelength of 210 nm. Result: The similarity of Sophorae tonkinensis Radix et Rhizoma medicinal herbs ranges from 0.903 to 0.979, with 31 common peaks. The similarity of 10 batches of Sophorae tonkinensis Radix et Rhizoma formula particles ranges from 0.995 to 1.000, with 23 common peaks. The similarity between Sophorae tonkinensis Radix et Rhizoma medicinal herb and formula granules ranges from 0.853 to 0.958, and there are 19 common peaks between Sophorae tonkinensis Radix et Rhizoma medicinal herb and formula granules. Conclusion: This method is stable, reproducible, with good separation and strong specificity, and can effectively control the quality of Sophorae tonkinensis Radix et Rhizoma formula granules, thereby exploring the differences between Sophorae tonkinensis Radix et Rhizoma medicinal materials and formula granules, and providing reference for clinical use of Sophorae tonkinensis Radix et Rhizoma formula granules.
1. 引言
山豆根为我国传统的药用植物,来源广泛,多见于贵州、四川等地。山豆根(Sophorae tonkinensis Radix et Rhizoma)为豆科槐属植物越南槐(Sophora tonkinensis Gagnep.)的干燥根及根茎,具有清热解毒,消肿利咽的功效 [1] [2] 。现代研究表明山豆根多含黄酮、三萜类及生物碱类成分 [3] [4] ,具有抗炎、抗肿瘤、抗菌、抗病毒、保肝等多种药理作用 [5] [6] 。
配方颗粒是基于药材饮片为原料,运用现代技术制成的新型配方用药,具有用药方便、携带运输简便、便于调剂等优点 [7] [8] 。山豆根配方颗粒现在被广泛应用于临床上,目前有文献报道采用液相指纹图谱技术 [9] 和光谱指纹图谱技术 [10] 对山豆根进行鉴别,但是尚无采用HPLC指纹图谱研究市售山豆根饮片及配方颗粒二者质量相关性的报道。中药指纹图谱是一种可以评价中药产品内在质量整体变化的分析鉴别技术,常应用于中药及其相关制剂的质量控制 [11] [12] 。因此,本研究采用高效液相色谱法建立10批市售山豆根药材和10批山豆根配方颗粒的HPLC指纹图谱,以期为山豆根药材及其配方颗粒的质量评价提供参考依据。
2. 仪器与材料
2.1. 材料
山豆根药材由实验室自行购买,经贵州民族大学王祥培教授鉴定为豆科槐属植物越南槐(Sophora tonkinensis Gagnep)的干燥根及根茎,山豆根药材和配方颗粒具体详见表1。

Table 1. Serial numbers, sample names, and sources of different batches of Sophorae tonkinensis Radix et Rhizoma medicinal materials and granules
表1. 不同批次的山豆根药材和颗粒序号、样品名和来源
2.2. 试剂及仪器
Waters HPLC 2695,美国Waters公司(包括四元高压梯度泵、自动进样器、柱温箱、PDA检测器、Empower色谱工作站),超声波清洗器(昆山市超声仪器有限公司,型号KQ-100E),电子天平(上海市安亭电子仪器厂,型号:FA10048),甲醇色谱纯(国药集团化学试剂有限公司,批号:20190221),乙腈色谱纯(国药集团化学试剂有限公司,批号:20201215),哇哈哈水(娃哈哈集团有限公司),磷酸分析纯(国药集团化学试剂有限公司)。
3. 方法与结果
3.1. 供试品溶液的配制
本次实验的山豆根药材10批,每批精密称定1.0 g,山豆根配方颗粒10批,每一批精密称定0.5 g,分别加甲醇25 mL,超声提取30 min,放冷,补重,过滤,滤液过0.22 μm滤膜,即可。
3.2. 色谱条件
色谱柱:Diasonsil C18 (4.6 mm × 250 mm, 5 μm),流动相:乙腈(A)-0.1%的磷酸水(B);梯度洗脱(0~10 min, 20% A~40.5% A; 10~30 min, 40.5% A~50% A; 30~45 min, 50% A~70% A; 45~50 min, 70% A~70% A; 50~55 min, 70% A~20% A; 55~65 min, 20% A~20% A);流速:1.0 mL/min;检测波长:210 nm;柱温:30℃;进样量:10 μL。
3.3. 方法学考察
3.3.1. 精密度试验
取样品山豆根配方颗粒(S11)供试品溶液,按确定的色谱条件下连续进样6次,考察仪器的精密度。结果表明,各共有峰的相对保留时间及相对峰面积RSD均小于3%,说明仪器的精密度良好。
3.3.2. 稳定性试验
取样品山豆根配方颗粒(S11)供试品溶液,按确定的色谱条件下分别于0、2、4、8、12、24 h进样,考察药物的稳定性。结果表明,各共有峰的相对保留时间与相对峰面积RSD均小于3%,说明样品在24 h内稳定。
3.3.3. 重复性试验
取样品山豆根配方颗粒(S11) 6份,按“3.1”项下的方法平行制备分析样品,按“3.2”项下的色谱条件分别进样,考察实验方法的重复性。结果表明,各共有峰的相对保留时间和相对峰面积RSD均小于3%,说明该方法的重复性良好。
3.4. HPLC指纹图谱生成与共有峰、相似度相关性分析
3.4.1. 山豆根药材及配方颗粒指纹图谱的构建
按确定的制备方法对样品进行处理,再按照确定的色谱条件分别对其进行测定,从而得到各批次样品HPLC色谱图后,将其导入中药指纹图谱相似度评价系统,得到山豆根和配方颗粒的HPLC指纹图谱,结果见图1、图2、图3。
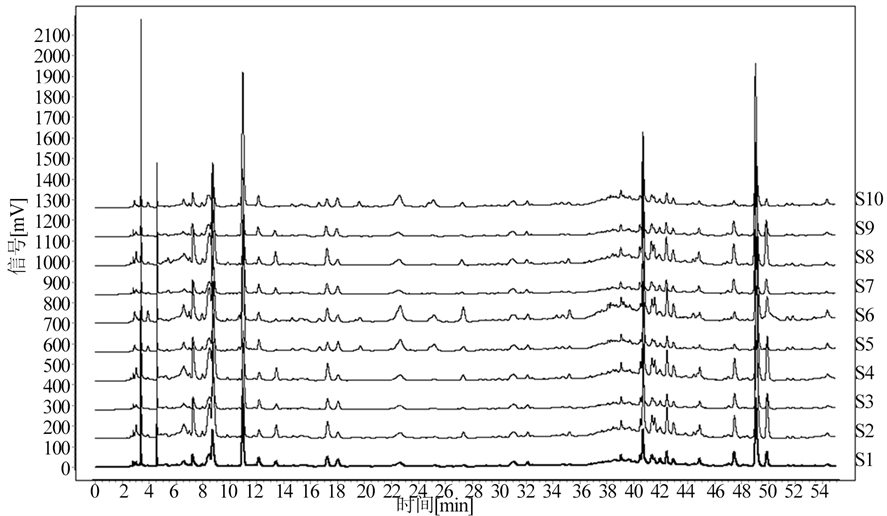
Figure 1. HPLC fingerprint of 10 batches of Sophorae tonkinensis Radix et Rhizoma medicinal materials
图1. 10批山豆根药材HPLC指纹图谱

Figure 2. HPLC fingerprint of 10 batches of Sophorae tonkinensis Radix et Rhizoma formula particles
图2. 10批山豆根配方颗粒HPLC指纹图谱

Figure 3. HPLC fingerprint of Sophorae tonkinensis Radix et Rhizoma medicinal materials and formula granules (S1~S10: Sophorae tonkinensis Radix et Rhizoma medicinal materials; S11~S20: Sophorae tonkinensis Radix et Rhizoma formula granules)
图3. 山豆根药材及配方颗粒HPLC指纹图谱(S1~S10山豆根药材;S11~S20山豆根配方颗粒)
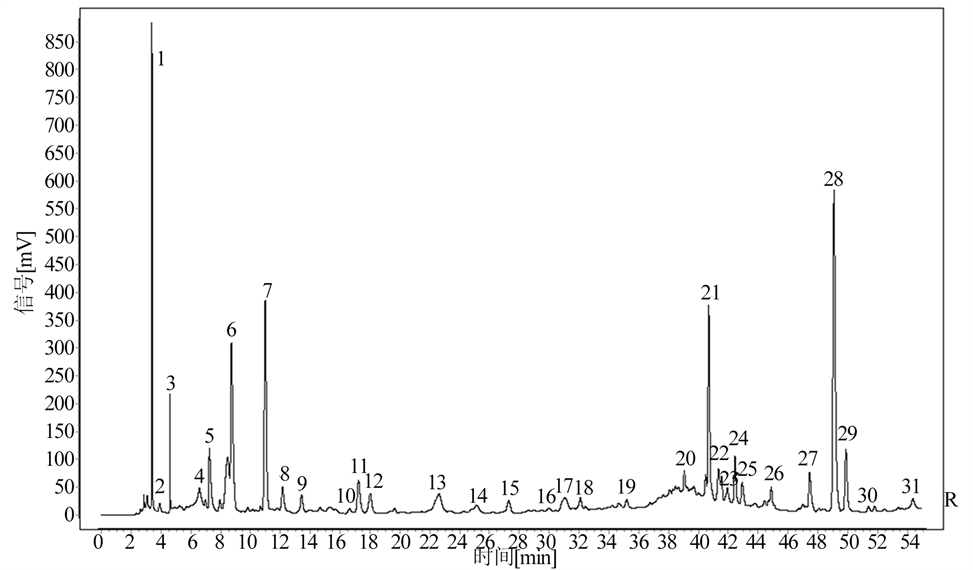
Figure 4. Common pattern of HPLC fingerprint of 10 batches of Sophorae tonkinensis Radix et Rhizoma medicinal materials
图4. 10批山豆根药材HPLC指纹图谱共有模式图
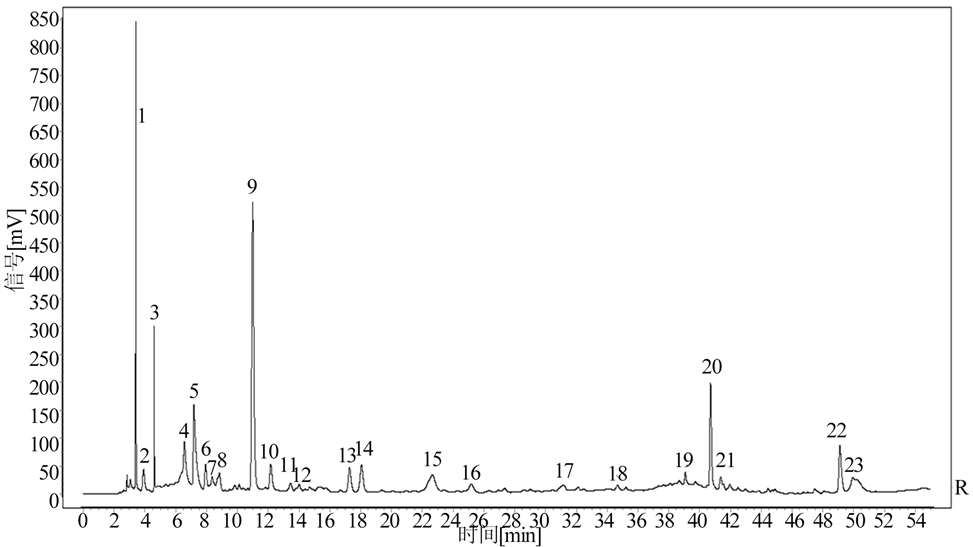
Figure 5. Common pattern of HPLC fingerprint of 10 batches of Sophorae tonkinensis Radix et Rhizoma formula particles
图5. 10批山豆根配方颗粒HPLC指纹图谱共有模式图

Figure 6. Common pattern of HPLC fingerprint of Sophorae tonkinensis Radix et Rhizoma medicinal materials and Formula Granules
图6. 山豆根药材及配方颗粒HPLC指纹图谱共有模式
3.4.2. 共有峰的确定
将10批山豆根药材和10批山豆根配方颗粒的液相图谱导入《中药色谱指纹图谱相似度评价系统2012A 版》,发现10批山豆根药材有31个共有色谱峰,10批山豆根配方颗粒有23个共有色谱峰,山豆根药材与配方颗粒比较有19个共有色谱峰,以峰形、分离度较好的山豆根及配方颗粒的共有峰(7号)为参照峰,计算各共有峰的相对峰面积。结果见图4、图5、图6,表2。


Table 2. Relative peak area of common peaks in HPLC fingerprint of Sophorae tonkinensis Radix et Rhizoma medicinal materials and formula granules
表2. 山豆根药材及配方颗粒HPLC指纹图谱共有峰的相对峰面积
3.4.3. 相似度评价
采用《中药色谱指纹图谱相似度评价系统2012A版》软件分别匹配药材及颗粒的HPLC色谱图相关参数,10批山豆根药材的相似度结果为0.903~0.979,10批山豆根配方颗粒的相似度结果为0.995~1.000,10批山豆根药材与10批山豆根配方颗粒的相似度结果为0.853~0.958。结果见表3、表4。

Table 3. Similarity of 10 batches of Sophorae tonkinensis Radix et Rhizoma medicinal materials and 10 batches of Sophorae tonkinensis Radix et Rhizoma formula granules
表3. 10批山豆根药材的相似度和10批山豆根配方颗粒的相似度

Table 4. Similarity of Sophorae tonkinensis Radix et Rhizoma medicinal materials and Sophorae tonkinensis Radix et Rhizoma formula granules
表4. 山豆根药材与山豆根配方颗粒的相似度
4. 讨论
本文建立了山豆根药材及其配方颗粒HPLC指纹图谱的分析方法,10批山豆根配方颗粒相似度在0.995~1.000之间,有23个共有色谱峰。10批山豆根药材相似度在0.903~0.979之间,有31个共有色谱峰。山豆根药材与山豆根配方颗粒之间的相似度在0.853~0.958之间,山豆根药材与其配方颗粒有19个共有峰。实验结果表明,该方法能有效地分离山豆根中的化学成分,且10批山豆根药材的一致性较好,10批山豆根配方颗粒相似度较高,一致性好。山豆根药材与配方颗粒的一致性存在差异。
本实验考察了乙醇、70%乙醇、甲醇、70%甲醇等不同溶剂、不同提取时间及回流和超声提取对药材的影响,结果以甲醇为溶剂,超声提取30 min较完全。并且考察了甲醇–水、乙腈–水、乙腈-0.01%磷酸水、乙腈-0.1%磷酸水为流动相系统;波长考察了210 nm、254 nm、270 nm、280 nm及柱温考察了25℃、30℃、35℃,结果发现采用乙腈-0.1%磷酸水为流动相系统、波长为210 nm及柱温30℃时,各峰的分离度较好、信息量较丰富且基线平稳,有利于山豆根药材及其配方颗粒HPLC指纹图谱的分析。
现行版《中国药典》山豆根药材项下的质量控制指标为苦参碱和氧化苦参碱,并规定了其在山豆根干燥品的总量不得少于0.7% [1] 。近年来,有研究表明山豆根多糖对肿瘤具有抑制作用 [13] ,芳香类成分及黄酮类成分对APAP诱导的肝细胞损伤具有保护作用 [14] ,非生物碱类对免疫性肝损伤具有保护作用 [15] 。有文献报道称总生物碱的含量测定可以用于控制山豆根配方颗粒的质量 [16] 。仅控制苦参碱和氧化苦参碱及总生物碱的含量存在药效关联性不强的问题,并且仅靠单一的某类成分含量的变化难以全面的评价山豆根及其配方颗粒的质量优劣。为全面评价山豆根药材及其配方颗粒的质量并初步探讨二者质量的相关性,本研究采用HPLC指纹图谱法测定10批市售山豆根药材和10批配方颗粒。实验的结果表明,山豆根药材与配方颗粒之间存在差异,可能与山豆根的生长环境、采收时节及山豆根饮片经过提取和浓缩等现代制粒工艺有关,而山豆根配方颗粒又被广泛应用于临床。因此,山豆根配方颗粒替代山豆根饮片广泛应用于临床的疗效是否与山豆根饮片一致还应进行深入的研究。
5. 总结
本文建立的山豆根及其配方颗粒的指纹图谱信息量大、操作简单快速,可为山豆根药材及其配方颗粒的质量控制提供参考。
基金项目
贵州省一流课程重点建设项目(项目合同编号:黔教高发[2017]158)。
NOTES
*第一作者。
#通讯作者。