1. 引言
鲟鱼籽酱是鲟科类的鱼卵经过轻微盐渍制成,严格按照国际餐饮文化的标准来说只有鲟科类的鱼卵才可以被称为鱼子酱,因其稀有而珍贵,自古以来就是一种非常昂贵的水产类美食 [1] ,其在中国也有很长的食用历史,最早甚至可以追溯到三国时期 [2] 。鱼子酱富含维生素(A、C、B2、B6、PP、B12)、卵磷脂以及钙、锌、硒、镁、铜等多种矿物元素和人体所需的多种氨基酸、蛋白质、多不饱和脂肪酸,还含有丰富的DHA和EPA,不仅营养价值很高,还具有滋润肌肤、消除疲劳,促进发育、提高免疫力等多种保健作用 [3] [4] [5] 。鲟鱼籽酱的加工一般经过:鲟鱼宰杀、取卵、搓卵、漂洗、沥水、挑选、腌制和包装几个步骤,为确保鱼卵的口感和新鲜度,整个工序一般要求在10~15 min内完成,然后进行真空罐装后低温贮藏 [6] 。
低温贮藏是保持水产品新鲜度的常用方法之一,根据贮藏温度可以分为冷藏和冻藏,冻藏一般在−10℃以下,因为温度低可以有效抑制水产品中微生物的生长繁殖活动和酶活性,降低产品微生物数量使货架期延长数月,但因形成的冰晶过大往往引起水产品组织结构破坏使品质和口感下降。冷藏条件下又因温度偏高,导致水产品较快腐败。微冻保鲜是将水产品的中心温度降至略低于细胞冻结温度点后,在该温度下进行贮存以保持水产品品质的一种轻度冷冻保鲜方法,能够较好的保持水产品的新鲜度并降低长期冻藏造成的品质劣变程度 [7] 。鲟鱼籽酱的微冻贮藏一般控制在鲟鱼籽酱冰点以下1℃~2℃之间的温度带内,常用的温度为−2℃,该条件下只产生少部分冰晶,鲟鱼籽酱组织结构受破坏程度小,汁液流失率低,产品质构与冷藏条件下的差异不大,但可使产品的货架期延长至冷藏的1.5~4倍,是目前鲟鱼籽酱保鲜的常用贮藏温度 [8] 。
微生物是导致鱼子酱腐败变质最主要的因素, 高通量测序技术(Illumina Miseq)可以在短时间内确定样品中的微生物群落组成和结构,是一种新的不依赖于传统微生物培养的方法,可以一次性对上百万条基因分子进行并行测序,使在样品中含量很低的微生物也可以被检测出来,具有极高的灵敏度 [9] ,在鲟鱼籽酱加工贮藏以及微生物多样性研究方面已有广泛的运用。Bagge-Ravn等 [10] 运用高通量测序技术对四个水产品加工厂加工车间的微生物进行了检测,其中分离出1009种不同的微生物,包括在鲟鱼籽酱加工厂检测分离的嗜冷菌、金黄色葡萄球菌及酵母菌。于渺 [11] 和周婷 [12] 运用高通量测序技术研究了鲟鱼籽酱加工和贮藏期间的品质及优势微生物变化,发现微生物的活动是引起鲟鱼籽酱腐败变质和食用安全的主要因素,尤其是其中的优势菌,对产品的质量起着关键作用。
鲟鱼籽酱加工工艺的特殊性导致产品贮藏运输和销售过程中极易腐败变质,而冷冻的鱼子酱口感被严重破坏,同时还存在一定的食品安全风险隐患。关于冷藏期间鲟鱼籽酱微生物多样性的研究,已经在微生物的分离鉴定方面开展了部分研究工作,有研究表明嗜冷杆菌属和鞘脂单胞菌属是主要优势菌属,同时发现在不同贮藏时间段优势菌属有较大差异 [13] 。在前期研究中我们发现不同贮藏时期内的鱼籽酱中的菌落总数在103 CFU/g以上。然而,目前对微冻贮藏条件下鲟鱼籽酱中微生物菌群结构及其多样性的系统性研究还未见报道。本实验利用Illumina Miseq技术分析微冻保鲜条件下不同贮藏期鲟鱼籽酱中微生物的多样性,比较、分析鲟鱼籽酱冷藏期间微生物菌群结构及其消长规律,同时深度剖析核心微生物类群,为鲟鱼籽酱的微生物控制提供科学依据。
2. 材料与方法
2.1. 材料与仪器
鲟鱼籽酱:湖北清江鲟龙渔业有限公司生产,上海鲟丹科技股份有限公司提供。
DNA提取试剂盒(DNA Kit)购自美国Omega公司;Qubit3.0 DNA检测试剂盒购自美国Life公司;2×Hieff® PCR预混液、Hieff NGS™ DNA分选磁珠(Hieff NGS™ DNA Selection Beads)购自翌圣生物科技股份有限公司。
凝胶成像系统,上海复日科技有限公司;Pico™ 21型微量离心机、HulaMixer™样品混合器,SimpliAmp™ PCR仪,Thermo Fisher;DYY-6 C型电泳仪电源、DYCZ-21型电泳槽,北京市六一仪器厂;Q32866型Qubit® 3.0荧光计,北京东胜创新生物科技有限公司;Research plus型移液器,德国Eppendorf公司;Miseq型测序仪,美国Illumina公司。
2.2. 实验方法
2.2.1. 样品的预处理
鲟鱼籽酱样品3组,每组20 g,−2℃贮藏0, 25, 50 d,其中0 d的样品为对照组。样品预处理参考本实验室已发表的方法进行 [9] [14] ,使用无菌不锈钢勺取样,每组分别取在不同贮藏期的鲟鱼籽酱样品0.5 g于2 ml离心管中,经组织破碎仪破碎10 s后备用。
2.2.2. 微生物菌落总数测定(Total viable count, TVC)
按照GB 4789.2-2022《食品安全国家标准食品微生物学检验菌落总数测定》 [15] 进行,测定结果用l g (CFU/g)表示,称取10 g鱼子酱置于无菌均质袋中,加入90 mL无菌生理盐水,用拍击式均质器拍打2 min,制成1:10的样品稀释液,再稀释10倍,分别吸取稀释度为1:10和1:100的样品稀释液100 μL,涂布接种于胰蛋白胨大豆琼脂培养基(TSA),置于36℃ ± 1℃培养48 ± 2 h。选取菌落数在适宜计数范围内的稀释度进行计数,每个稀释度重复3次。
2.2.3. DNA的提取
DNA提取操作按试剂盒产品说明书进行,网址链接参考 (http://omegabiotek.com/store/product/soil-dna-kit/),用2%的琼脂糖凝胶电泳对鲟鱼籽酱基因组DNA抽提效果进行检测 [9] [16] 。
2.2.4. PCR扩增及高通量测序
对各组样品的16S rDNA序列V3~V4区域进行扩增,以提取到的基因组DNA为模板,引物为:
341F,5′- CCTACGGGNGGCWGCAG;805R,5′- GACTACHVGGGTATCTAATCC。通过在正向引物上连接不同碱基标签序列(barcode)来识别不同组的样品,标签序列为:0 d,GTGTAT;25 d,TGGATA;50 d,GTTTCG。
经过PCR扩增两轮后用2%琼脂糖凝胶电泳进行检测,再用Qubit 3.0 DNA检测试剂盒对纯化后的样品进行定量检测,最后交由生工生物工程(上海)股份有限公司完成Illumina MiSeq高通量测序工作。
2.2.5. 高通量测序结果分析
根据barcode序列对各组样品进行区分、比较,通过质控和筛选,对有效序列进行操作分类单元(operational taxonomic unit, OTU)聚类分析和物种分类学分析(在97%的相似水平下进行),基于分类学信息,讨论鲟鱼籽酱在不同贮藏期的微生物菌群结构变化。
2.3. 数据处理
使用软件R 3.6.0和Excel 2016进行图像和数据处理;使用软件Cutadap 1.18、PEAR 0.9.8及PRINSEQ 0.20.4进行序列拼接和数据质控;使用软件Usearch 11.0.667进行OUT聚类分析,使用软件RDP Classifier 2.12进行OTU物种注释及统计;使用软件Mothur 1.43.0进行多样性分析。
3. 结果与分析
3.1. 鲟鱼籽酱冷藏期间菌落总数变化
从图1可以看出,鲟鱼籽酱冷藏期间菌落总数逐渐上升,第0 d时菌落总数为3.08 ± 0.03 lg (CFU/g),在−2℃贮藏25 d和50 d后,样品菌落总数分别为3.53 ± 0.02 lg (CFU/g)和3.68 ± 0.05 lg (CFU/g)。
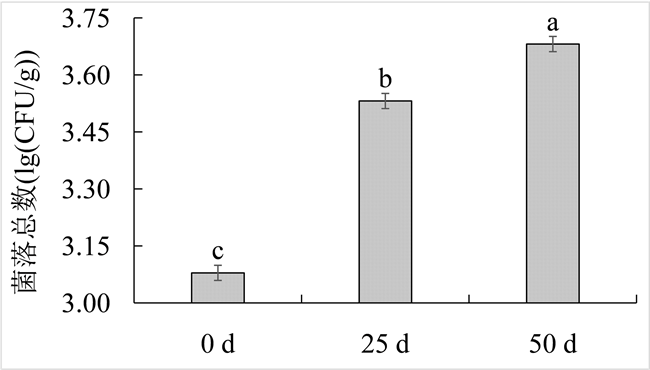
Figure 1. Total microbial count of Sturgeon caviar during cold storage
图1. 鲟鱼籽酱冷藏期间菌落总数
3.2. 样品DNA提取及PCR扩增结果
以提取的鲟鱼籽酱总DNA作为模板,通过16S rDNA V3-V4区的通用引物扩增出目的片段序列。实验结果如图2所示,各组样品(0 d, 25 d, 50 d)在500~600 bp之间均有清晰、明亮的可见条带,没有明显的非特异性扩增现象,表明提取的DNA样本能够满足后续测序实验的要求。
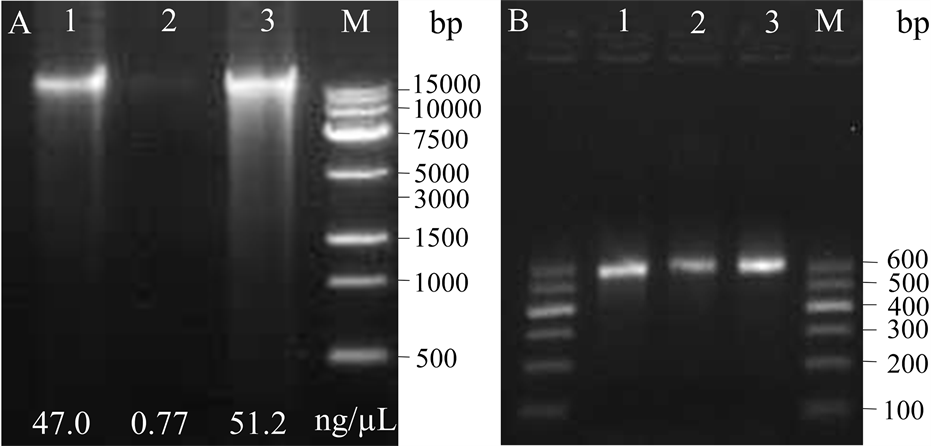 注:A,鲟鱼籽酱DNA;B,PCR扩增产物;M,DNA分子量标准;1~3,鲟鱼籽酱25 d,50 d和0 d。
注:A,鲟鱼籽酱DNA;B,PCR扩增产物;M,DNA分子量标准;1~3,鲟鱼籽酱25 d,50 d和0 d。
Figure 2. Electrophoretogram of DNA and polymerase chain reaction products of Sturgeon caviar during cold storage
图2. 鲟鱼籽酱菌群DNA和PCR扩增产物电泳图
3.3. Illumina高通量测序数据统计(质控评估)
采用Illumina高通量测序方法对3组鲟鱼籽酱样品进行测序,经过Cutadap、PEAR及PRINSEQ等软件进行质控筛选及数据优化后获得134,811条有效序列,序列长度主要集中在400~440 bp。采用Usearch软件按照97%相似性对有效序列进行OUT聚类,共获得881个OTUs (表1)。

Table 1. Sturgeon caviar during cold storage
表1. 鲟鱼籽酱样本菌群有效序列数据统计
3.4. 稀释曲线分析
物种的稀释曲线是指在样本中随机抽取一定数量的序列,统计这些序列对应样本的多样性指数,以随机抽取的测序数据量作为横坐标,以OUT数量(物种数量)为纵坐标,绘制曲线,然后根据曲线是否达到平缓来判断本次测序数据量是否足够、测序数据的量是否合理,稀释曲线可以用来反应样品的测序深度 [7] [17] ,利用Mothur软件对数据进行分析,R软件绘图,如图3所示,可以看出3组样品的稀释曲线均已达到曲线的平缓阶段,表明测序数据量已经能够满足多样性分析的要求。
3.5. 主成分分析
主成分分析图(图4)可以反应各组样品的总体分布情况,PC1的贡献率为92.86%,PC2的贡献率为7.14%,两个主轴贡献之和达到100%,说明其完全能够反应样品的所有信息。从三组样品在主成分分析图上的分布来看,不同贮藏期的样品相距较远,表明各组间微生物种群结构发生了明显的变化。
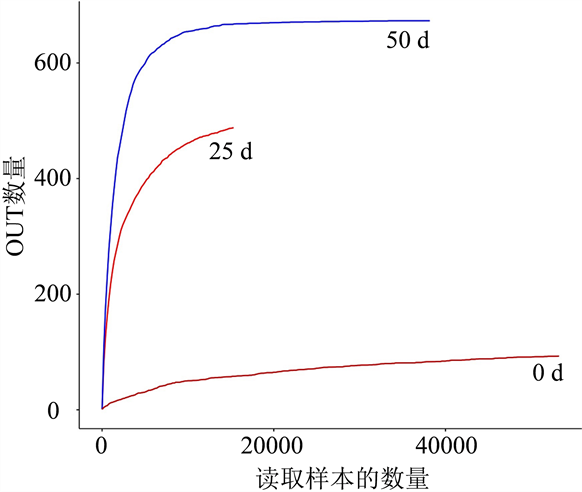
Figure 3. Rarefaction curve of Sturgeon caviar samples in different storage time
图3. 不同贮藏期鲟鱼籽酱稀释曲线
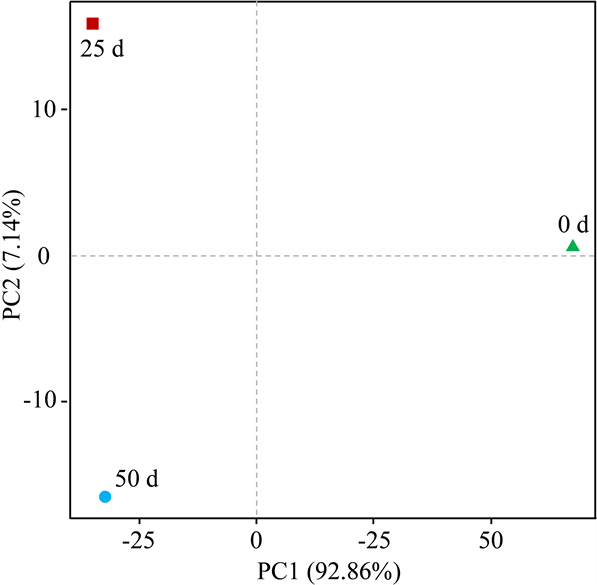
Figure 4. Principal component analysis of Sturgeon caviar
图4. 鲟鱼籽酱菌群主成分分析图
3.6. 菌群多样性分析
对不同贮藏期的样品获得的OTU序列进行物种注释,其中相对丰度大于1%的门水平群落结构分布见图5。从图5可知,鲟鱼籽酱样品在第0天主要优势菌群为变形杆菌门(Proteobacteria),相对丰度为99.15%;贮藏25 d后,主要优势菌群为变形杆菌门(Proteobacteria, 64.71%)、其次还有拟杆菌门(Bacteroidetes, 8.04%)、绿弯菌门(Chloroflexi, 5.78%)、蓝藻门(Cyanobacteria chloroplast, 4.60%)等;贮藏50 d后,主要优势菌群为变形杆菌门(Proteobacteria, 45.07%)、厚壁菌门(Firmicutes, 16.40%),其次还有拟杆菌门(Bacteroidetes, 6.59%)、蓝藻门(Cyanobacteria chloroplast, 4.60%)等。
鲟鱼籽酱贮藏期间微生物群落在属水平的结构分布见表2。从表2可知,鲟鱼籽酱在冷藏期间微生物种类变化较大,贮藏第0 d样品相对丰度大于1%的菌属仅有1属,为嗜冷杆菌属(Psychrobacter),其相对丰度为98.51%;贮藏25 d的样品相对丰度大于1%的菌属有14属,其中相对丰度较高的有鞘脂单胞菌属(Sphingopyxis, 29.51%)、嗜酸菌属(Acidovorax, 3.79%)、假单胞菌属(Pseudomonas, 3.29%)、不动杆菌属(Acinetobacter, 2.76%)和鞘氨醇单胞菌属(Sphingomonas, 2.16%)等;贮藏50 d后相对丰度大于1%的菌属有11属,主要包括类芽孢杆菌属(Paenibacillus, 8.49%)、水杆菌属(Aquabacterium, 6.51%)、鞘氨醇单胞菌属(Sphingomonas, 4.82%)、定殖草螺菌属(Herbaspirillum, 4.55%)、污泥单胞菌属(Pelomonas, 4.16%)、芽孢杆菌属(Bacillus, 3.55%)和苯基杆菌属(Phenylobacterium, 2.37%)等。以上结果表明,鲟鱼籽酱在−2 ℃微冻贮藏期间的主要优势菌群发生了较大的变化,这可能是因为不同菌属对低温的耐受度不同,贮藏一段时间后耐受度较强的菌属逐步形成优势菌,推测这些菌可能对鲟鱼籽酱冷藏后期的腐败变质起重要作用。
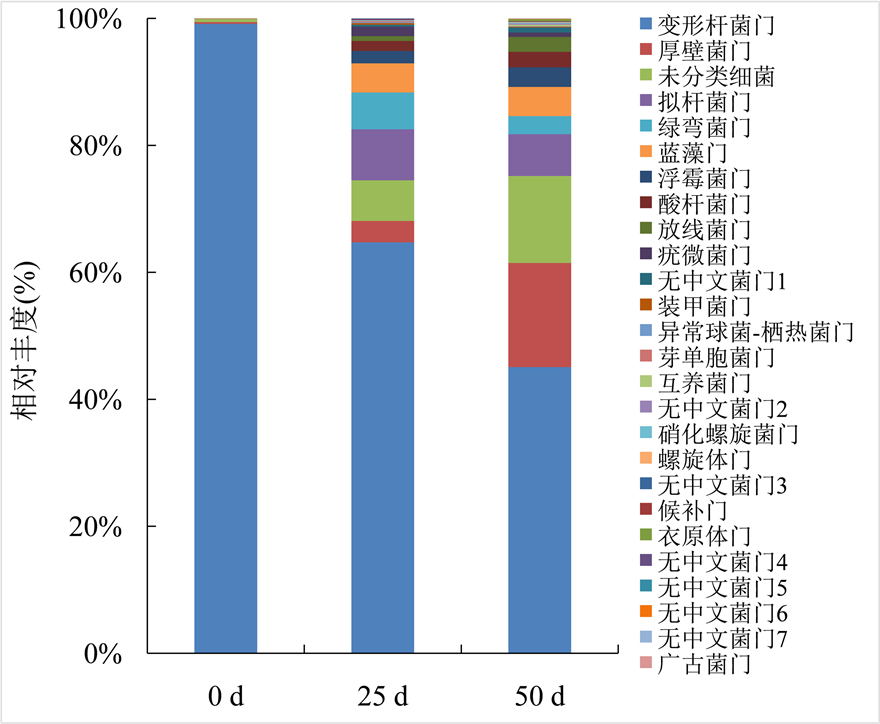 注:无中文菌门1~7分别为Ignavibacteriae、Candidatus saccharibacteria、Candidate division WPS-1、SR1、Parcubacteria、BRC1和Microgenomates。
注:无中文菌门1~7分别为Ignavibacteriae、Candidatus saccharibacteria、Candidate division WPS-1、SR1、Parcubacteria、BRC1和Microgenomates。
Figure 5. Distribution map of the community structure of all samples at phylum level
图5. 鲟鱼籽酱冷藏期间菌群在门水平群落结构分布

Table 2. Relative abundance of microbial flora at the genus level in Sturgeon caviar during cold storage
表2. 鲟鱼籽酱冷藏期间菌群在属水平上的相对丰度
3.7. FAPROTAX功能预测
基于原核分类群功能注释(Functional Annotation of Prokaryotic Taxa,FAPROTAX)分析鲟鱼籽酱在贮藏期间微生物群落的功能注释。FAPROTAX通过整合原核生物类群功能数据库,构建“物种–生态功能分类”的关系网络,包含超过4600多个原核微生物的7600多条功能注释信息,分为80多个功能分组,例如甲烷营养、硝化作用、产甲烷、硫酸盐呼吸、亚硝酸盐呼吸等 [18] 。由图6可知,鲟鱼籽酱贮藏第0 d样品中微生物的功能注释主要是化能异养和好氧化能异养,分别占49.738%和49.732%;贮藏25 d后,化能异养和好氧化能异养分别下降为30.184%和27.924%,同时叶绿体(2.486%)、硝酸盐还原(1.946%)、氮呼吸作用(1.462%)和发酵功能显著增强;贮藏25 d后,化能异养和好氧化能异养分别下降为18.646%和15.839%,同时尿素分解(3.612%)、固氮作用(3.568%)、叶绿体(3.129%)、发酵(2.434%)、氮呼吸作用(1.808%)、亚硝酸盐呼吸(1.280%)、厌氧氨氧化(1.14%)和硝酸盐还原(1.125%)等。以上功能富集变化表明,鲟鱼籽酱贮藏期间化能异养功能减弱,且逐渐从好氧向厌氧转变这可能与包装后氧气量较少有关。此外,鲟鱼籽酱贮藏期间发酵、尿素分解、氮呼吸作用、硝酸盐还原、亚硝酸盐呼吸、厌氧氨氧化等功能显著增强,这可能与贮藏期间N, N-二甲基亚硝胺和亚硝酸盐积累有关,与鲟鱼籽酱贮藏后期微生物菌群多样性增加的结果一致。
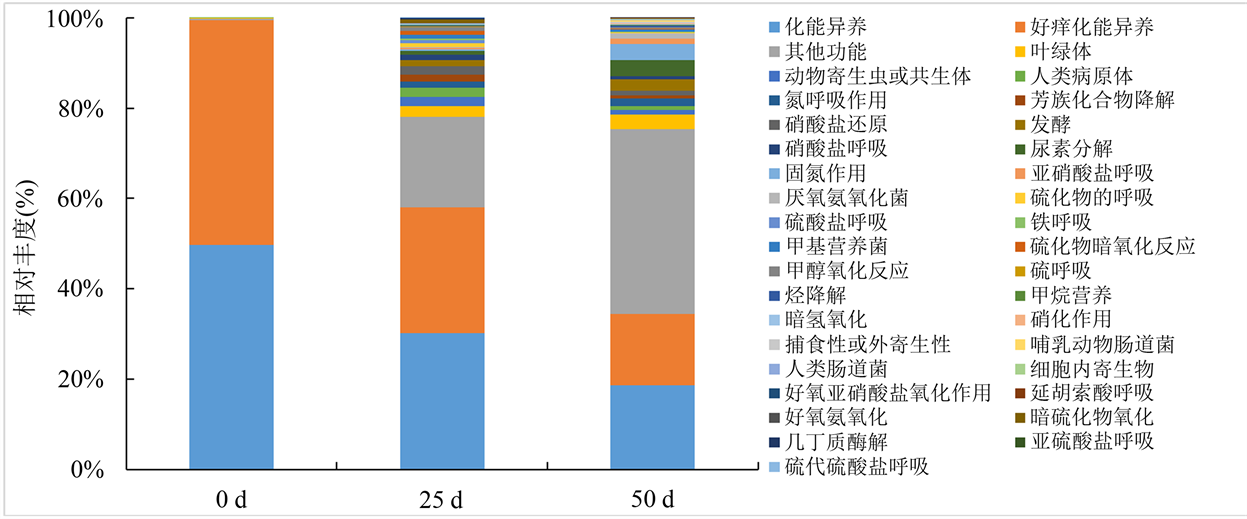
Figure 6. Relative abundance of bacteria function in Sturgeon caviar during cold storage
图6. 鲟鱼籽酱中微生物功能相对丰度
4. 讨论
微生物是影响水产品品质和食用安全性的主要因素,微冻贮藏可延长其货架期。Bahuaud等 [19] 分析了−1.5℃下贮藏的大西洋鲑(Salmo salar)鱼片蛋白酶活性、肌肉组织及质构等指标,发现贮藏4周后的大西洋鲑品质仍然良好;李婷婷等 [20] 研究了在−2℃微冻贮藏条件下,大菱鲆微生物、理化、感官品质的变化,结果表明−2℃贮藏可延长其货架期至20 d;陆寒等 [21] 研究了微冻保鲜(−3℃)贮藏的鳙鱼片在贮藏过程中肌肉品质、pH值、TVB-N值、细菌总数、硬度和弹性等指标的变化,发现与4℃贮藏组相比,微冻保鲜显著(p < 0.05)改善了各项指标的劣变程度。本实验结果也表明,鲟鱼籽酱在−2℃贮藏50 d后没有出现腐败特征,在感官品质上与贮藏第0 d的样品没有显著差异,微冻条件下其货架期可以达到50 d以上。
微生物群落演替对水产品有害物质的积累及其品质也有重要影响。周婷 [12] 测定了0℃下真空包装鲟鱼籽酱不同贮藏期的菌群多样性,结果表明鲟鱼籽酱在贮藏期间的优势菌相互交替,主要包括希瓦氏菌属(Shewanella)、假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)和嗜冷杆菌属(psychrobacter),以及少量的鞘氨醇杆菌属(Sphingobacterium)、寡养单胞菌属(Stenotrophomonas)和不动杆菌(Acinetobacter),这些菌是水产品中常见报道的优势腐败菌属。于渺 [11] 通过16s rDNA及23s rDNA序列分析,发现嗜冷菌为鲟鱼籽酱冷藏过程中的优势腐败菌,且酵母菌对贮藏鲟鱼籽酱品质变化也有较大影响。本实验中,鲟鱼籽酱在第0 d的主要优势菌群为嗜冷杆菌属(Psychrobacter),在−2℃贮藏25 d和50 d后,主要优势菌演变为类芽孢杆菌属(Paenibacillus, 8.49%)、鞘氨醇单胞菌属(Sphingomonas, 4.82%)、芽孢杆菌属(Bacillus, 3.55%)、假单胞菌属(Pseudomonas, 3.29%)和不动杆菌属(Acinetobacter, 2.76%)等,与上述研究结果基本一致。类芽孢杆菌是低温肉制品中常见的腐败菌,在低温西式火腿 [22] 、冷藏狮子头 [23] 、冷藏黄颡鱼 [7] 低温贮藏期中都有较高的相对丰度。此外,本研究中还发现鲟鱼籽酱在−2℃贮藏期间鞘脂单胞菌属(Sphingopyxis, 29.51%)、水杆菌属(Aquabacterium, 6.51%)、定殖草螺菌属(Herbaspirillum, 4.55%)、污泥单胞菌属(Pelomonas, 4.16%)、嗜酸菌属(Acidovorax, 3.79%)和苯基杆菌属(Phenylobacterium, 2.37%)相对丰度显著上升,与上述研究结果有一定差异,这可能与地域、原料、生产加工环境及贮藏温度等不同有关。
值得关注的是,本实验中贮藏25 d的样品中相对丰度大于1%的菌属最多,有14属,其中鞘脂单胞菌属相对丰度为29.51 %,是这一阶段的主要优势菌。鞘脂单胞菌属是海洋贫营养细菌的代表菌,广泛存在于水体、土壤、大气以及极端环境中,其最大的特点是能够耐受贫营养的环境,是一类致病菌,能引起植物根部或动物伤口的感染 [24] ,它们有特殊的代谢调控机制可以通过高效地调整自身的生长速率来抵抗许多不利的环境变化 [25] [26] ,这使其在低温贮藏的鲟鱼籽酱中成为了这一阶段的绝对优势菌,但它并不能长时间耐受−2℃的贮藏环境,在50 d的样品中其相对丰度降低到1.137%,推测鞘脂单胞菌属可能是鲟鱼籽酱短期贮藏的主要腐败微生物。此外,鲟鱼籽酱在贮藏期间水杆菌属、定殖草螺菌属、污泥单胞菌属、嗜酸菌属和苯基杆菌属相对丰度也显著上升,这些菌属在冷冻水产品中报道较少,是否对鲟鱼籽酱品质败坏有主要影响还有待进一步实验证明。
5. 结论
鲟鱼籽酱在−2℃微冻贮藏条件下其货架期可达到50 d以上,感官品质与对照组无显著差异。第0 d时菌落总数为3.08 ± 0.03 lg (CFU/g),在−2℃贮藏25 d后样品菌落总数为3.53 ± 0.02 lg (CFU/g),贮藏50 d后,菌落总数为3.68 ± 0.05 lg (CFU/g),均保持在国家标准规定限值4.70 lg (CFU/g)以下。
鲟鱼籽酱贮藏第0 d样品中菌群结构相对比较单一,主要为嗜冷杆菌属(Psychrobacter),相对丰度达98.651%;贮藏25 d样品中相对丰度大于1%的菌属有14个,鞘脂单胞菌属(Sphingopyxis)是这一阶段的主要优势菌属,相对丰度为29.51%。贮藏50 d样品中相对丰度大于1%的菌属有11个,主要优势菌为类芽孢杆菌属(Paenibacillus)和水杆菌属(Aquabacterium)等,相对丰度分别为8.49%和6.52%。
嗜冷杆菌属(Psychrobacter)、鞘脂单胞菌属(Sphingopyxis)、类芽孢杆菌属(Paenibacillus)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)和不动杆菌属(Acinetobacter)可能是鲟鱼籽酱贮藏期间的主要腐败微生物,在加工贮藏中应予以重点防控。
致谢
感谢国家自然科学基金资助项目(项目编号:50902110)。
参考文献
NOTES
*第一作者。
#通讯作者。