摘要: 目的:本研究旨在探讨芦丁在急性软组织损伤治疗中的潜在作用。方法:分别使用人成纤维细胞(HFF-1)和成肌细胞(C2C12)通过划痕法和D-半乳糖法建立了体外损伤模型。实验分成三组:空白组,模型组(进行损伤造模),以及芦丁组(芦丁预处理)。我们采用ELISA检测了不同组细胞上清液中IL-1β、IL-6和PGE-2的表达水平。此外,我们还评估了芦丁的细胞毒性和对细胞增殖活性的影响。结果:芦丁在浓度为10,20 μmol/L时对HFF-1和C2C12细胞的增殖活性无明显影响,而80 μmol/L的浓度明显抑制了细胞增殖。ELISA检测结果显示,相对于模型组,芦丁组降低了损伤细胞中IL-1β、IL-6和PGE-2的表达水平。结论:本研究表明,芦丁对急性软组织损伤具有潜在的治疗作用。芦丁能够降低损伤细胞中炎症因子的表达水平,减轻炎症反应,促进软组织的修复。
Abstract:
Objective: This study aims to investigate the potential role of Rutin in the treatment of acute soft tissue injuries. Methods: In vitro injury models were established using human fibroblast cells (HFF-1) and myoblast cells (C2C12) through scratch and D-galactose methods, respectively. The ex-periments were divided into three groups: the blank group, the model group (injury modeling), and the Rutin group (Rutin pretreatment). ELISA was employed to detect the expression levels of IL-1β, IL-6, and PGE-2 in the supernatant of cells from different groups. Additionally, the cytotoxicity of Rutin and its impact on cell proliferation were assessed. Results: Rutin at concentrations of 10 and 20 μmol/L had no significant effect on the proliferation of HFF-1 and C2C12 cells, while a concentra-tion of 80 μmol/L significantly inhibited cell proliferation. ELISA results showed that, compared to the model group, the Rutin group reduced the expression levels of IL-1β, IL-6, and PGE-2 in injured cells. Conclusion: This study suggests that Rutin may have a potential therapeutic effect on acute soft tissue injuries. Rutin can reduce the expression levels of inflammatory factors in injured cells, alleviate the inflammatory response, and promote tissue repair.
1. 引言
急性软组织损伤是一种临床最为常见的运动损伤,指的是外界暴力直接或间接作用于机体,导致局部皮肤、筋膜、肌肉韧带、滑膜、肌腱等软组织受损。这类损伤常在受创部位引起疼痛、肿胀、皮肤青紫或瘀斑、肢体活动障碍等症状 [1] [2] ,其病理本质为局部急性炎症和组织修复。近年来,随着人们运动的需求不断增加,急性软组织损伤的发病率呈逐渐上升的趋势。为了缓解患者的症状,目前临床上主要采用口服非甾体类抗炎药,这类药物能够减轻炎症反应,但也有损害肝肾功能及胃肠道功能的潜在风险 [3] [4] 。
芦丁是一种重要的黄酮醇,又称为芸香苷、槲皮素-3-芸香苷和槐苷,被广泛发现于多种植物,如西番莲、荞麦、茶叶以及苹果中 [5] 。大量研究显示 [6] [7] [8] ,芦丁可抑制多种炎症因子,如IL-1β、IL-6、TNF-α、PGE-2的上调,表现出明显的抗炎及修复作用。本研究根据目前对急性软组织损伤的认识和芦丁具有抗炎修复的最新研究进展,利用划痕法及D-半乳糖法建立体外损伤模型,通过体外培养人成纤维细胞(HFF-1)及成肌细胞(C2C12),观察芦丁对损伤造模细胞分泌IL-1β、IL-6、PGE-2 的影响,探讨芦丁对软组织损伤的治疗效果。
2. 材料和方法
2.1. 试剂与材料
人成纤维细胞(HFF-1)及成肌细胞(C2C12) (中桥新洲生物科技有限公司)、芦丁(纯度 ≥ 98%,杰士康科技有限公司)、胎牛血清、低糖DMEM、PBS缓冲液(均购自Gibco公司)、CCK8试剂盒(碧云天)、DEPC超纯水(Takara)、Elisa试剂盒(深圳市优品生物科技有限公司)。
2.2. 主要仪器
倒置显微镜(OLYMPUS)、单加热型恒温金属浴(上海沪析)、细胞培养箱(Thermo Fisher)、台式高速微量冷冻型离心机(SCILOGEX)、酶标分析仪(德铁)、药品阴凉柜(博津)、低速台式离心机(山东百欧)。
2.3. 实验方法
2.3.1. 细胞培养
从液氮中取出HFF-1、C2C12细胞冻存管,立即置于37℃~40℃温水中迅速晃动,直至冻存液完全溶解;将细胞悬液转移至离心管内,加入约5 mL培养基,轻轻吹打混匀;细胞悬液800~1000 r/min离心5 min,弃上清夜;于细胞沉淀内加入完全培养基,轻轻吹打混匀;将细胞悬液转移至培养瓶内,补足培养基进行培养。细胞达到80%~90%汇合后进行传代。每2 d补充一次培养基。
2.3.2. CCK-8法筛选药物单体最佳浓度
选取第3代对数生长期的成纤维细胞及肌肉细胞,离心稀释吹打配制成细胞浓度为2 × 107 L−1的均匀单细胞悬液,将其接种于96孔板中,每孔细胞悬液100 μL,每组设4个复孔,孔板周围加PBS 100 μL保持湿度,放入CO2培养箱中培养,24 h后细胞贴壁进行换液,弃去96孔板中的培养基,实验各孔加入DMEM培养液配制的不同质量浓度的药物单体溶液,每孔100 μL,质量浓度分别为10,20,40,80,160 mg/L;对照各孔继续加完全培养液100 μL,以只加培养液的孔为空白组,继续放至CO2培养箱中培养,24 h后取出,每孔加入10 μL CCK-8试剂(Cell Counting Kit-8),于CO2孵箱中避光孵育1 h,用酶标仪在450 nm波长处检测各组细胞的吸光度值,取4个孔平均值。
2.3.3. 细胞分组
采用划痕法及D-半乳糖法对细胞进行损伤造模,将正常的HFF-1、C2C12细胞分为3组,空白组(未对细胞进行操作)、模型组(对细胞进行损伤造模,划痕法:将细胞接种于6孔板,吸出上清,用20 μL枪头在培养皿底部平行划三道直线痕(每道划痕间距为5 mm)造成机械损伤。PBS液清洗3遍以去除损伤的细胞碎片,添加新鲜培养基继续培养72小时并进行后续实验。D-半乳糖法:将细胞以1 × 105/mL细胞密度分别接种于6孔板中,37℃、5% CO2恒温培养箱中培养24 h后弃去培养基,模型组加入含0.25 mol/L D-半乳糖的完全培养基培养72小时并进行后续实验),芦丁组:在模型组的基础上加入适宜浓度的芦丁培养24小时并进行后续实验。
2.3.4. 酶联免疫吸附法检测IL-1β、IL-6、PGE-2
各组细胞按照上述2.3.3进行分组处理。孵育24 h,收集细胞上清液离心,2500 r/min离心10 min。再取上清,分别利用IL-1β、IL-6、PGE-2试剂盒采用酶联免疫吸附法检测其水平。
2.3.5. 统计学分析
所有数据采用GraphPadPrism7.0统计学软件进行分析。数据均以均数±标准差(Mean ± SD)形式表示。组内前后比较用配对样本T检验,组间比较用单因素方差分析,P值 < 0.05为差异具有统计学意义。
3. 结果
3.1. 芦丁的细胞毒性及对损伤的HFF-1、C2C12细胞增殖活性的影响
不同浓度芦丁对细胞毒性的影响见图1,结果显示,10,20,40 μmol/L的芦丁对HFF-1、C2C12细胞增殖无影响,而80 μmol/L的芦丁则明显表现出抑制细胞增殖。故后续试验采用了20 μmol/L作为预处理浓度。
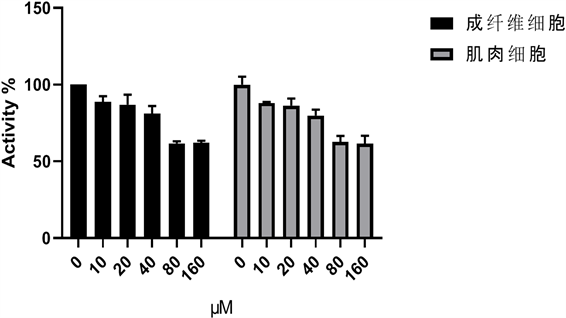
Figure 1. Effect of different concentrations of Rutin on cytotoxicity
图1. 不同浓度芦丁对细胞毒性的影响
3.2. ELISA检测HFF-1、C2C12细胞上清液中IL-6、IL-β及PGE-2的表达
芦丁对HFF-1、C2C12细胞中IL-6、IL-β及PGE-2的影响见图2,ELASA检测结果显示,相较于对照组,HFF-1和C2C12模型组细胞中的IL-6、IL-β及PGE-2的表达水平均显著升高,相较于模型组,芦丁组可降低损伤细胞中的IL-6、IL-β及PGE-2的水平。
4. 讨论
现代医学研究表明,在闭合性软组织损伤发生后,组织会经历一系列生理变化,包括细胞死亡、出血和凝血等 [9] 。随后,这些变化会引发炎症反应,表现为红肿、淤血、疼痛以及行动能力降低等临床症状。这种炎症反应与组织损伤密切相关。而在这一炎症过程中,细胞产生了一些关键的生物分子,如PGE-2、IL-1β和IL-6。PGE-2是花生四烯酸代谢途径的产物,它可以与趋化因子协同作用,增强血管通透性,引来中性粒细胞,导致发热和疼痛,从而促进炎症损伤的发生 [10] 。IL-1β是炎症反应过程中的一个关键介质。在组织受损后,它的浓度会在炎症部位和脊髓水平显著增加 [11] 。此外,IL-1β还可以诱导其他促炎因子的释放,从而促进和维持炎症反应,导致炎性疼痛的发生 [12] 。IL-6则促进了炎症介质传递和细胞因子产生 [13] ,加剧了组织受损的程度。相关研究发现,芦丁能够调节IL-1β、TNF-α的表达,冯龙华 [14] 等发现芦丁可降低LPS诱导的急性肺损伤小鼠组织中TNF-α及IL-1β含量,并可增加肺泡上皮钠通道蛋白表达,有效保护了LPS所致的小鼠急性肺损伤;岳朝驰 [15] 等发现芦丁可改善葡聚糖硫酸钠诱导的溃疡性结肠炎小鼠的临床症状,降低小鼠血清和结肠组织中IL-1β和IL-18的表达,抑制黏膜炎症损伤;杨馥宇 [16] 等研究发现芦丁水溶液有效降低糖尿病视网膜病变大鼠视网膜组织中IL-6、STAT3的过度表达,并有助于减轻糖尿病视网膜病变大鼠免疫炎症反应。
在本次实验中,芦丁有效降低损伤造模HFF-1、C2C12细胞中PGE-2、IL-6和IL-β的表达水平,降低损伤造成的炎性反应,减少软组织炎症细胞浸润,改善了炎症引起的损伤,以促进细胞及组织的修复。虽然芦丁能够降低损伤细胞中炎症因子的表达,但是在这次实验中,我们对芦丁给药浓度的设计较局限,未来我们将更加精确地选择适当的药物浓度梯度进行实验,并进一步探究芦丁可能通过何种通路以抑制急性软组织损伤的炎症反应。
综上所述,芦丁对急性软组织损伤有一定的治疗和预防作用,在病程中可减少损伤造模HFF-1、C2C12细胞中IL-1β、IL-6、PGE-2的释放,抑制炎症反应,对急性软组织损伤的治疗可能具有潜在的价值。