1. 引言
电解水制氢工艺具有制备过程简单、效率高等特点,日益受到重视。不锈钢材料廉价易得,且含有典型的催化活性元素如铁、镍,近年来成为催化剂领域关注的一类材料 [1] [2] [3] [4] 。但是,不锈钢表面致密的富铬钝化层通常表现出相对的化学惰性,一定程度上抑制了铁镍元素高催化活性的展现,因此基于不锈钢基材进行表面改性制备水分解电极的研究越来越多,开发简单易行的改性制备方法对于实现用于水分解的高效不锈钢基电催化剂材料的制备具有重要意义。
研究发现,通过电化学氧化、化学氧化或两者结合对不锈钢材料进行原位处理可以提高其催化活性 [5] [6] [7] ,目前普遍认同氧化过程中Cr、Fe元素优先溶解,从而获得较高催化活性的富镍催化层。但现有研究中氧化处理时间均小于18 h,且大多主要局限于析氧(OER)催化性能,很少涉及析氧/析氢(HER)双功能催化性能的探讨。本文进一步简化水热介质成分,由2 M NaOH水溶液为介质通过一步水热法对316 L不锈钢进行高温水热氧化,并将处理过程延长至较长时间(9~36 h),制备得到了具有双层膜结构的OER/HER双功能催化层,研究了催化电极在不同氧化时间条件下的电催化性能,结合微观分析结果对基材组成的影响以及相关催化原理进行了分析。
2. 实验部分
2.1. 水热处理实验
将316 L不锈钢剪切为10 × 15 mm大小的电极,由320目砂纸进行打磨,蒸馏水清洗,之后由无水乙醇超声5 min。取出试样吹干,置于1 M的盐酸中进行5 min的酸洗活化处理,随后由去离子水清洗,置于高压釜内进行水热氧化实验。
采用四氟乙烯内衬不锈钢高压釜作为反应容器,2 M NaOH碱性溶液作为氧化剂,在180℃条件下分别反应9 h、18 h、27 h、36 h后,关闭高温烘箱电源,冷却至室温,取出由去离子水、无水乙醇清洗后冷空气吹干即得到催化电极。
2.2. 电化学测试
采用三电极体系,由上海辰华CHI660e电化学工作站分别对催化电极进行HER及OER反应的催化活性表征测试,其中甘汞电极为参比电极,铂电极为对电极,水热处理后的不锈钢样品为工作电极,电解质溶液为1 M KOH溶液,电极与溶液接触面积为1 × 1 cm2。测试内容主要包括线性伏安扫描和电化学阻抗测试。线性扫描伏安法(LSV)测试中扫描速率为5 mV·s−1并进行95%的IR补偿。测试电位通过E (RHE) = E (Hg/HgO) + 0.098 V + 0.059 × PH计算。电化学阻抗谱(EIS)测试频率范围为100 kHz~0.1 Hz,交流信号振幅为5 mV。
2.3. 微观分析
采用JSM6510LV扫描电子显微镜(SEM)和能谱仪进行表面形貌观察,由Thermo Fisher Scientific Escalab X射线光电子能谱(XPS)进行成分分析。
3. 结果与讨论
3.1. 析氢性能分析
对316 L不锈钢基材于2 M NaOH溶液中水热氧化处理不同时间后获得一系列SS316L-SH-X (X = 9/18/27/36 h)电极材料。图1(a)为SS316L-SH-X电催化材料在HER过程中测得的LSV图。结合图1(b)可知随着水热处理时间延长,10和100 mA·cm−2电流密度下对应的过电位η10和 η100逐渐降低,其中,SS316L-SH-36电催化材料对应的η10和η100最小,分别为123和248 mV。但SS316L-SH-27与SS316L-SH-36过电位的差值较小,在10 mV范围内。同时,如图1(c)和图1(d)所示,还观察到随着反应时间延长,SS316L-SH-X电催化材料的塔菲尔斜率以及EIS测试中电荷转移电阻Rct值也逐渐变小。此外,S316L-SH-27和SS316L-SH-36的塔菲尔斜率以及阻抗值差距也较小,这和前面极化曲线的测试结果基本保持一致。说明水热反应27 h后,SS316L-SH-X电催化材料的HER性能已趋于稳定,整体性能36 h水热反应对应的样品最佳。
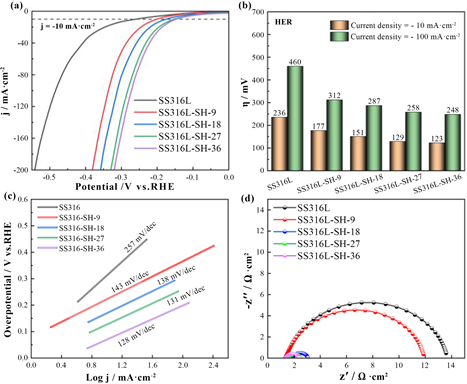
Figure 1. HER performance of catalytic electrodes: (a) LSV curve; (b) Overpotential; (c) Tafel slope; (d) EIS spectra
图1. 催化电极HER性能:(a) LSV曲线;(b) 过电位;(c) 塔菲尔斜率;(d) EIS谱图
3.2. 析氧性能分析
图2(a)为SS316L-SH-X电催化材料OER反应过程中测得的LSV图,结合图2(b)过电位柱状图可知,随水热处理时间延长,OER反应的过电位η10和η100也呈现逐渐降低的趋势,其中,SS316L-SH-36电催化材料对应的η10和η100最小,分别为258和335 mV。结合图2(c)塔菲尔斜率以及图2(d)的EIS谱图可知,塔菲尔斜率以及电化学阻抗的变化也显示一致的趋势:随水热时间延长,塔菲尔斜率以及电荷转移电阻Rct值都逐渐减小。同样比较27 h和36 h样品,有反应时间超过27 h后,性能变化趋于平缓的趋势,整体性能36 h水热反应试样最佳,与HER性能变化规律取得一致。
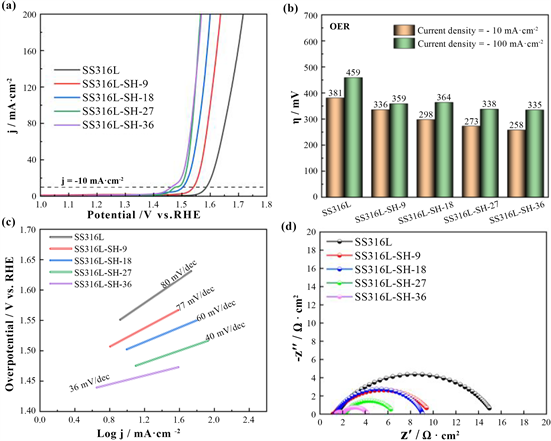
Figure 2. OER performance of catalytic electrodes: (a) LSV curve; (b) Overpotential; (c) Tafel slope; (d) EIS spectra
图2. 催化电极OER性能:(a) LSV曲线;(b) 过电位;(c) 塔菲尔斜率;(d) EIS谱图
3.3. 表面形貌观察
图3为SS316L-SH-X电催化材料表面测得的扫描电子显微镜(SEM)图;由图3(a~d)可见,316 L不锈钢在2 M氢氧化钠溶液中水热反应后得到的样品表面均生长出不规则形状的微米级晶体。对图3(a)中无微米级颗粒沉积表面区域进一步放大得到的形貌如图3(e)、图3(f)所示,可见水热处理9 h时除生成微米级晶粒,底层还有较为致密的纳米级晶粒氧化膜。随水热反应时间延长,氧化膜逐渐增厚,表面的微米级晶粒也逐渐增多,在达到27 h反应时间后,微米级产物晶粒已基本完全覆盖底层的纳米级产物层,此时开始形成完整的双层膜结构:由底层纳米晶催化层和顶层微米晶催化层两层构成。继续反应至36 h时,膜的结构变化不再明显,这与前面电化学性能的变化取得一致趋势,即27 h反应时间之后,处理试样的电化学性能变化已趋于平缓趋势,到36 h以后性能仅略有优化。

Figure 3. SEM images of catalytic electrodes: (a, e, f) SS316L-SH-9; (b) SS316L-SH-18; (c) SS316L-SH-27; (d) SS316L-SH-36
图3. 催化电极表面SEM图:(a, e, f) SS316L-SH-9;(b) SS316L-SH-18;(c) SS316L-SH-27;(d) SS316L-SH-36
3.4. XPS分析
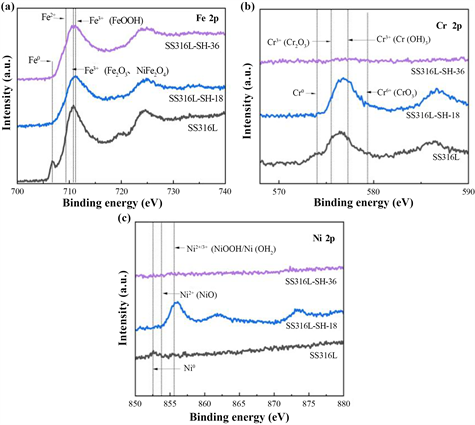
Figure 4. XPS spectra of catalytic electrodes: (a) Fe 2p; (b) Cr 2p; (c) Ni 2p
图4. 催化电极XPS图谱:(a) Fe 2p;(b) Cr 2p;(c) Ni 2p
对空白316 L,SS316L-SH-18和SS316L-SH-36电极进行XPS测试,得到的XPS能谱图如图4所示。由Fe 2p图谱可知,水热处理后,Fe0的特征峰明显减弱,并且铁元素以铁的氧化物(Fe2O3)及羟基氧化物(FeOOH)形式存在。结合能处于856 eV的Ni 2p特征峰在空白316 L不锈钢水热反应至18 h期间先增强,水热氧化36 h后变得很微弱,则说明氧化前期主要生成富镍氧化层,而随着时间延长至氧化后期,由于大量铁元素溶解至电解质中,在碱性环境下又以氢氧化物以及氧化物的形式沉积于表面,导致氧化后期表面富集铁元素,而镍元素含量降低,由此分析可知水热氧化前期主要生成富镍纳米晶氧化膜,后期则逐渐生成富铁微米晶催化层顶层从而形成双层膜结构。另外SS316L-SH-36电催化材料的Cr 2p特征峰变得极其微弱,说明对不锈钢进行水热处理的过程中,铬元素发生了溶解,由于铬元素的溶解破坏了不锈钢表层富铬钝化膜的保护作用,增加了不锈钢中镍以及铁的化学反应活性,从而生长得到高催化活性的氧化层。
结合SEM与XPS分析结果可见,对316 L不锈钢进行较长时间的氧化处理(≤ 36 h),富镍催化层的形成主要在氧化前期,后期继续延长处理时间,则进一步生成富铁微米晶催化层,从而得到富镍纳米晶/富铁微米晶的双层异质结构催化层,该类双层结构可进一步提高电极的催化性能。
4. 结论
1) 316 L不锈钢基材在180℃的2 M NaOH溶液中水热氧化处理后,得到的电极HER以及OER催化活性相对于不锈钢基材均有显著提高。36 h水热反应制备得到的SS316L-SH-36催化电极,在HER及OER反应中,对应于10 mA/cm2电流密度下的过电位分别为123 mV与258 mV,有望应用于工业化电解水制氢。
2) 微观分析结构表明,316 L不锈钢表面在水热氧化前期主要生成富镍纳米晶氧化膜,后期则逐渐生成富铁微米晶催化层顶层从而形成双层膜结构。27 h以后已经形成较为完整的双层膜结构,因此催化性能的改变在此后趋于平缓,继续氧化至36 h,电极的HER及OER催化性能仅有较小幅度的进一步优化。