1. 引言
白酒作为中国传统的酒类,具有悠久的历史和独特的酿造工艺 [1] 。我国白酒的种类繁多,其中浓香型白酒具有芳香浓郁、香味协调等特点 [2] [3] ,占中国每年白酒产量的70%以上 [4] ,深受人们喜爱。浓香型白酒窖泥是富含微生物的有机质,其中包括各种有益菌和酵母菌。在酿造过程中,这些微生物相互作用,形成复杂的微生态系统。这些细菌、古菌群落,如己酸菌在微生物酯化酶的作用下形成脂 [5] 、乳酸菌参与各种能量与物质循环 [6] ,形成香味主体成分,影响白酒的风味。因此窖泥是酿造浓香型白酒的基础,而窖泥的质量直接关系到酒的品质。
随着厌氧菌培养技术以及测序技术的发展,学者们开始从微生态的角度研究窖泥微生物群落 [7] [8] 。窖泥处于特殊厌氧环境,大部分细菌属于厌氧菌如:产己酸菌、产甲烷菌、乳酸菌,采用厌氧技术分离培养,可以丰富窖泥可培养微生物资源 [9] [10] 、科学养护窖泥保持窖泥的稳定与平衡 [11] 。高通量测序技术(high-throughput sequencing)因具有准确、快速、高效等特点被广泛应用。通过该技术和生物信息学分析,促进了窖泥微生物群落多样性的分析。
郎酒产自四川省泸州市,是川酒中浓香型代表之一,具有“香、醇、浓、绵、甜、净” [12] 的特点。目前,有对浓香型白酒窖泥中微生物群落结构与多样性分析的研究 [13] [14] ,但是大多数未对可培养微生物分析,且有些采用的DGGE法 [15] ,具有局限性,针对窖泥中古菌的研究较少。本文采用先进厌氧培养技术和Illumina PE250测序法对窖泥研究,从可培养细菌以及细菌和古菌多样性结构层次分析比较菌群结构,为窖泥微生物菌种资源的认识和开发利用以及白酒提质增香提供参考。
2. 材料与方法
2.1. 实验材料
样品及材料:窖泥样品由郎酒股份有限公司提供,窖泥均采集新窖泥、老窖泥、窖泥内、窖泥外、新批次窖泥样品,编号分别为WN、WO、WI、WE、PT (其中WN、WO、WI、WE为一个批次,PT为另一批次)。
试剂及耗材:细菌基因组DNA提取试剂盒,北京天根生化科技有限公司;无水乙醇,重庆川东化工有限公司;Marker LDL200,日本Takara;琼脂糖,上海生工生物工程股份有限公司;Gold View核酸染料,北京赛百盛基因技术有限公司;Axyprep DNA凝胶回收试剂盒,AXYGEN公司。
2.2. 实验仪器
主要仪器有EG200厌氧工作站、T100TMThermal型PCR仪、SIGMA 1-14离心机、NanoPhotometer®N50超微量分光光度计、Quanti FluorTM-ST蓝色荧光定量系统等。
2.3. 窖泥可培养微生物的分离和鉴定
实验在厌氧平台N2/H2/CO2 (95:2:3)进行,在10毫升无菌水的离心管中加入1克窖泥,充分混匀并放置1 h析出上清。在无菌水中梯度稀释后,均匀涂布PYG培养基琼脂平板上,37℃孵育2天。挑取单菌落在平板上纯化三次。通过16S rDNA基因测序和EzBioCloud细菌鉴定服务,对菌株进行物种水平的鉴定。
2.4. 高通量测序
送至上海生工生物工程股份有限公司,利用Illumina PE250平台测序。细菌的16S rRNA定制扩增引物为338F (5'-AGAGTTTGATCCTGGCTCAG-3')和806R (5'-TGCTGCCTCCCTAGGAGT-3'),古菌扩增引物为Arch344F (5'-ACGGGGYGCAGCAGGCGCGA-3')和Arch915R (5'-GTGCTCCCCCGCCAATTCCT-3')扩增V3-V4可变区。高通量测序及序列分析步骤具体参照文献进行 [16] 。
2.5. 数据处理
对测序原始数据参照文献进行处理 [17] 。
3. 结果与分析
3.1. 窖泥中可培养微生物多样性
从窖泥样品中共分离出96株菌,通过16S rDNA序列分析鉴定出1个门水平,其中54株(56.3%)梭菌属,37株(38.5%)乳酸菌属,5株(5.2%)属于芽胞杆菌属。在54株梭菌属中,有9种不同的菌种,其中Clostridium tyrobutyricum共18株,占32.1%,其次Clostridium amylolyticum和Clostridium diolis各8株,占14.3%;Clostridium butyricum共7株,占12.5%;Clostridium beijernckii共5株,占8.9%;Clostridium guangxiense共4株,占7.1%。具体见表1:

Table 1. Statistical table of strains for separation and identification in cellar mud
表1. 窖泥分离鉴定菌株统计表
3.2. 窖泥中细菌群落多样性
3.2.1. OUT划分与分析
OTU (Operational Taxonomic Units)是测序序列按97%的相似度进行归类和OTU划分,进行比对后获得每个OTU所对应的分类学信息。根据我们研究的5个样本OTU划分结果,绘制Venn图,见图1。5种窖泥的细菌群落结构存在显著差异,独有OTU占比分别为:新窖泥16.3%,老窖泥27.7%,窖泥内13.3%,窖泥外20.2%,最新批次窖泥32.1%,这可能是窖泥产浓香型白酒品质差异的原因。其中窖泥内和窖泥外的相似性更高,说明窖泥不同位置微生物差异较大。

Figure 1. Distribution of OTUs in a Venn diagram
图1. OTU分布Ven图
3.2.2. 窖泥细菌微生物物种群落Alpha多样性分析
Alpha多样性分析是指特定环境或生态系统内的多样性,主要用来反应微生物菌落的丰度和多样性。表2中汇总了5个样品细菌微生物多样性的指数,其中最新批次窖泥微生物多样性较高。老窖泥和新窖池窖泥样品物种丰度(Chao指数)分别为364.08、301.68,物种多样性(Shannon指数)分别为3.2022、3.218,结果与黄润娜 [18] 和周文 [19] 一致。窖泥内和窖泥外物种丰度(Chao指数)分别为384.04、462.26,物种多样性(Shannon指数)分别为2.4867、3.2073。最新批次窖泥的Chao指数和Shannon指数均高于其他四种窖泥。其余四种窖泥中,窖泥外Chao指数和Shannon指数明显高于窖泥内,可能是外层空气接触多,有利于环境微生物的吸附和生长。

Table 2. Index of bacterial microbial diversity in cellar mud
表2. 窖泥中细菌微生物多样性指数表
3.2.3. 窖泥细菌微生物物种群落Beta多样性分析
PLS-DA (Partial Least Squares Discriminant Analysis),即偏最小二乘法判别分析,是多变量数据分析技术中的判别分析法,经常用来处理分类和判别问题。采用该方法分析结果见图2,PLS-DA图中X轴的差异可解释全面分析的26.1%,Y轴的差异可解释全面分析的18.08%,累计为44.18%,说明这两个主成分可以解释44.18%的信息。窖泥内和窖泥外分布在一、二象限,最近批次窖泥分布在第三象限,老窖泥和新窖泥样品分布在第四象限。由此可见,新窖泥和老窖泥样品与窖泥内和窖泥外在空间排布上呈现出明显的区分,说明这两种窖泥细菌群结构存在差异。

Figure 2. PLS-DA based on OUT level
图2. 基于OUT水平的PLS-DA
3.2.4. 窖泥细菌微生物群落组成
5个样本在门水平细菌群落结构中(图3),新窖泥和老窖泥优势门是厚壁菌门(Firmicutes) (图4),窖泥内和窖泥外优势门是放线菌门(Actinobacteria) (图5),最近批次中厚壁菌门比放线菌门略多。在属水平细菌群落结构中(图6),新窖泥优势属是丁酸菌属和己酸菌属(Clostridium, Caproiciproducens),老窖泥优势菌属是互营乙酸氧化菌属(Syntrophaceticus),窖泥内优势菌是棒状杆菌属和奇异菌属(Corynebacterium, Atopobium),窖泥外优势菌是棒状杆菌属和乳酸杆菌属(Corynebacterium, Lactobacillus) (图7),最近批次中物种较为丰富且有很多未被注释到的菌属。其中己酸菌属是浓香型生产中非常重要的产酸微生物 [20] ,由它代谢产生的己酸与大曲发酵产生的酒精生成己酸乙酯,是浓香型曲酒的主体香成分。己酸菌培养液可应用于窖池保养、人工窖泥培养等可改善和提高浓香型白酒的质量 [21] 。乳酸菌产生有机酸,降低发酵体系pH值,为其他细菌提供适宜生长环境,抑制杂菌生长 [22] 。乳酸菌产生乳酸对酒有缓冲功能,减少酒体刺激感、增加酒体回甜感和浓厚感。由此可知,己酸菌属和乳酸菌属是窖泥中重要的微生物。
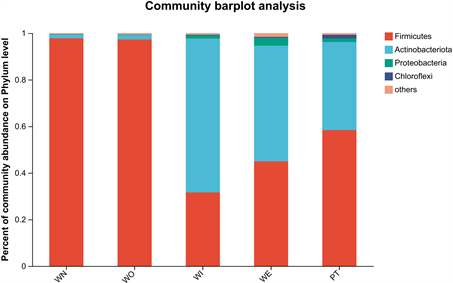
Figure 3. Bacterial colony composition (phylum level)
图3. 细菌菌落组成(门水平)
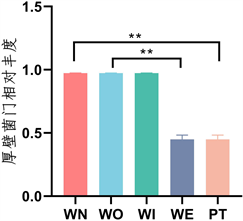
Figure 4. Relative abundance of Firmicutes
图4. 厚壁菌门相对丰度
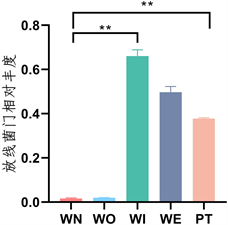
Figure 5. Relative abundance of Actinomycetes
图5. 放线菌门相对丰度
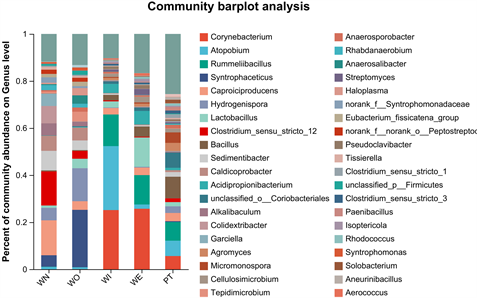
Figure 6. Bacterial community composition (genus level)
图6. 细菌群落组成(属水平)

Figure 7. Relative abundance of bacteria at genus level
图7. 细菌属水平相对丰度
3.3. 窖泥中古菌群落多样性
3.3.1. OUT划分与分析
5种窖泥的古菌群落结构差异不明显,独有OTU占比分别为:新窖泥14.0%,老窖泥4.7%,窖泥内7.8%,窖泥外80.2%,最新批次窖泥16.1%,其中窖泥外古菌总OUT数量较多。由此看出窖泥中古菌多样性与窖龄呈负相关,这与邓杰 [23] 研究相同,各窖龄段窖泥中古菌群落影响最大的环境因子各不相同,这可能发酵产酒存在差异的原因之一(见图8)。
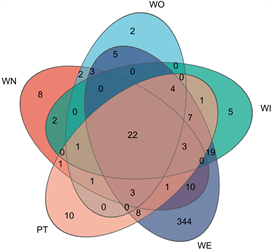
Figure 8. Distribution of OTUs in a Venn diagram
图8. OTU分布Ven图
3.3.2. 窖泥古菌微生物物种群落Alpha多样性分析
由表3可知,5个样品古菌微生物多样性的指数中窖泥外古菌微生物多样性最高。老窖泥和新窖池窖泥样品物种丰度(Chao指数)分别为43.25、54.48,物种多样性(Shannon指数)分别为1.1371、1.1696。窖泥内和窖泥外物种丰度(Chao指数)分别为60.72、263.38,物种多样性(Shannon指数)分别为0.1840、0.8131。最新批次窖泥的Chao指数为55.15、Shannon指数为0.4363。有意思的是窖泥外Chao指数明显高于其余四组,但是Shannon指数最高的是新窖泥,这结果说明窖泥质量和窖泥老化存在关系。

Table 3. Microbial diversity index of medieval bacteria in cellar mud
表3. 窖泥中古菌微生物多样性指数表
3.3.3. 窖泥细菌微生物物种群落Beta多样性分析
采用PLS-DA方法分析结果见图9,PLS-DA图中第一主成分解释占全面分析的85.23%,第二主成分解释占全面分析的4.17%,累计为89.4%,说明这两个主成分可以解释89.4%的信息。新窖泥和老窖泥分布在第一象限,窖泥内和最近批次窖泥分布在第四象限,窖泥外分布在第二、四象限。由此可见,窖泥外在空间排布上呈现出明显的区分,说明窖泥外细菌群结构存在差异。
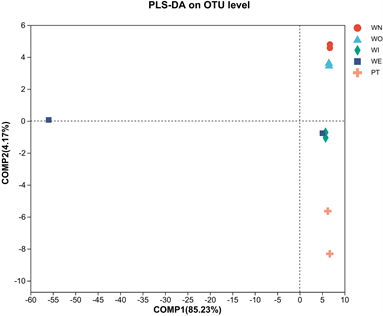
Figure 9. PLS-DA based on OUT level
图9. 基于OUT水平的PLS-DA
3.3.4. 古菌群落组成
在古菌群落门水平结构中(图10),新窖泥丰度较高的是广古菌门(Euryarchaeota) (图11),老窖泥中是盐杆菌门(Halobacterota) (图12),窖泥内、窖泥外、最近批次窖泥广古菌门占比最高。在古菌群落属水平结构中(图13),新窖泥丰度较高的是甲烷杆菌属(Methanobacterium),老窖泥丰度较高的是甲烷囊菌属、甲烷短杆菌属(Methanoculleus, Methanobrevibacter),窖泥内、最近批次、窖泥外优势菌是甲烷短杆菌属(Methanobrevibacter)。但窖泥外除优势菌外不可培养古菌次之(图14),窖泥内和窖泥外为古菌组成相似,但丰度存在差异。老窖泥与新窖泥相比,老窖泥甲烷囊菌属(Methanoculleus)更为丰富。因此可以看出甲烷短杆菌属和甲烷囊菌属是构成浓香型白酒的主要古菌属。甲烷菌在窖泥中发挥重要作用,催化H2和CO2产生甲烷 [24] ,从而解除了H2对酸代谢的反馈抑制作用,提高浓香型白酒主要香味成分。
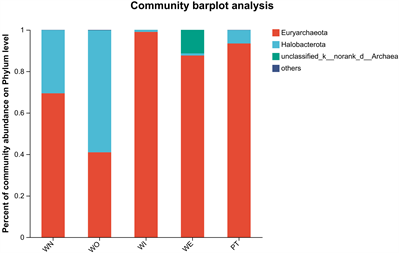
Figure 10. Composition of archaea community (phylum level)
图10. 古菌群落组成(门水平)
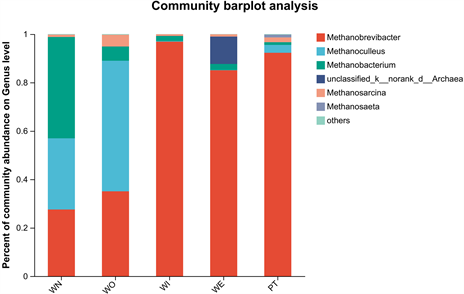
Figure 13. Composition of archaea community (genus level)
图13. 古菌群落组成(属水平)
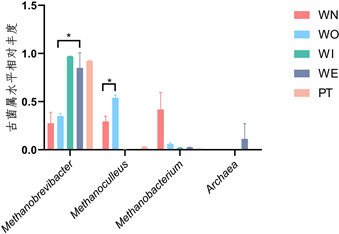
Figure 14. Relative abundance of archaea at genus level
图14. 古菌属水平相对丰度
4. 结果与讨论
窖泥采用厌氧分离技术共鉴定出96株,其中54株(56.3%)梭菌属,37株(38.5%)乳酸菌属,5株(5.2%)属于芽胞杆菌属。Illumina PE250测序发现,在新窖泥、老窖泥、窖泥内、窖泥外和最近批次窖泥5个样品中,最近批次窖泥样品的细菌和古菌群落结构与多样性略多,其中可划分OUT数相差较大,细菌群落最多的是最近批次窖泥,最少的是窖泥内;古菌群落最多的是窖泥外,最少的是老窖泥。细菌多样性门水平上优势菌门是厚壁菌门,古菌门水平上是广古菌门。老窖泥中优势菌属是互营乙酸氧化菌,优势古菌属是甲烷囊菌属;新窖泥优势菌属是己酸菌属和丁酸梭菌属,优势古菌属是甲烷杆菌属;窖泥内和窖泥外优势菌属是棒状杆菌属,优势古菌属是甲烷短杆菌属。通过可培养和不可培养微生物结果显示差异较大,老窖泥存在退化情况,提示窖泥微生物资源有待继续开发和窖泥养护问题需要重视。
4.1. 窖泥分离鉴定结果分析
窖泥样本中我们共分离96株,主要是梭菌和乳酸菌。其中梭菌谢树贵 [25] 体外研究表明其具有较强的耐酸、耐胆汁和耐抗生素能力,并能显著抑制常见肠道致病菌的生长,具有作为饲用微生态制剂应用的潜力。衡文 [26] 研究表明梭菌发酵24 h丁酸产量为5.29 g/L这对白酒品质提升方面具有一定应用价值。窖泥分离鉴定出的乳酸菌沈馨 [27] 结果表明柑橘酒中的有机酸主要是乳酸、柠檬酸和琥珀酸,添加乳酸菌可明显提升果酒中乳酸的含量并降低橘酒的酸味和苦味强度,对柑橘酒发酵中可能具有一定的应用潜力。有趣的是舒梨 [28] 研究乳酸菌能产生细菌素抑制病原菌的生长,这与梭菌功能相同但是抑菌物质以及机制可能会不同。因此我们从窖泥中分离鉴定出的微生物,不仅能丰富我们对窖泥可培养微生物多样性的认识,而且还能研究菌种在特殊环境中在各领域的功能。
4.2. 细菌群落多样性和结构分析
在5个样本中最近批次窖泥中细菌多样性更高,可以由此推测窖泥离开窖池环境时间与微生物多样性的关系:浓香型白酒窖泥中细菌多样性与窖泥离开窖池环境有着深层关系,且随着窖泥离开时间的增加而减少,但窖泥离开窖池环境时间与古菌多样性差异较小。新窖泥与老窖泥相比,细菌多样性门水平差异很小,属水平存在一定差异,其中老窖泥互营乙酸氧化菌属较高,根据郭壮 [29] 研究表明退化窖泥互营乙酸氧化菌高于正常窖泥,这与我们研究结果一致,也说明我们的老窖泥存在退化的状况。新窖泥优势菌属是己酸菌属和丁酸梭菌属,结果与任海伟 [30] 和徐相辉 [31] 一致。窖泥内和窖泥外门水平中放线菌门丰度高,其中窖泥内比窖泥外丰度更高。在属水平上刘茂柯 [32] 研究奇异菌属窖泥底丰度更高,这与我们窖泥内与窖泥外结果类似。针对以上结果,考虑可能是因为最近批次窖泥与其余四个取样时间不一致,然后老窖泥出现退化现象,窖泥中的细菌优胜劣汰,导致细菌丰度不同。
4.3. 古菌群落多样性和结构分析
浓香型白酒窖泥中的古菌多样性较少,新窖泥、老窖泥、窖泥外、窖泥内和最近批次窖泥5个样品中,新窖泥古菌多样性略低于其余4个样本的窖泥,此发现与李文芳 [14] 等得出的结果一致。上述现象可能是窖池本身的古菌群落趋于稳定的过程是一个动态的,窖池中窖泥微生物在发酵过程中受到发酵产生的乙醇以及酸类物质的影响,细菌多样性短时间就有较大的变化,波动较为明显,古菌可以承受高热、高盐度、缺氧的极端环境 [33] ,所以短时间古菌多样性指数波动较小,但由于长时间的发酵驯化,对窖泥中古菌进行筛选,虽然古菌属的种类变化较小,但其各个属的优势度变化较大,适应于窖池发酵环境和能发挥相关功能的菌种优势度增加。因此窖池古菌的多样性越高不一定就能有利于白酒发酵,稳定的生物多样性系统和有利白酒发酵的菌优势度的提高,可能是提高窖池发酵质量的条件。
目前,白酒窖泥中微生物由于培养技术的限制,以及微生物需要周围环境的各类物质作为正常生长因子,99%的微生物还未被培养出来。厌氧技术是分离培养窖泥微生物主要手段,而多样性主要手段是高通量测序。厌氧培养箱采用科学先进手段达到厌氧环境的高精度、箱内装有紫外灯可避免杂菌污染,有利于特殊厌氧环境微生物分离培养后的实际应用以及增加微生物资源库。对于微生物多样性高通量测序技术的应用及范围也越来越广。相对DGGE较为全面和准确的反应窖泥微生物的差异和客观反映低丰度的重要功能。高通量测序技术结合生物信息学结合分析数据 [34] 对古菌和细菌群落的研究更有优势。但Illumina PE250测序发现较多未分类的菌属,因此还需要对窖泥微生物深度研究对提高酒体品质、增加白酒香气、探索提高白酒生产的出酒率、酒厂窖泥养护等方面提供数据和理论支撑。
NOTES
*第一作者。
#通讯作者。