1. 引言
近些年,伴随着经济发展越来越多元化,人们的需求也不再单一化,越来越多的海洋生物进入大众的视野,那些味道鲜美、营养价值丰富的可食用的海产品满足了人们的胃口,热带海水观赏鱼更是为人们的生活添加了丰富的乐趣,也丰富了人们的精神生活。随着观赏鱼在国内的大范围兴起,热带海水观赏鱼市场在国内迅速发展,形成一条新兴产业链 [1] 。小丑鱼,学名为Amphiprion也叫海葵鱼,属鲈形目、雀鲷科、海葵鱼亚科鱼类,传统形态学把该亚科分成双锯鱼属(Amphiprion)及棘颊雀鲷属(Premna) [2] 。小丑鱼是一类具有很高观赏价值的珊瑚礁鱼类,因色彩艳丽,比较活泼,体格健壮的特点深受人们的喜爱,因经济效益高备受市场的喜爱。目前已知的小丑鱼有23种,比较受欢迎的小丑鱼种类主要有公子小丑鱼、黑公子小丑鱼、透红小丑鱼、双带小丑鱼、澳洲小丑鱼、熊猫小丑鱼、毕加索小丑鱼等。
小丑鱼是热带海洋鱼类,是一种重要的热带海洋观赏鱼种,其原产于太平洋和印度洋,分布并不广泛,主要分布在印度洋至西太平洋较温暖的珊瑚礁海域,因其表面能够分泌一种特殊的黏液,并附着在体表,可以保护自身不受海葵出售的伤害,因此常隐匿于海葵中来抵御敌害的侵袭,安心地繁殖后代,同时海葵的食物残渣也可以为小丑鱼提供食物,对海葵而言,小丑鱼的游动可以帮助海葵清理长期积累在表面的残余物和寄生虫,同时小丑鱼的存在也可以吸引其他的捕食者,为海葵提供可猎捕食物,因此小丑鱼和海葵是一种互利共生的关系。除此之外小丑鱼会将卵产在海葵的触手中,海葵的触手保护了鱼卵被其他猎食者吃掉,使得鱼卵可以比较顺利的孵化,幼鱼顺利孵化后,会在海葵附近继续活动,并寻找适合自己生存的环境,然后继续与海葵共生。但并非所有小丑鱼都是与海葵共生,小丑鱼没有海葵出售的保护下依然可以正常生存,而且没种小丑鱼都有适合自己的共生对象。小丑鱼虽然栖居于海葵,但并非是群居鱼类,且小丑鱼有很强大的领地占有意识,一般来说,一对雌雄鱼拥有了适合自己的栖息场所之后,也就是拥有了一个海葵之后,就不会在允许其他鱼进入,除非栖息场所的领域面积较大,否则就会驱逐其他鱼的进入,所占领域面积大的情况下才会有可能允许其它鱼共同相处。通常来说,一个小丑鱼家族中,体型较大、体格健壮的个体一般是雌鱼,体型较小,体格瘦弱的是雄鱼。当其他的鱼入侵领地时,雌鱼就会担任起保护领地的责任,负责驱逐外来鱼类,当这个小丑鱼族群中最大的雌鱼死亡时,雄鱼就会发生性逆转,由雄性转变为雌性,成为新的雌性小丑鱼,以维持族群的平衡。性逆转过程会持续一段时间,短则几个月,长则一年之久,并且不会再发生性逆转现象 [3] 。
小丑鱼是雌雄同体鱼类,且雄性先发育成熟,在经过一系列的环境因素和种群的交替演变,最终转变为雌性小丑鱼,这种现象是与雌性先熟的鱼类正好相反 [4] [5] 。这种性逆转的模式也是雀鲷科鱼类生活史中所特有的 [6] 。在小丑鱼族群繁育过程中,当族群中雌性小丑鱼死亡或者因为其他原因缺失时,雄性小丑鱼就会迅速不可逆的转变为雌性小丑鱼,以保障小丑鱼族群的正常繁衍,有研究表明,小丑鱼在某些情况下幼鱼也可以越过雄性阶段,直接发育成雌性 [7] 。这种现象一般发生在雌、雄鱼均离开鱼巢或者幼鱼所到的新巢穴中雌鱼和雄鱼表现均十分弱势,此时幼鱼就会直接越过雄性阶段,直接发育成雌鱼。这种现象的发生与小丑鱼族群的社会等级行为有关,Hattori等 [7] 在观察日本海域克氏双锯齿鱼的社会等级行为时发现,当雌鱼在族群中缺失后,雄鱼一般会重新寻找其他海葵中的雌鱼进行配对,此时原族群中的幼鱼或者其他未激活的雄鱼就会直接发育成雌鱼,之后性别不可在逆转,且此后终身保留雌性功能。族群中已有配对且处于主导地位时,其余小丑鱼会暂时处于无性别的状态,以备后需,但有些小丑鱼也可能会一生都处于无性别状态,主要取决于它们所需的营养和它们所处的环境 [8] 。
综合组织学研究发现,小丑鱼得性腺发育可分为以下六个阶段:1) 未成熟的幼鱼性腺,其中性腺主要部分是初级卵母细胞卵巢,并且拥有无功能性的精巢组织;2) 亚成体性腺,具有一些功能性的精囊和初级生长时期的卵母细胞,没有可分辨的卵巢片层;3) 拥有两性性腺的成熟雄鱼阶段,具有内含不同发育阶段精母细胞的成熟精巢和具有卵圆细胞及卵黄发生前期卵母细胞的未成熟卵巢;4) 性逆转时期,这个时期的精巢组织开始退化,出现大量游离状态的精子,卵巢组织发育并且充满卵黄发生前期的卵母细胞;5) 未成熟的雌鱼阶段,此阶段拥有卵巢腔,含卵片层,没有精母细胞、精细胞或者精子,只有周边核仁期的卵母细胞;6) 成熟雌鱼阶段,此阶段拥有完整的卵巢和产卵片层,同时还有各个发育阶段的卵母细胞存在其中,而精巢高度退化萎缩,精巢缩小至一条很小很窄的带,且退化的组织包绕着性腺。这个阶段又可根据有无卵黄形成期卵母细胞分为两个时期(I期和II期),其中含有卵黄形成期卵母细胞的为II期,没有的则为I期 [7] [9] [10] [11] 。
小丑鱼因为独特的雄性先熟性别转换成为生物学研究的重点,实验本着求知的态度,利用石蜡切片和HE染色技术,观察各个小丑鱼的性腺发育状态,与其体长和体重耦合起来,探讨小丑鱼生长发育过程中,不同的体长、体重和性腺发育程度的关系。通过本实验的研究,更清晰地了解小丑鱼独特的性腺发育过程。
2. 材料与方法
2.1. 实验材料
数条公子小丑鱼(非鲜活,冰箱冷藏),且体长体重均存在差异。
2.2. 实验试剂和器材
2.2.1. 实验试剂
甲醛溶液、乙醇溶液(无水)、二甲苯溶液、冰乙酸溶液、苏木精试剂、伊红试剂、中兴树脂凝胶。
2.2.2. 实验器材
1.5 L标本瓶、带标签的载玻片、盖玻片、500 mL量筒、组织包埋盒、1000 uL移液枪(包括相适配的枪头)、石蜡切片机、解剖显微镜、观察显微镜、水浴锅、60摄氏度恒温箱、石蜡包埋机(包括足量石蜡)。
2.3. 实验设计
取数条小丑鱼分别测量其体长、体重,并按测量的顺序来标号,按照标号依次解剖并取出其性腺组织,性腺组织经过固定、脱水、透蜡后制作成蜡块,在经过切片机切片、脱蜡、染色、复脱水制作成为永久组织切片。然后通过观察、比对、分析、探讨、查阅资料等研究小丑鱼的体长、体重与性腺发育的关系。
2.4. 实验样品采集和处理
2.4.1. 样品处理
将在冰箱中冷藏的公子小丑鱼取出并进行解冻处理(分批次处理,且解冻过程应保证小丑鱼体表湿润,避免解冻后风干脱水,影响实验)。
2.4.2. 溶液配制
量取500 mL甲醛标准溶液于1.5 L标本瓶中,并做好标签备注;此外还需量取两次500 mL无水乙醇标准溶液和两次500 mL二甲苯标准溶液分别置于4个1.5 L标本瓶中,做好标签备注;配制70%乙醇标准溶液500 mL于标本瓶中,还需配制80%乙醇标准溶液500 mL、95%乙醇标准溶液500 mL两次、无水乙醇:二甲苯 = 1:1标准溶液500 mL、5%冰乙酸标准溶液500 mL均分别置于1.5 L标本瓶中,并分别做标签备注处理。(本实验所用试剂为挥发性有毒气体,均在通风橱内配制)
2.5. 实验方法
1) 测量:将解冻后的公子小丑鱼分别测量体长、体重,记录其体长、体重的数值并用按照测量顺序排序标号。
2) 拍照:测量完体长和体重的公子小丑鱼进行拍照,记录未解剖小丑鱼的整体样貌。
3) 解剖:拍照后在解剖镜下解剖小丑鱼,找到性腺后拍照记录。
4) 固定:将性腺组织完整的取出并放入包埋盒中,在包埋盒上做好标注进行区分,立即放入福尔马林固定液(甲醛标准溶液)中进行固定24小时。
5) 洗涤:固定24小时后的组织块于70%乙醇溶液中分别冲洗三次,去除残留的甲醛溶液。
6) 脱水:将洗涤后的组织块依次放入70%乙醇标准溶液1小时→80%乙醇标准溶液1小时→95%乙醇标准溶液1小时→95%乙醇标准溶液1小时→无水乙醇标准溶液I 1小时→无水乙醇标准溶液II 1小时→无水乙醇:二甲苯 = 1:1标准溶液40分钟→二甲苯标准溶液I 40分钟→二甲苯标准溶液II 40分钟。(试剂溶液具有挥发性,会导致溶液浓度发生变化,同时试剂反复使用也会导致溶纯度发生变化,为保持实验严谨,应定期更换试剂。) (为避免试剂溶液挥发有毒气体,此过程均在通风橱内进行。)
7) 透蜡:将脱水后的组织在通风橱内晾置一段时间,避免组织表面附带的二甲苯挥发产生的有毒气体的污染,后将组织块从包埋盒中取出放入石蜡包埋机的蜡盒I中透蜡40分钟(位置做好标注,以免转移时混乱),再将组织块转移到蜡盒II中透蜡50分钟(注意顺序标注,避免混乱),然后再将组织块转入蜡盒III中继续透蜡1小时 [12] 。
8) 包埋:将透蜡后的组织块对应编号放入原定的组织包埋盒中,利用石蜡包埋机进行包埋处理,(石蜡包埋机需预热将蜡盒中的石蜡融解,为保证实验顺利进行且避免不必要的时间浪费,石蜡包埋机在使用前应提前预热一个半小时到两个小时,保证蜡盒里的石蜡能够完全融化),包埋后的组织在包埋盒中晾置一段时间,直到包埋盒里的石蜡完全凝固,形成完整的蜡块。
9) 切片:① 将蜡块从包埋盒内取出,固定在石蜡切片机的夹物台上。② 将刀片固定在石蜡切片机的刀架上,并注意刀口朝上。③ 调整切片机的切片厚度,调整至5微米。④ 调整好后开始切片,摇动切片机把手,注意摇动速度,通常以40~50 r/min为宜。⑤ 当切到连续的完整的带有组织的蜡带时,用毛笔和刀片轻轻取一小段完整的蜡带,放入水浴锅中,注意蜡带的展平。(此过程水浴锅需要提前预热)
10) 脱蜡复水:用干净的载玻片将展平的蜡带从水浴锅中取出并做好标注,后转入60摄氏度恒温箱中烤片30分钟进行融蜡,将融蜡后的载玻片迅速转入二甲苯I标准溶液中脱蜡15分钟,后转入二甲苯标准溶液II中继续脱蜡15分钟,然后在转入二甲苯:无水乙醇 = 1:1的溶液中5分钟,然后再放入100%、95%、80%、70%的乙醇溶液中各3~5分钟,最后放入蒸馏水中3分钟。
11) 染色:将切片放置在解剖盘上,1000微升移液枪移取苏木精染剂染色30分钟,后用缓水流冲掉多余苏木精染剂,在转移至5%冰乙酸溶液中50秒,取出后相同方式移取伊红染剂染色5分钟,染色后缓水流冲掉多余伊红染剂,转入水中浸泡2分钟洗去多余红色 [12] 。
12) 脱水:染色后的切片放入95%乙醇溶液中3分钟,在转入无水乙醇溶液中浸泡3分钟。
13) 透明:脱水后的切片放入二甲苯I和II中各3分钟。(二甲苯应尽量保持无水,因此试剂应经常更换。)
14) 封藏:透明后的切片用移液枪滴加中性树脂凝胶,盖上盖玻片,晾干封藏。
15) 封藏后的完整切片用观察显微镜观察并拍照记录性腺组织切片。
3. 结果与分析
3.1. 公子小丑鱼体长与体重的关系
如表1所示,随机测量了26条公子小丑鱼,其规格为3.8~10 cm,1.31~24.13 g,覆盖了公子小丑鱼的不同发育时期,涵盖了公子小丑鱼从幼鱼到雄鱼再转为雌鱼的性别转化周期。

Table 1. Relationship between body length and weight of Amphiprion ocellaris
表1. 公子小丑鱼体长与体重的关系
3.2. 野生公子小丑鱼的性腺组织解剖

Figure 1. General view of Amphiprion ocellaris 1
图1. 公子小丑鱼1整体图
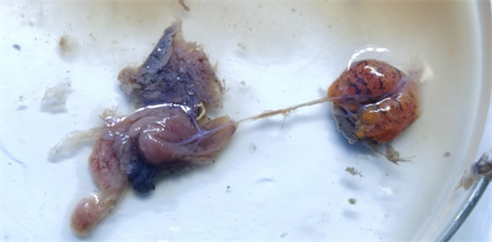
Figure 2. Gonad of the Amphiprion ocellaris 1
图2. 公子小丑鱼1性腺

Figure 3. Cross-section of the gonad of Amphiprion ocellaris 1 ((A): Oocytes; (B): Pre-meiotic oval cells; (C): Yolk granules)
图3. 公子小丑鱼1性腺切片图((A):卵母细胞;(B):减数分裂前卵圆细胞;(C):卵黄颗粒)
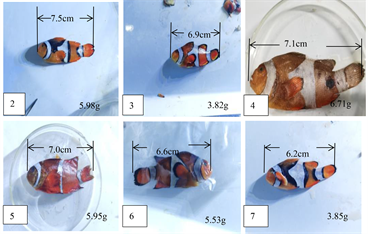
Figure 4. Overall photos of different sizes of Amphiprion ocellaris
图4. 不同规格公子小丑鱼整体照片
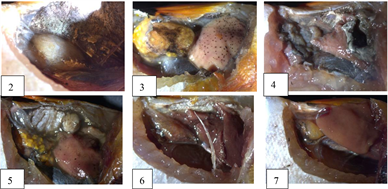
Figure 5. Anatomical diagram of the gonads of Amphiprion ocellaris
图5. 公子小丑鱼性腺解剖图
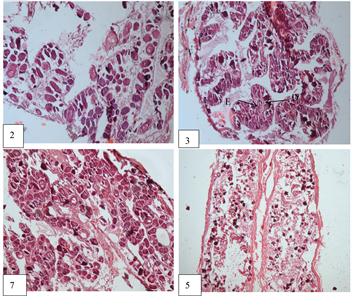
Figure 6. Cross sections of the gonads of other Amphiprion ocellaris ((D): Cell nucleus; (E): Transparent band around the nucleus)
图6. 其他公子小丑鱼性腺切片图((D):细胞核;(E):绕核透明带)

Figure 7. Relationship between body length and weight of Amphiprion ocellaris
图7. 公子小丑鱼体长与体重关系图
通过肉眼观察法,观察到小丑鱼1号体型较大,体格肉眼看上去比较健壮,体长达到了10.0 cm,体重重达24.13 g (表1),在整个小丑鱼家族中也属于比较大的体型,如图1所示,鉴于小丑鱼的发育特性,通常来说只有雌鱼才可以生长到这种体型,因此进行下一步解剖得到了它的性腺组织,如图2所示,性腺颜色呈现橙黄色,且性腺组织块相对较大,也比较符合卵巢的描述,符合我们的猜想,于是进行切片观察,一方面确定猜想,证明是卵巢组织,另一方面确定性腺发育的程度。切片后得到图3,从图3中我们可以明显观察到成熟的卵母细胞(A),且卵母细胞中好有很多卵黄颗粒(C),卵母细胞体积较大,呈不规则的圆形,而且此时粗大的卵黄颗粒充斥着整个卵母细胞,细胞核移向动物极,观察不到液泡,说明此时液泡已经缩小退化,且滤泡膜已经脱离,还可以观察到一些件数分列前的卵母细胞,这些细胞多成椭圆形或者梨形,细胞质较少,细胞核较大,嗜碱性,被染成紫色。有分析我们可以得知卵巢的发育是处在第V时相,小丑鱼性腺发育而言是处在成熟雌鱼阶段,且处在第II时期,因为有卵黄的形成。
观察到的其他公子小丑鱼的外观形态(表1,图4),但从形态而言,体型没有1号小丑鱼那么大,而且体长、体重都相差挺多,因此无法只通过肉眼观察来确定小丑鱼的性别,唯有进行解剖和制片观察来确定。性腺解剖結果如图5所示,不同规格小丑鱼性腺发育情况不一致,存在很大差异性。从图6中2、3、5、7来看,细胞体积要比精细胞大很多,但相比成熟的卵母细胞较小,细胞形状大小不一,被染成紫色,颜色较深,说明有嗜碱性,对比图3中的C发现,却有类似之处,由此可以断定这是一些卵圆细胞向初级精母细胞的过度细胞,符合卵巢发育的第I时相。而图6中的3可以看到这个细胞体积较大,胞体排列疏松,呈椭圆形或圆形,出现多个细胞核,且细胞核变化不大,染色较浅,符合第二时相的特征。因此这几条小丑鱼也都是雌鱼。除了1号公子小丑鱼是完全成熟的雌鱼之外,其他公子小丑鱼的性腺都处于卵巢的初期阶段,尤其是2、5、7号公子小丑鱼,它们的卵巢属于发育期第I时相,结合小丑鱼性腺逆转过程,其中会有一个阶段出现精巢退化卵巢发育的阶段,这个阶段两种性腺同时存在,其中卵巢部分会出现大量的卵黄发生前期的卵母细胞,这也就是雄性向雌性转变的临界阶段,从图6来看,其中2、5、7公子小丑鱼切片图中虽然没有观察到游离状态的精子,但观察到的卵母细胞是符合这个阶段的描述的,而3号公子小丑鱼的切片图来看,卵母细胞的形态结构显然已经进入了下一个阶段,因此可以推测2、5、7号公子小丑鱼可能为性逆转的临界阶段,从表1来看,计算得到这三条小丑鱼的平均体长为6.9厘米,平均体重为5.26克,由此可以粗略的推断出当小丑鱼体长 ≤ 6.9厘米时,小丑鱼处于雄性阶段,体长 ≥ 6.9厘米时,小丑鱼处于雌性阶段。根据图7所得公式,将体长等于6.9厘米代入得到体重为5.4克,由此可以得到与体重的关系,当体重 ≤ 5.4克时为雄性,当体重 ≥ 5.4克时为雌性。但这个结论只是通过现有的实验结果推断出来的,仍需要后续增加实验样本进行验证。
4. 讨论
小丑鱼作为一种雄性先熟的雌雄同体鱼,它的特殊性逆转成为了生物学研究的重点,本实验也是希望通过观察不同体长、体重的小丑鱼的性腺组织,来寻找小丑鱼未成熟雄性、成熟雄性、性逆转时期以及早期雌性和成熟雌性的临界体长体重。正常来说小丑鱼的整个发育过程中,初始阶段为雄性,性腺组织中包括成熟的精巢组织和未成熟卵巢组织,然后在后续的变性过程中,精巢会慢慢退化,卵巢会慢慢占据性腺主导,且中间会出现一个精卵巢均同时存在的两性阶段,但变性的最终结果是发育成雌鱼,且不可逆转 [13] [14] 。而小丑鱼性腺的每个变化都是会在一个生长阶段进行,一般不会跨越式变化。因此所做的这个实验也是为了探究这个变化时的生长阶段。但并非所有实验都是理想的,本次实验并没有达到预期,没有得到理想的结果。这是有很多方面的原因的,一是材料不新鲜,实验所用小丑鱼是早期死亡冷藏在冰箱内的,长期的冰冻冷藏可能导致小丑鱼内部组织结构发生变化,例如萎缩、腐烂等,实验也确实解剖到很多内部脏器萎缩、腐烂的鱼。二是自身原因,自身操作不当以及过程不严谨造成了所得切片质量差,这也导致了结果不理想。第三就是突发疫情的到来导致实验时间大大缩短,实验材料也不能很好地补充,实验周期短加上实验材料少也很大地造成了实验没有达到预期。
对于鱼类性腺的研究,目前已经不算少数了,从原始性腺的形成、发育和分化到性腺组织结构、形态和时相的划分以及环境因素对性腺发育的影响等均涉猎颇多 [15] 。就性逆转现象来说,在鱼类中并不是很特别的现象,很多鱼在大自然的选择进化下都进化出了性逆转机制,来保证种族的繁衍。但性逆转的调控机制是如何的,性别分化指令是从什么位置发出的以及通过什么信息来传导和调控表达,这些我们目前都是位置的 [16] 。目前有研究表明,珊瑚礁鱼类的性别转换很大程度上受环境和种群的影响 [17] 。与小丑鱼雄性先熟性逆转正相反的福氏刺尻鱼,人们也是通过组织学观察确定了它的性腺发育特点 [17] 。人们为了深入的了解鱼类性别转换的调控机制,很多从组织观察层面深入到基因层面,通过双酚B对斑马鱼性别分化的影响,得到了foxl2、dmrt1、amh、sox9a、cyp19a1a等多个基因的表达对性腺发育均有这不同的影响 [18] 。小丑鱼方面的研究目前来说做的是比较少的,但并不是没有,国内目前也利用红小丑鱼开展了其性腺发育和性逆转的研究 [19] ,国外也有对小丑鱼性别转化基因组的分析 [20] 。但研究没有终点,仍需要不断地研究去补充以前的不足和开拓未知。
小丑鱼作为一个雌雄同体鱼,且拥有独特的雄性先熟的性别变化现象,在生物学的研究上是非常有参考价值的。但目前来说,关于小丑鱼的性别转化的研究是相对较少的,大多集中在研究小丑鱼的人工繁殖,而且研究主要集中在国外,国内对这方面的研究可以说是寥寥无几。可能是因为小丑鱼本身价格相对比较贵,且在之前是相对小众的鱼种,但如今小丑鱼已经成为了比较热门的观赏鱼种,对于小丑鱼研究也应该与时俱进。今后也有必要研究更多更加多样化的性别转化机制,这将极大地丰富对脊椎动物性别决定和分化调控机制的认识。
5. 小结
本实验中随机选取3.8~10.0 cm的野生公子小丑鱼,记录体长和体重,通过石蜡切片和HE染色,将不同发育时期公子小丑鱼的性腺发育与体长和体重耦合起来。研究表明,当公子小丑鱼体长 ≤ 6.9厘米,体重 ≤ 5.4克时,处于雄性阶段,当公子小丑鱼体长 ≥ 6.9厘米,体重 ≥ 5.4克时,处于雌性阶段。本研究对于小丑鱼的亲本构建及育种有一定的参考价值。
基金项目
青岛水族技术协同创新中心合作项目(6602418043)。
NOTES
*通讯作者。