摘要: 目的:探讨小胶质细胞参与脑缺血损伤的核心基因。方法:在R语言中,对GEO数据库中的数据集GSE174574中的单细胞测序数据进行读取、质控、聚类、分群及注释,得到缺血性脑卒中组与假手术组小鼠小胶质细胞的差异表达基因(DEG),并进行秩和检验、GO富集分析。利用“Seurat”包对小胶质细胞的单细胞测序数据进行再聚类及小胶质细胞拟时序分析。最后使用string网站构建相关mark基因的互作网络图,发现该网络的核心基因。结果:根据缺血性脑卒中单细胞图谱,我们发现小胶质细胞在缺血性脑卒中发挥重要作用,在对小胶质细胞进行二次聚类后,我们鉴定出8种细胞类型,分别为Mic 0、Mic 1、Mic 2、Mic 3、Mic 4、Mic 5、Mic 6、Mic 7。由小胶质细胞拟时序分析结果可知,缺血性脑卒中组的小鼠小胶质细胞向Mic 2亚群发育。进一步鉴定Mic 2的mark基因的互作网络图发现,SPP1在该网络中处于核心地位。结论:小胶质细胞的基因SPP1在脑缺血再灌注损伤中发挥重要作用,可能是治疗缺血性脑卒中的重要靶点。
Abstract:
Objective: To investigate the core genes of microglia involved in cerebral ischemic injury. Methods: The differentially expressed genes (DEGs) of mouse microglia in the ischemic stroke group and the sham operation group were obtained by reading, quality control, clustering, clustering and annota-tion of the single-cell sequencing data in the dataset GSE174574 in the GEO database, and the rank-sum test and GO enrichment analysis were performed. The “Seurat” package was used to re-cluster and microglia pseudo-temporal analysis of single-cell sequencing data from microglia. Fi-nally, the STR website was used to construct the interaction network diagram of related mark genes, and the core genes of the network were discovered. Results: According to the ischemic stroke single-cell profile, we found that microglia play an important role in ischemic stroke, and after sec-ondary clustering of microglia, we identified 8 cell types, namely Mic 0, Mic 1, Mic 2, Mic 3, Mic 4, Mic 5, Mic 6, and Mic 7. According to the results of microglial pseudo-chronological analysis, the micro-glia of mice in the ischemic stroke group developed towards the Mic 2 subset. Further identification of the interaction network diagram of the mark gene of Mic 2 showed that SPP1 was at the core of the network. Conclusion: The microglia gene SPP1 plays an important role in cerebral ische-mia-reperfusion injury, and may be an important target for the treatment of ischemic stroke.
1. 引言
脑卒中作为全球第三大致死原因,具有极高的发病率、致残率以及死亡率 [1] 。发病后,患者常常会面临多种后遗症,其中大部分会导致不同程度的身体运动功能损伤,从而引起暂时性或永久性的运动障碍。脑卒中所造成的致残情况也给医疗系统带来了巨大的经济负担。据统计,脑中风可分为出血性脑卒中和缺血性脑卒中两种类型,其中后者占据了总病例的80% [2] 。缺血性脑卒中是由于脑缺血和供氧不足引起,可导致长期的神经和精神障碍,但目前的治疗方法有限 [3] 。
小胶质细胞是中枢神经系统免疫系统中数量最多的单核吞噬细胞。它们主要通过吞噬作用来清除大脑中的损伤物质,如受损细胞碎片、微生物和蛋白聚集物,以及其他可能引起神经系统损伤的颗粒状和溶解性抗原。此外,小胶质细胞还参与调节大脑的发育,维持中枢神经系统的稳定,并参与中枢神经系统的损伤和修复过程 [4] [5] [6] 。作为中枢神经系统的免疫细胞,小胶质细胞发挥中枢神经系统损伤监测、神经元碎片清除、突触修剪等功能,并为神经发生提供必要的分泌因子。研究发现,SPP1位于人染色体4q22.1,编码分泌型磷蛋白-1 (SPP-1) [7] 。其在出生后早期的小胶质细胞中是一种高表达的基因,在成人脑缺血损伤后也会发生高表达 [8] [9] 。在中枢神经系统中,SPP1作为一种重要且有效的传感器,可以对破坏稳态的细胞/组织的状态或生理上不同类型的急性或慢性损伤作出反应,例如在以炎症为重要病理生理改变的神经退行性疾病 [10] 。
本研究利用Seurat包、差异基因表达分析和GO富集分析的方法,对GEO数据库中的GES174574单细胞测序数据进行质控、聚类、分群及注释,得到细胞分群图,鉴定差异基因相关生物学过程,分子功能及细胞定位。通过绘制脑卒中单细胞图谱,构建小胶质细胞的发育轨迹,探讨小胶质细胞的亚群。进一步构建此亚群mark基因的互作网络图,研究SPP1在该网络中的地位,为缺血性脑卒中寻找治疗的靶点。
2. 方法
2.1. 数据来源
从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)下载小鼠缺血性脑卒中的单细胞RNA-seq数据(GSE174574)。
2.2. 单细胞测序数据读取,质控,聚类,分群及注释
使用read10×及merge函数分别读取合并单细胞测序数据。使用percentfeature函数计算线粒体百分比,并提取检测基因数为400至6000,且线粒体比例低于15%的细胞进行下游分析。R包“harmony”算法用于移除不同样本间单细胞测序数据的批次效应。然后使用Seurat包中的FindVariableGenes函数筛选高变基因,以及RunPCA函数对小鼠脑组织单细胞进行线性降维。通过执行Seurat包的FindClusters函数,获得基于共享近邻(SNN)模块化的集群,并绘制SNN图。其中,SNN图由前30个主要主成分(PC)构建。对于模块化优化,我们将脑组织数据的分辨率设置为0.5。同时,继续使用这前30个PC由Seurat软件包中的RunTSNE函数生成t-SNE图。从cellmarker网站获取小鼠脑部不同细胞的mark基因,利用dotplot函数对不同cluster的mark基因表达水平进行可视化。最后基于mark表达水平对细胞进行注释。
2.3. 不同集群细胞的差异表达基因分析和秩和检验
通过使用秩和检验将巨噬细胞,小胶质细胞及单核细胞与其他聚类进行比较,再进行差异表达基因(DEG)分析和秩和检验。差异基因的阈值设置为尺度离散度 > 0.25和对数归一化平均表达 > 0.01。通过Benjamini Hochberg方法计算错误发现率(FDR),并使用0.01的FDR作为截止值。对于每个集群的细胞类型特征,指定为具有前100倍变化的DEG。
2.4. 小胶质细胞的基因组功能分析
基因组功能分析采用R包“clusterProfler”进行。GO数据库总共有三大类,分别是生物学过程(Biological Process, BP)、细胞定位(Cellular Component, CC)和分子功能(Molecular Function, MF),分别推测基因可能行使的分子功能,细胞定位,以及参与的生物学过程。“Findmarker”函数用于分别寻找缺血性脑卒中小鼠及假手术组小鼠小胶质细胞,巨噬细胞,单核细胞的差异基因。将小胶质细胞的差异基因映射至基因本体数据库,鉴定差异基因相关生物学过程,分子功能及细胞定位。
2.5. 小胶质细胞再聚类、单细胞伪时间轨迹和PPI网络的构建
Subset提取脑组织单细胞测序数据中小胶质细胞,共得到4762个细胞进行下游分析。使用Seurat包中的RunPCA函数对小鼠脑组织单细胞进行了线性降维。使用Seurat包中的FindVariableGenes函数筛选高变基因,并用于降维。我们执行了Seurat包的FindClusters函数中实现的基于共享近邻(SNN)模块化的集群。SNN图使用前30个主要主成分(PC)构建。对于模块化优化,我们将脑组织数据的分辨率设置为0.5。t-SNE图由Seurat软件包中的RunTSNE函数生成,使用前30个PC。
用R包“monocle3”(monocle3 v1.0.1)算法构建小胶质细胞细胞伪时间轨迹。UMAP方法降维,并使用plot_cell进行可视化。使用“graph_test”函数用于筛选差异表达基因。莫兰指数的阈值设定为 > 0.3,q值(校正后的p值)阈值设定为 < 0.001。在筛选出差异表达基因后,利用STRING在线工具(http://string-db.org)构建这些差异表达基因的蛋白质—蛋白质网络(PPI)。
3. 结果
3.1. 单细胞测序数据质控过滤及整合
为了在单细胞层面解析缺血性脑卒中的发病机制,从GEO数据库下载了总共6例小鼠脑组织单细胞测序数据(3MACO VS 3 sham)。为了去除低质量细胞,使用PercentFeatureSet函数计算各细胞线粒体百分比(图1)。随后,提取检测到基因数多于400,且少于6000同时线粒体百分比低于15的细胞进行下游分析。总共提取到58,007个细胞进行下游分析。
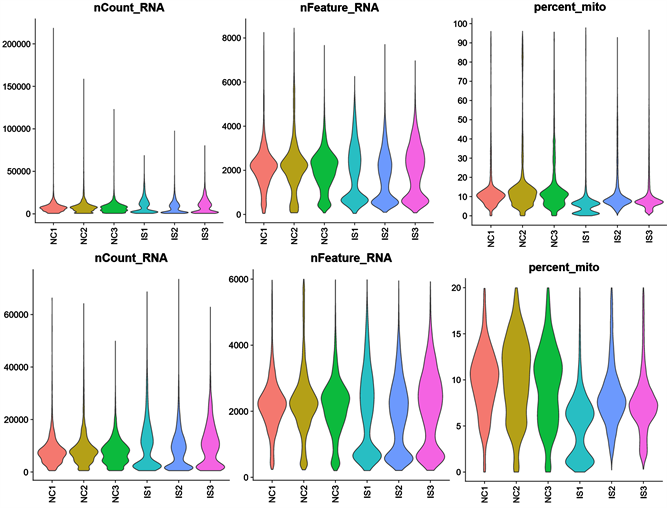
Figure 1. Distribution of RNA count, feature number and mitochondrial percentage between NC1, NC2, NC3 and IS1, IS2 and IS3
图1. NC1、NC2、NC3与IS1、IS2、IS3的RNA count数、Feature数与线粒体百分比分布图
3.2. tSNE降维聚类及分群
FindVariableFeature函数寻找top2000高度可变基因。采用主成分分析的方法对这2000个高变基因进一步降维,并选取前30个主成分进行下游分析。结合tSNE算法对主成分进一步降维聚类,聚类树辅助选取合适的分辨率进行分群(图2(b))。结果表明当resolution = 0.5时,分群效果最好,总共鉴定到25个cluster (图2(a))。
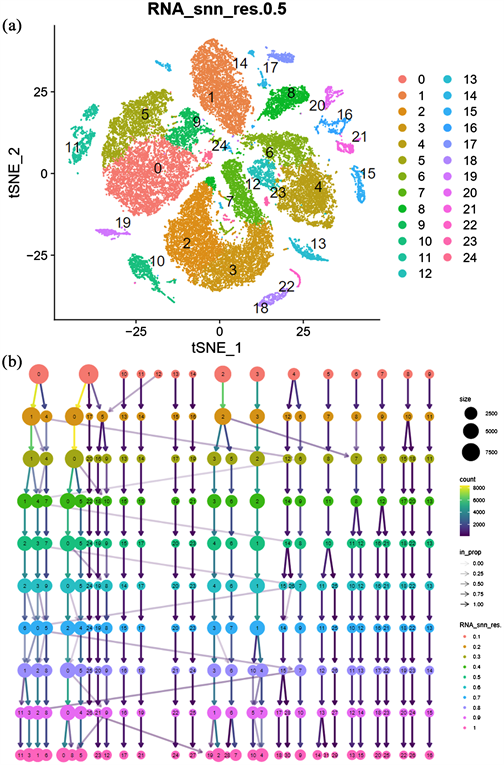
Figure 2. (a) Resolution = 0.5, 25 Cluster’s group diagram; (b) The clustering tree map of 30 main components of the dimension
图2. (a) resolution = 0.5的25个cluster的分群图;(b) 降维聚类30个主成分的聚类树图
3.3. 细胞类型鉴定
通过cellmarker数据库获得小鼠脑部细胞的marker,对质控后的10,000个细胞进行细胞类型鉴定,共鉴定出14个细胞类群,分别是星形胶质细胞(Astrocyte)、B细胞(B cell)、脑微血管内皮细胞(BMEC)、树突状细胞(DC)、室管膜细胞(Ependymal)、巨噬细胞(Macrophage)、小胶质细胞(Microglia)、单核细胞(Monocyte)、神经元(Neuron)、少突胶质细胞(Oligo)、少突胶质前体细胞(OPC)、周细胞(Pericyte)、T细胞(T cell)、血管平滑肌细胞(VSMC) (图3)。当脑血管闭塞时,先天免疫系统被应激和死亡神经元的危险

Figure 3. (a) Maps of 14 cell subsets obtained after the identification of mouse brain cells; (b) Average expression levels and percentage expressions of different genes of 14 cell subsets
图3. (a) 鉴定小鼠脑细胞后获得的14个细胞亚群图;(b) 14个细胞亚群不同基因的平均表达量和表达百分比图
相关分子信号被激活。小胶质细胞是第一个被激活的细胞群,作为中枢神经系统内的一种免疫细胞群,它吞噬细胞碎片并通过细胞因子信号调节免疫应答。不久,单核细胞从外周免疫系统到达,分化为巨噬细胞,并进一步帮助免疫应答。激活后,小胶质细胞和单核细胞来源的巨噬细胞都能够极化成表型,这些表型既可以促进炎症反应,也可以减弱炎症反应,从而减少了缺血性卒中后期神经元的损伤,促进了神经元功能的恢复 [11] 。随后,为了在单细胞层面探索巨噬细胞、小胶质细胞和单核细胞在缺血性脑卒中进展中发挥的作用及潜在机制,我们使用findmarkers函数来鉴定这3类细胞缺血性脑损伤与假手术组之间的差异基因(图4),可知mark基因Spp1、Lgals、Cxcl2、Gpnmd、Ccl2在小胶质细胞中高表达。

Figure 4. The differences of genetic diagram of macrophages, microglias, monocytes in ischemic stroke and fake surgery group
图4. 巨噬细胞、小胶质细胞、单核细胞在缺血性脑卒中与假手术组之间的差异基因图
3.4. 小胶质细胞基因组的GO富集分析
对缺血性脑卒中与假手术组小鼠小胶质细胞的差异基因进行GO富集分析(Gene ontology enrichment analysis)。GOBP(生物过程)结果表明这些差异基因主要富集在核糖核蛋白复合物生物合成、细胞大分子生物合成过程的调控、细胞粘附的正向调节以及细胞器蛋白质定位的建立(图5(a)),MF(分子功能)表明这些差异基因主要富集在核糖体的结构组成部分(图5(b)),CC(细胞组分)表明这些差异基因主要富集于核糖体、核糖体亚单位中(图5(c))。
3.5. 小胶质细胞再聚类、拟时序轨迹分析及其PPI网络图的构建
为了确定小胶质细胞在缺血性脑卒中发病过程中发挥的作用,我们提取了小胶质细胞进行二次聚类共鉴定出8种细胞类型,分别为Mic 0、Mic 1、Mic 2、Mic 3、Mic 4、Mic 5、Mic 6、Mic 7,绘制了脑卒中单细胞图谱(图6)。
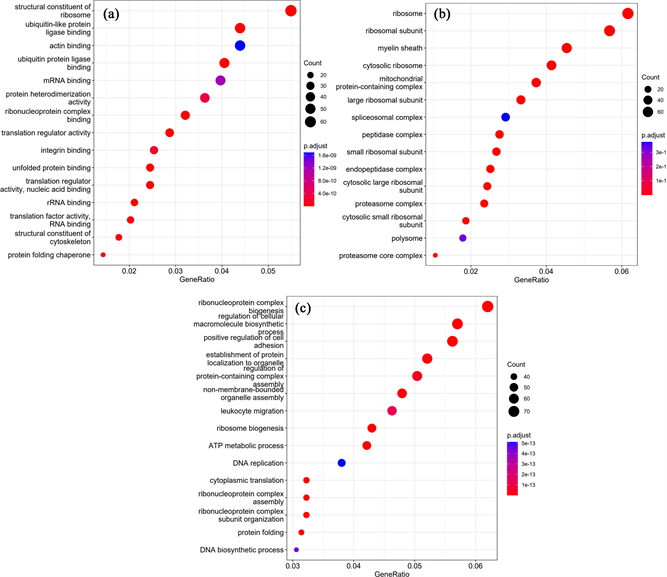
Figure 5. Scatter plot of differential gene expression in microglia of ischemic stroke versus sham-operated group after GO enrichment analysis
图5. 缺血性脑卒中与假手术组小鼠小胶质细胞的差异基因表达GO富集分析后的散点图
轨迹分析表明,假手术组小鼠小胶质细胞主要向Mic 5亚群发育。缺血性脑卒中组小鼠小胶质细胞向Mic 2亚群发育,这表明Mic 2可能在脑缺血再灌注损伤中发挥了重要作用(图7)。接下来我们使用findmarkers函数鉴定了Mic 2的mark基因。使用string网站构建了Mic2的mark基因的互作网络图(图8)。如图所示,SPP1在该网络中处于核心地位,可能是治疗缺血性脑卒中的重要靶点。
4. 讨论
中枢神经系统的免疫功能主要依赖于小胶质细胞。小胶质细胞在中枢神经系统中扮演着监测损伤、清除神经元碎片、修剪突触等重要作用,并通过分泌因子支持神经发生过程 [12] 。通过GO富集分析的结
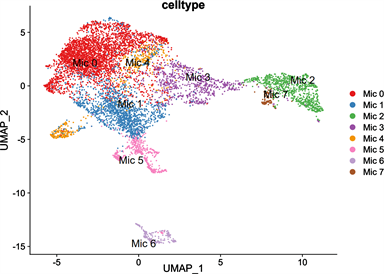
Figure 6. Single-cell profile after microglia reclustering
图6. 小胶质细胞再聚类后的单细胞图谱

Figure 7. Trajectory plot of microglia pseudotime analysis
图7. 小胶质细胞拟时序分析轨迹图
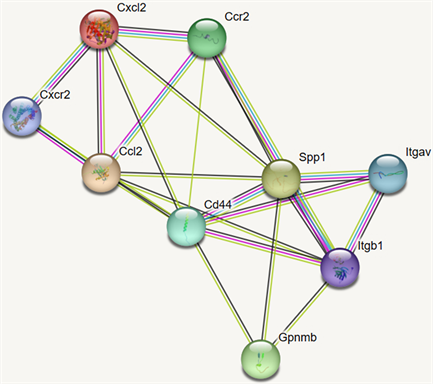
Figure 8. PPI interaction network diagram of the mark gene of Mic 2
图8. Mic 2的mark基因的PPI互作网络图
果,我们发现小胶质细胞在脑缺血再灌注损伤中参与很多生理过程,主要集中在核糖核蛋白复合物的生物合成、细胞大分子生物合成过程的调控、细胞黏附的正向调节以及细胞器蛋白质定位的建立。在脑缺血再灌注损伤发生后,由于血流减少和能量消耗,大量神经元会死亡。死亡或濒死细胞释放出损伤相关配体和兴奋性毒性物质谷氨酸,引发炎症级联反应,进一步加剧神经元的损伤 [13] 。此外,小胶质细胞参与产生生长因子转化生长因子-β (TGF-β),而TGF-β促进了脑血管重构和神经元、小胶质细胞的增殖、分化和成熟,在神经退行性疾病中发挥着重要的调节作用 [14] 。研究发现,缺血性脑卒中后,在活化的小胶质细胞在急性期表达黏附因子CD44,并持续到缺血性脑卒中后的慢性期 [15] 。一项研究表明,CD44缺陷的小鼠在缺血性卒中后的促炎细胞因子表达水平较低,导致缺血区域减少,从而改善神经功能缺损。然而在自身免疫性脑脊髓炎中CD44缺陷的小鼠则表现出增强的炎症反应,这表明CD44发挥抗炎作用 [16] 。对CD44缺陷小鼠的研究获得的不同结果可能是由于CD44在小胶质细胞中的不同作用导致 [10] 。另有研究指出,在脑出血损伤2小时后,大量红细胞向小胶质细胞聚集,而在5小时后,小胶质细胞会吸附其周围红细胞,并将其吞噬 [12] 。
Mic 2小胶质细胞包括选择性激活状态和获得性失活状态 [17] 。选择性激活状态仅限于IL-4或IL-13处理的激活状态,与抗炎、组织修复和细胞外基质(ECM)重建的过程密切相关 [18] 。获得性失活是缓解急性炎症的另一种状态,主要通过吸收凋亡细胞或暴露于抗炎细胞因子如IL-10和转化生长因子-β (TGF-β)的损伤而诱导 [19] 。近期的研究发现,Mic 2表型小胶质细胞可能是通过外泌体中携带的miR-124、miR-186、miR-137、miR-218和miR-26a-5p调控Itgav、Itga5、Itga6、Col1a1、Col1a2、Col4a1和Lamc1表达,进而影响PI3K-AKT信号通路,减轻神经细胞凋亡 [20] 。我们通过对小胶质细胞进行再聚类后,绘制的单细胞图谱发现Mic 2小胶质细胞在脑缺血性损伤中存在重要作用。
分泌型磷蛋白-1 (SPP-1)是由SPP1基因编码的蛋白质。最初SPP-1被发现在骨骼中表达,但现在我们已知它在多种不同的组织中都有表达,包括胃肠道上皮、外分泌腺和远端肾小管 [21] 。研究发现SPP1在肿瘤中发挥重要的作用。它是一种细胞外基质蛋白,参与调节肿瘤细胞的各种活动,包括侵袭、迁移、增殖、凋亡以及抑制血管生成 [22] [23] 。Yu等人研究发现,SPP1在肾脏缺血再灌注损伤中的表达会上调,同时下调SPP1表达可以抑制H/R(缺氧/复氧)引起的肾小管上皮细胞凋亡 [24] 。SPP1的作用机制可能与下调NF-kB通路的表达有关 [25] 。最近的研究发现,在阿尔茨海默症小鼠模型中,SPP1在血管周围细胞和小胶质细胞之间的相互作用中起着重要的作用。血管周围细胞释放的SPP1是小胶质细胞吞噬突触和上调吞噬标志物的必要条件 [26] 。这项研究揭示了SPP1通过调节小胶质细胞介导的突触吞噬来发挥其功能 [8] 。我们的研究通过构建Mic2的mark基因的互作网络图,发现SPP1基因处于该互作网络图的核心地位,有成为脑卒中的重要治疗靶点的可能性。
5. 结论
综上所述,本文依据生信分析的结果可知,在脑缺血再灌注损伤中,Mic 2型小胶质细胞发挥重要的保护作用,SPP1可能在Mic 2的保护作用中作为重要的基因。在接下来的研究中,我们应该验证和探索SPP1在Mic 2中的具体作用及其分子机制,为使其成为脑卒中潜在的早期诊断和治疗靶点做准备。
基金项目
国家自然科学基金面上项目(81771415)。
NOTES
*通讯作者。