摘要: 目的:探讨抑郁障碍和双相障碍以及双相障碍抑郁发作和双相障碍躁狂发作患者之间中性粒细胞–淋巴细胞比率(neutrophil-lymphocyte ratio, NLR)、血小板–淋巴细胞比率(platelet-lymphocyte ratio, PLR)、单核细胞–淋巴细胞比率(monocyte-lymphocyte ratio, MLR)和系统炎症反应指数(system in-flammation response index, SIRI)的差异。方法:我们共纳入229名中国汉族患者(抑郁障碍128人;双相障碍抑郁发作49人;双相障碍躁狂发作52人),根据血液分析结果得出白细胞计数及各细胞亚型计数,并计算NLR、PLR、MLR和SIRI。采用SPSS 26.0进行统计分析,抑郁障碍和双相障碍患者两组间的比较采用Mann-Whitney U检验,抑郁障碍与双相障碍抑郁发作及躁狂发作之间的比较采用Kruskal Wallis H检验,同时采用Bonferroni校正进行事后多重比较。最后以单相、双相抑郁为结局变量,对变量进行单因素及多因素Logistic回归分析,并绘制受试者工作特征曲线。P < 0.05为差异有统计学意义。结果:1) 与抑郁组相比,双相组患者的NLR和SIRI显著升高(P < 0.05)。2) 抑郁组、双相抑郁组和双相躁狂组相比,三组的NLR、MLR和SIRI总体分布存在着统计差异(P < 0.05)。其中,与抑郁组相比,双相躁狂组的NLR、MLR、SIRI显著升高,差异有统计学意义(校正P < 0.05)。抑郁组与双相抑郁组在炎性比率方面均无统计学差异(校正P > 0.05)。(3) 双相躁狂组的NLR和MLR显著高于双相抑郁组,差异有统计学意义(校正P < 0.05)。4) 年龄和白细胞计数对单相和双相抑郁诊断的影响具有统计学意义(P < 0.05),二者联合诊断时的准确率相对较高(AUC = 0.716)。结论:本研究发现双相躁狂患者的NLR和MLR较高,表明躁狂患者的炎症变化相较于抑郁及双相抑郁患者更为明显。此外,联合使用年龄和白细胞计数可以在一定程度上提高鉴别单相和双相抑郁的能力。
Abstract:
Objective: To explore the differences in neutrophil-lymphocyte ratio (NLR), platelet-lymphocyte ra-tio (PLR), monocyte-lymphocyte ratio (MLR), and system inflammation response index (SIRI) among patients with major depressive disorder (MDD), bipolar disorder (BD), bipolar disorder depressive episode (BDD) and bipolar disorder manic episode (BDM). Methods: We included a total of 229 Chi-nese Han patients (128 with MDD, 49 with BDD, and 52 with BDM). The leukocyte counts and vari-ous cell subtype counts were obtained from blood analyses, and NLR, PLR, MLR, and SIRI were cal-culated. Statistical analysis was conducted using SPSS 26.0. Comparisons between MDD and BD pa-tients were performed using the Mann-Whitney U test, while comparisons among MDD, BDD, and BDM were analyzed using the Kruskal-Wallis H test, followed by Bonferroni corrections for post hoc multiple comparisons. Finally, MDD and BDD were used as the outcome variables, and the variables were analyzed by univariate and multivariate Logistic regression analysis, and receiver operating characteristic curve was drawn. Differences were considered statistically significant at P < 0.05. Results: 1) Compared to the MDD, BD exhibited significantly elevated NLR and SIRI (P < 0.05). 2) When comparing the MDD, BDD, and BDM, there were overall statistical differences in NLR, MLR, and SIRI (P < 0.05). Specifically, in comparison to the MDD, the BDM showed significantly higher NLR, MLR, and SIRI, with statistical significance (adj. P < 0.05). There were no statistically signifi-cant differences in inflammatory ratios between MDD and BDD (adj. P > 0.05). 3) The BDM exhibited significantly higher NLR and MLR compared to the BDD, with statistical significance (adj. P < 0.05). 4) The influence of age and leukocyte counts on the diagnosis of MDD and BDD (P < 0.05) was statisti-cally significant (P < 0.05), and the accuracy of the combination of the two was relatively high (AUC = 0.716). Conclusion: This study found that NLR and MLR are higher during BDM, indicating a more pronounced inflammatory response compared to MDD and BDD. In addition, the combined use of age and leukocyte counts improved the ability to discriminate MDD from BDD to some extent.
1. 引言
在国际疾病分类第10版(International Classification of Diseases-10, ICD-10)诊断体系中,抑郁障碍(major depressive disorder, MDD)和双相障碍(bipolar disorder, BD)归属于心境障碍大类,其主要特征是显著而持久的心境或情感改变 [1] 。调查发现 [2] ,我国的心境障碍终生患病率为7.37%,12个月患病率为4.06%。这些疾病伴随着高自杀率和频繁的病情复发 [3] [4] ,已成为全球公共卫生关注的焦点 [5] 。尽管这些疾病的确切病因尚不明确,但越来越多的证据支持免疫炎症系统在心境障碍发病机制中的重要作用,尤其是与细胞因子、趋化因子和C反应蛋白水平相关的研究 [6] [7] [8] 。近年来,研究者认识到外周血作为炎症标志物的独特优势,它易于获取,检测成本低廉,适用于临床常规检测,并且具有良好的可重复性。因此,外周血中白细胞亚群计数及其比率,如中性粒细胞–淋巴细胞比率(neutrophil-lymphocyte ratio, NLR)、血小板–淋巴细胞比率(platelet-lymphocyte ratio, PLR)、单核细胞–淋巴细胞比率(monocyte-lymphocyte ratio, MLR)和系统炎症反应指数(system inflammation response index, SIRI)等已成为研究炎症与心境障碍关系的重要工具 [9] 。一项荟萃分析表明 [10] ,与健康对照者相比,MDD和BD患者具有更高的NLR和PLR。Mazza等发现 [9] ,在双相障碍躁狂发作(bipolar disorder manic episode, BDM)患者中,NLR和MLR明显高于MDD和双相障碍抑郁发作(bipolar disorder depressive episode, BDD)患者,而上述炎症比率指标在MDD与BD、BDD之间未见差异。然而,Wei等 [11] 研究结果与之不完全一致,他们发现与MDD患者相比,BD患者表现出较高的NLR和MLR以及较低的PLR。同时,Wei等 [12] 还发现与健康对照相比,BD患者的SIRI升高。上述研究表明,炎症在不同病程状态下存在显著差异,可能是影响病程发展的重要因素。然而,目前关于这些炎症比率在MDD和BD中的作用的证据有限且不一致。因此,本研究旨在探讨MDD和BD患者以及不同病程状态下的BD患者(抑郁发作、躁狂发作)之间外周血中炎性比率的差异,以丰富该领域现有研究并验证或挑战以往的发现,增进我们对心境障碍与免疫炎症系统相互关系的理解。通过这项研究,我们希望为未来心境障碍的临床诊断和治疗提供更加可行和可靠的生物学指标,从而推动相关检测方法的标准化和产业化发展。
2. 对象与方法
2.1. 对象
我们收集了2022年6月~2023年9月于青岛市精神卫生中心住院治疗的急性期抑郁障碍和双相障碍的成年患者。抑郁障碍入组标准:(1) 汉族人;(2) 18岁 ≤ 年龄 ≤ 60岁;(3) 符合ICD-10中抑郁障碍的诊断标准,且明确诊断至少由2名具有主治及以上职称的精神科医师出具;(4) 患者对本研究知情同意并签署书面知情同意书。双相障碍入组标准:(1) 汉族人;(2) 18岁 ≤ 年龄 ≤ 60岁;(3) 均符合ICD-10中关于双相障碍的诊断标准,且明确诊断至少由2名具有主治及以上职称的精神科医师出具;(4) 患者对本研究知情同意并签署书面知情同意书。
两组共同排除标准:(1) 与其他精神障碍共病,包括精神分裂症、酒精和(或)物质依赖;(2) 合并其他影响机体炎症状态的躯体疾病,如活动性感染、发烧、炎症反应或自身免疫性疾病、肝或肾功能衰竭、心脏疾病和癌症;(3) 与炎性反应指标改变有关的临床特征,如怀孕、体质量指数(body mass index, BMI) > 30 kg/m2;(4) 近期或反复感染史、过敏史;(5) 入院前2周内使用皮质类固醇、非甾体抗炎药、乙酰水杨酸或免疫抑制药物。本研究共纳入心境障碍患者229例(91名男性和138名女性),抑郁障碍128例,双相障碍101例,其中双相障碍抑郁发作49例,双相障碍躁狂发作52例。
本研究经青岛市精神卫生中心伦理委员会批准(批准文号:2023021),所有纳入研究的患者均知情同意,并签署书面知情同意书。
2.2. 方法
1) 人口学资料和临床资料收集:由1名精神科医师记录入组患者的人口学资料,包括年龄、性别、民族、身高、体重、既往躯体疾病史等,以及临床资料(发病年龄、总病程、终身发作次数等)。
2) 血液学检测及炎性反应指标的计算:采集入组患者住院第二天清晨空腹静脉血。在青岛市精神卫生中心检验科进行检测,获得外周血中白细胞计数、中性粒细胞绝对值、淋巴细胞绝对值、单核细胞绝对值以及血小板计数等数据。计算炎性反应指标:NLR = 中性粒细胞绝对值/淋巴细胞绝对值、PLR = 血小板计数/淋巴细胞绝对值、MLR = 单核细胞绝对值/淋巴细胞绝对值、SIRI = 中性粒细胞绝对值 × 单核细胞绝对值/淋巴细胞绝对值。
3) 统计学处理:应用SPSS 26. 0统计软件进行分析。结合正态性检验(Shapiro-Wilk, SW)判断各个定量资料的正态性,服从正态分布的定量资料以平均数 ± 标准差表示,不服从正态分布(严重偏态分布)的采用中位数(四分位距)表示。分类变量以频数(百分比)表示。两组间一般资料、各类细胞计数及炎性反应指标的比较采用χ2检验或Mann-Whitney U检验;多组间的比较采用Kruskal Wallis H检验,同时采用Bonferroni校正进行事后多重比较。此外,本研究以单相、双相抑郁为结局变量,先对性别、年龄、BMI、白细胞计数等变量进行单因素Logistic回归分析,后筛选出P < 0.05的变量纳入多因素Logistic 回归分析,采用“向后:LR”法筛选出有统计学意义的变量,并绘制受试者工作特征(receiver operating characteristic curve, ROC)曲线,计算曲线下面积(area under the curve, AUC)。所有分析采用双侧检验,以P < 0.05为差异有统计学意义。
3. 结果
3.1. 抑郁组与双相组的人口学资料及炎性反应指标比较
本研究包括128例MDD患者和101例BD患者。在性别分布上,MDD组中女性多于男性(约2:1),而在BD组中男女比均等,两组在性别分布上存在统计学差异(P < 0.05)。关于年龄,MDD组和BD组之间有显著统计学差异,MDD患者的年龄中位数为51岁,而BD患者的年龄中位数为43岁(P < 0.001)。在BMI方面,两组之间的差异无统计学意义(P > 0.05)。见表1。

Table 1. Comparison of demographic data between groups
表1. 组间人口学资料比较
注:MDD为单相抑郁障碍;BD为双相障碍;BDD为双相障碍抑郁发作;BDM为双相障碍躁狂发作;BMI为身体质量指数;*P < 0.05,有统计学差异。
与MDD组相比,BD组的白细胞计数(Z = −3.872, P < 0.001)、中性粒细胞绝对值(Z = −3.830, P < 0.001)、单核细胞绝对值(Z = −3.201, P = 0.001)、NLR (Z = −2.540, P = 0.011)和SIRI (Z = −3.117, P = 0.002)显著升高,余实验室检查结果和炎症比率方面无显著统计学差异(P > 0.05)。见表2。
3.2. 抑郁组与双相抑郁发作组、抑郁组与双相躁狂发作组的人口学资料及炎性反应指标比较
MDD组、BDD组和BDM组相比,三组在性别和年龄总体分布上存在着统计差异(P < 0.05),在BMI方面差异无统计学意义(P > 0.05)。其中,MDD组患者年龄明显偏大,与BDD组、BDM组相比,差异有统计学意义,且MDD组男女比明显低于BDM组(校正P < 0.05)。见表1。
MDD组、BDD组和BDM组相比,三组的白细胞计数、中性粒细胞绝对值、淋巴细胞绝对值、单核细胞绝对值、NLR、MLR、SIRI总体分布存在着统计学差异(P < 0.05)。其中,与MDD组相比,BDD组的白细胞计数和中性粒细胞绝对值显著升高,差异有统计学意义(校正P < 0.05);BDM组的白细胞计数(H = 15.205,校正P = 0.013)、中性粒细胞绝对值(H = 15.245,校正P = 0.001)、单核细胞绝对值(H = 10.729,校正P = 0.008)、NLR (H = 12.290,校正P = 0.002)、MLR (H = 9.494,校正P = 0.036)和SIRI (H = 15.219,校正P < 0.001)均显著升高;余实验室检查结果和炎症比率方面均无显著统计学差异(P > 0.05)。见表2。

Table 2. Comparison of leukocyte counts, subtypes count, and their ratios between groups
表2. 组间白细胞计数、各细胞亚型计数及其比率的比较
注:MDD为单相抑郁障碍;BD为双相障碍;BDD为双相障碍抑郁发作;BDM为双相障碍躁狂发作;NLR为中性粒细胞–淋巴细胞比率;PLR为血小板–淋巴细胞比率;MLR为单核细胞–淋巴细胞比率;SIRI为系统炎症反应指数;*P < 0.05,有统计学差异。
3.3. 双相抑郁发作组与双相躁狂发作组的人口学资料及炎性反应指标比较
49例BDD患者与52例BDM患者的年龄、性别、BMI等方面比较,差异均无统计学意义(校正P > 0.05)。见表1。
与BDD组相比,BDM组的淋巴细胞绝对值(H = 6.236,校正P = 0.041)显著降低;BDM组的NLR (H = 12.290,校正P = 0.047)和MLR (H = 9.494,校正P = 0.011)显著升高;余实验室检查结果和炎症比率方面均无显著统计学差异(校正P > 0.05)。见表2。
3.4. 人口学资料及炎性反应指标对单相和双相抑郁诊断的影响
先对性别、年龄、BMI、白细胞计数等变量进行单因素Logistic回归分析。随后,纳入年龄(P = 0.001)、白细胞计数(P = 0.001)、中性粒细胞绝对值(P = 0.005)和单核细胞绝对值(P = 0.032)构建多因素Logistic回归方程。结果发现,年龄对MDD和BDD诊断的影响具有统计学意义(OR = 0.960, 95% CI = 0.935~0.986, P = 0.003);白细胞计数对MDD和BDD诊断的影响具有统计学意义(OR = 1.392, 95% CI = 1.126~1.721; P = 0.002)。见表3。

Table 3. Regression analysis of demographic data and inflammatory response indicators between MDD and BDD groups
表3. 人口学资料及炎性反应指标在MDD组与BDD组间的回归分析
注:MDD为单相抑郁障碍;BDD为双相障碍抑郁发作;*P < 0.05,有统计学差异。
3.5. 年龄和白细胞计数对单相和双相抑郁鉴别诊断的预测价值分析
ROC曲线显示:年龄鉴别MDD和BDD诊断的AUC为0.633,灵敏度为73.4%,特异度为55.1%,约登指数为0.285。白细胞计数鉴别MDD和BDD诊断的AUC为0.662,灵敏度为69.4%,特异度为62.5%,约登指数为0.319。通过Logistic模型进行年龄和白细胞计数的联合预测,该联合模型在区分MDD和BDD诊断方面的AUC达到0.716,灵敏度为83.7%,特异度为64.1%,约登指数为0.477。见图1。
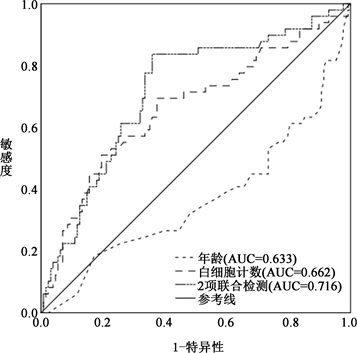 注:AUC曲线下面积。
注:AUC曲线下面积。
Figure 1. ROC curves of age and leukocyte counts for the differential diagnosis of MDD and BD
图1.年龄和白细胞计数对单相和双相抑郁鉴别诊断的ROC曲线
4. 讨论
心境障碍与免疫炎症反应通路的关系备受关注 [13] 。近年来,外周血中炎性比率,如NLR [14] 、PLR [15] 、MLR [16] 以及SIRI [17] ,已成为公认的评估机体炎性反应状态的生物标志物,被认为是衡量炎症活性的优越指标 [18] 。然而,在心境障碍领域,这些指标的研究相对较为稀缺。为了填补这一研究空白,我们进行了一项横断面研究,旨在比较成年MDD患者与BD患者、BDD患者与BDM患者的外周血中炎性比率差异。
本研究的主要结果显示,双相躁狂组的NLR和MLR均呈升高趋势,与单相抑郁组、双相抑郁组相比存在显著性差异。与过往研究 [9] [11] [19] [20] [21] 一致,双相躁狂患者相对于单相抑郁患者表现出更高的NLR、MLR以及一些促炎细胞因子,包括C-反应蛋白、白细胞介素-4 (interleukin-4, IL-4)、IL-18、可溶性IL-6受体、可溶性肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)受体1、单核细胞趋化蛋白-1。此外,BD在不同病程阶段可能存在炎症反应的差异。Ortiz-Domínguez等发现 [22] ,双相躁狂期的TNF-α和IL-4水平升高,IL-1β和IL-2水平降低;而双相抑郁期的IL-6和TNF-α水平升高,IL-2水平降低。与双相缓解期、抑郁期和健康对照相比,双相躁狂期的C-反应蛋白水平显著升高 [23] [24] 。这与本研究结果一致,即支持不同病程状态下的BD患者之间可能存在独特的炎症反应模式,表明炎症变化主要发生在双相躁狂期。
中性粒细胞是细胞防御感染的第一道防线,也是先天免疫系统中的关键细胞类型。淋巴细胞则参与适应性免疫反应,对抗特定病原体。NLR在双相躁狂期的增加可能表明机体免疫功能的失衡 [25] 。单核细胞在先天免疫反应中扮演重要角色,通过将抗原呈递给淋巴细胞,架起先天免疫和适应性免疫的桥梁。中枢神经系统小胶质细胞的激活可能是单核吞噬细胞系统激活的一部分 [16] 。因此,MLR的升高可能是中枢神经系统炎症的外周体征和标志物。综上所述,双相躁狂期机体炎症存在严重失调的特点。
双相障碍,尤其是双相抑郁,是一种误诊率极高的精神疾病,最易被误诊为单相抑郁,误诊率高达70.6% [26] 。在临床实践中,将MDD与BDD区分开来是一项具有挑战性的任务。本研究发现年龄对于MDD和BDD的诊断具有统计学意义。随着年龄的增加,患BDD的风险似乎减少。这可能是因为随着时间的推移,BD的临床特征变得更加明确,医生在诊断时更加警觉,从而减少了误诊的可能性。本研究ROC曲线显示年龄在鉴别MDD和BDD方面的AUC为0.633,表明年龄的预测能力中等偏下,说明年龄只是一个相关因素,而不能作为单独的诊断依据。此外,研究还提示白细胞计数的增加可能与BDD的发病风险增加相关。高白细胞计数反映了慢性炎症状态或免疫系统的过度激活,这可能与BDD的发病机制有关 [27] 。然而,需要注意的是,外周血中单个白细胞参数容易受内外环境的影响,因此单独使用白细胞计数在鉴别MDD和BDD时的能力相对较低(AUC为0.662)。当年龄和白细胞计数联合进行诊断时,AUC为0.716,预测准确率有所提升,但仍需结合其他临床信息和评估工具来进行综合判断。
总的来说,这项研究为我们提供了一些有关炎性指标与心境障碍之间关系的新见解,支撑了既往研究中发现的现象,即与单相抑郁、双相抑郁相比,炎症变化在双相躁狂期尤为明显。然而,需要强调的是,这只是一项横断面研究,无法确定因果关系。未来需要更多的纵向研究来追踪患者的炎性指标随时间的变化,以及与治疗反应和长期结局之间的关系。此外,本研究的样本规模相对较小,且未对患者的病情严重程度与炎性比率之间可能的相关性进行评估,也没有将心境障碍患者与健康对照者进行比较,因此结果需要进一步的验证。同时,我们强调联合年龄和白细胞计数两个指标虽然可以在一定程度上提高鉴别单相和双相抑郁的能力,但AUC值较低,仍需要结合其他因素进行全面判断。未来的研究可以进一步探索免疫炎症反应与心境障碍之间的关系,以期为这些疾病的早期诊断和治疗提供更多的线索和支持。
基金项目
山东省医药卫生科技发展计划项目(202203090255)。
利益冲突
所有作者均声明不存在利益冲突。
作者贡献声明
张延凯:数据收集,统计分析,文章设计与撰写;郝新梅:筛选患者入组,临床资料整理,数据分析;王圣海:文献整理,文章架构;孙平:课题设计,文章审校与修订。
NOTES
*第一作者。
#通讯作者。