1. 前言
糖尿病神经病变(Diabetic Neuropathy)是一种由糖尿病导致的神经系统退行性疾病,是一组因感觉神经、自主神经轴突受损导致的神经系统损伤综合征。作为糖尿病最常见的并发症,随着糖尿病患病率的不断增加 [1] ,糖尿病神经病变患者的数量也在急剧增加。研究统计,糖尿病患者中神经病变的累积发病率高达66%~72% [2] 。多种类型的糖尿病神经病变给糖尿病患者带来的身心损害及医疗资源投入日益加剧。糖尿病如何作用于神经元具体机制仍有争议,目前普遍认为糖尿病持续时间和糖化血红蛋白水平是糖尿病神经病变的主要预测因素 [3] ,然而临床上发现,单纯的血糖控制并不能很好阻止这种并发症的产生和发展。因此,未来关于糖尿病神经病变发病机制的深入研究以及发现可改变的危险因素,制定有效的诊断、筛查和预防策略至关重要。本文通过分析1例以反复晕厥肌无力为表现的糖尿病多发神经病变患者的诊疗过程,结合研究进展,探讨该病的诱发加重因素及管理策略,以提升临床医师对该并发症的诊治经验。
2. 病例资料
2.1. 病例回顾
患者女,44岁,体重35 Kg,此次因“发现血糖高8年,反复发作性晕厥伴肌无力半年”于2023年2月25日入院。患者8年前无明显诱因出现口干、多饮,日饮水量达2000~3000 mL,伴夜尿增多,不伴视物模糊、手足麻木,无头痛、头晕,无心慌、胸闷憋气,无食欲不振、腹痛腹泻等不适,体重无明显变化,于当地医院就诊,查空腹血糖33 mmol/L,尿酮体阳性,以“1型糖尿病合并酮症酸中毒”收住院,住院期间给予降糖、补液、消酮等治疗,症状缓解后出院。平日规律应用优泌乐5 IU、4 IU、4 IU三餐前皮下注射,甘精胰岛素10 IU睡前皮下注射,控制饮食,未规律监测血糖,近期测空腹血糖波动在13 mmol/L左右。近半年无明显诱因出现发作性晕厥,跌倒,伴短暂意识障碍,多次于当地医院就诊,曾考虑“癫痫,短暂脑缺血发作,癔病”等,未能确诊原因,并逐渐出现双下肢无力,不能站立,现患者为行进一步诊治,就诊于我院,患者自1年半前起尝试低碳水饮食,体重共下降约30 Kg,近2月出现反复腹泻,尿失禁,末次月经2021年8月。
2.2. 既往史
癔病发作史5年。无糖尿病家族史。
2.3. 体格检查
T:36.5℃,P:100次/分,R:20次/分,BP:卧位血压114/76 mmHg,身高:160 cm,体重:35 kg,体重指数:13.67 kg/m2,营养不良,体型瘦长型,半自主体位,牙齿大部分脱落,双肺查体未见明显异常,下腹部膨隆,按压有遗尿现象,四肢肌肉萎缩,不能自行站立及行走,肌张力下降,肌力4级,腱反射减弱。
2.4. 入院后辅助检查
生化检测:胆固醇3.90 mmol/L (参考范围:2.32~5.62 mmol/L),低密度脂蛋白胆固醇2.18 mmol/L (参考范围:1.90~3.12 mmol/L),甘油三酯1.06 mmol/L (参考范围:0.30~1.92 mmol/L),高密度脂蛋白胆固醇1.16 mmol/L (参考范围:0.80~2.35 mmol/L),尿酸143 umol/L (参考范围:89.20~339 umol/L),血钠133 mmol/L (参考范围:137~147 mmol/L),肌酐66.40 ummol/L (参考范围:31~132 umol/L),白蛋白31 g/L (参考范围:40~55 g/L),血红蛋白112 g/L (参考范围:115~150 g/L)。尿常规:白细胞112/uL (参考范围:0~25/uL),细菌计数:42,928/uL (参考范围:0~1200/uL)。大便常规正常,潜血阴性,大便菌群分析正常。
C肽测定:0.12 nmol/L (参考范围:0.37~1.47 nmol/L),胰岛素测定:6.07 pmol/L (参考范围:17.80~173 pmol/L),血糖测定(空腹):20.89 mmol/L (参考范围:3.90~6.16 mmol/L)。糖化血红蛋白A1c 9.00% (参考范围:4.0%~6.0%),谷氨酸脱羧酶抗体291.90 IU/mL (参考范围:0~30.00 IU/mL)。
性激素:孕酮0.53 nmol/L (参考范围:绝经期:0~0.60 nmol/L),泌乳素317.01 miu/L (参考范围:109.80~562.40 miu/L),睾酮0.71 nmol/L (参考范围:0.38~1.97 nmol/L),雌二醇 < 36.70 pmol/L (参考范围:0~102.80 pmol/L),促卵泡刺激素2.18 IU/L (参考范围:2.60~150.50 IU/L),促黄体生成素0.19 IU/L (参考范围:5.20~62 IU/L)。
促甲状腺激素:3.20 mIU/L (参考范围:0.27~4.20 mIU/L),游离三碘甲状腺素:3.00 pmol/L (参考范围:3.10~6.80 pmol/L),游离甲状腺素:19.60 pmol/L:(参考范围:12~22 pmol/L)。
25-羟基维生素D:8.08 ng/mL (参考范围:20~32 ng/mL),总I型胶原氨基酸端延长肽:41.53 ng/mL (参考范围:绝经后:20.25~76.31 ng/mL),B-胶原特殊序列:0.79 ng/mL (参考范围:绝经后:≤1.008 ng/mL)。
骨密度检测:腰椎T值−1.37,股骨颈T值−1.57,提示骨量减少。
肌电图检测:正中神经腓浅,腓总神经,腓肠神经MCV、SCV减慢,F波测不到;交感皮肤反应SSR:双手双足SSR潜伏期及波幅均测不到,考虑神经源性损害。见图1。
十二导联心电图:窦性心动过速。
泌尿系统超声:膀胱壁毛糙,残余尿480 mL。

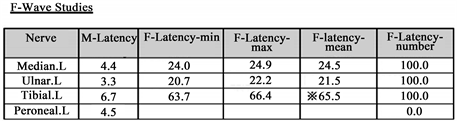

图1. 患者神经功能检测
眼底检查,心脏超声、颅脑CT、胸部CT、腹部CT、盆腔CT、胸腰椎CT均未见明显异常。
患者住院后实施Ewing试验,Ewing试验方法:① 静息时心率:静息时心率 > 90次/分为异常(排除心律失常、心功能不全);② 握拳试验:持续用力握拳3 min后立即测血压,收缩压升高 ≥ 16 mmHg为正常,收缩压升高 ≤ 10 mmH为异常;③ 卧立位血压差:测量患者安静时卧位血压,后嘱其立即站立,于1 min内快速测量血压,收缩压下降 > 20 mmHg或舒张压下降 > 10 mmHg为异常;④ 卧立位每分钟心率差:>10次/分为正常,≤10次/分为异常。其中①、②、④每项异常计1分,③异常计2分。两项以上异常且总分 ≥ 2分者判定为糖尿病心血管自主神经病变。
患者多次测静息时心率:100~110次/分,立–卧位收缩压差 > 20 mmHg,舒张压差 > 10 mmHg,且心率增加 < 10次/min,最低立位血压62/43 mmHg,发生黑朦头晕,及时卧床,未出现意识丧失,上述结果符合糖尿病心血管自主神经病变诊断标准,患者发作前无精神刺激,发作时血糖水平偏高且不伴肢体抽动,结合心脏超声、十二导联心电图、颅脑CT等辅助检查排除了低血糖及其他可导致晕厥的疾病,故诊断患者晕厥由糖尿病心血管自主神经病变直立性低血压所致。
2.5. 诊断
糖尿病1型,糖尿病心血管自主神经病变,糖尿病胃肠神经病变,糖尿病神经源性膀胱,糖尿病周围神经病变,膀胱炎,营养不良,肌肉减少症,骨量减少,继发性闭经,低T3综合征。
2.6. 治疗过程及随访
患者住院后给予胰岛素持续皮下泵入治疗,维持血糖达标,减少血糖波动。同时针对糖尿病神经病变的病因和发病机制给予相应治疗,包括甲钴胺,α-硫辛酸和依帕司他等药物,同时针对自主神经病变分别给予相应处理,补充生理盐水扩容,增加床上肌肉康复训练,避免体位快速变化,改善体位性低血压,抗生素治疗膀胱炎,中医针灸穴位针刺合谷、足三里、太溪、阴陵泉治疗。加强营养支持,改善贫血、低蛋白血症,补充活性维生素D和钙剂。治疗15天后复查,体重增加2 kg,膀胱残余尿量降至240 mL,立位血压升至91/65 mmHg。四肢肌无力症状缓解不明显,嘱出院继续治疗。后期对该患者进行随访,患者自出院后更改为正常饮食方案,并注重食物多样性及营养搭配,体重较出院时提高约5 KG。平日规律应用甘精胰岛素每晚11 IU + 赖脯胰岛素早餐前2 IU、午餐前4 IU、晚餐前4 IU皮下注射,联合补充维生素、营养神经等治疗,目前空腹血糖波动于9 mmol/L,餐后2小时血糖波动于11~12 mmol/L。最近一次血压测定:卧位:121/72 mmHg,立位:107/65 mmHg。目前患者一般情况可,肌无力较前减轻,腹泻、尿失禁及直立性低血压产生的晕厥症状基本消失,日常生活已不受限。后期将继续对该患者进行随访。
3. 讨论
糖尿病神经病变是糖尿病最常见的慢性并发症,其受累神经多种多样,其中糖尿病心血管自主神经病变当属最严重的一种,其显著增加了糖尿病患者死亡率,其临床上多以静息性心动过速、直立性低血压为表现。国外糖尿病患者中心血管自主神经病变的患病率约为20%,随着年龄和糖尿病病程的增加,其患病率可能高达65% [4] 。国内关于自主神经病变的流行病学研究资料较少,目前认为中国人群心脏自主神经病变(cardiac autonomic neuropathy, CAN)在T1DM患者中的患病率约为61.6% [5] 。CAN早期可无症状,只有通过深呼吸降低心率变异性(heart rate variability, HRV)才能检测到,晚期可表现为静息状态下心动过速、直立性低血压、无症状性心肌缺血等症状,临床可采用Ewing试验来诊断 [6] 。
本文中患者以反复发作的晕厥为表现,曾被多次考虑为癫痫、癔症及短暂性脑缺血发作。从入院后检查资料及发作时表现来分析,该患者应为严重的直立性低血压导致。直立性低血压(OH)定义为从仰卧位到站立后收缩压持续下降20 mmHg或舒张压持续下降10 mmHg,且心率增加小于15次/分钟,其由Bradbury和Eggleston [7] 于1925年首次提出。国外荟萃分析显示,直立性低血压与跌倒风险呈正相关,是晕厥和跌倒的风险因素,且在某些方面提高了糖尿病患者的死亡率 [8] [9] 。生理状态下,由仰卧位转为站立位后,大约500毫升血液因重力转移到横膈膜下方的静脉池中,导致静脉回流减少,心搏量减少,动脉血压降低,流向大脑的血流下降 [10] 。在健康个体中,站立时介导心输出量和血管张力调节的心血管自主神经系统及肌肉泵的完整存在可维持血压稳态,不会导致血压的急剧变化;但在糖尿病心血管自主神经病变个体中,由于血管运动性去神经支配,导致内脏和其他外周血管床的血管收缩减少,静脉回流进一步减少,加之心脏正向变力性和变时性调节减弱,导致心输出量进一步减少,导致大脑灌注不足,大脑供氧不足,表现为头晕。在严重的立位不耐受病例中,患者可能出现晕厥、意识障碍和跌倒,如该患者Ewing试验最低立位血压62/43 mmHg,收缩压下降40 mmHg。因此在临床上对于糖尿病患者出现原因不明的头晕和晕厥,应警惕糖尿病心血管自主神经病变的可能。
该患者在半年内出现的多发的、各种类型、广泛累及的糖尿病泛发神经病变,包括感觉、运动和多脏器自主神经,其原因可能与多种因素有关。早期的研究认为神经病变的严重程度与血糖控制不良、病程、吸烟、年龄、血脂、血压等多种因素有关。随着研究进展,动态血糖波动、低血糖、维生素D缺乏、营养不良、运动减少等因素也被证实与糖尿病神经病变相关。该患者血糖控制不良,饮食控制不合理而导致血糖波动显著,有反复的低血糖出现,同时因过度低碳水饮食导致严重的体重下降和营养不良,临床表现为低蛋白血症、贫血、低钠血症、牙齿脱落、肌肉萎缩、继发性闭经、低尿酸、低胆固醇和低T3综合征。研究证实营养不良包括铁、维生素B12和叶酸缺乏,并可诱导机体产生慢性炎症反应,并进一步导致神经病变的发生和发展 [11] 。此外,患者存在骨量减少和严重的低维生素D血症,血清维生素D水平已证实与神经元细胞分化相关,同时在神经元细胞的抗氧化应激和维护神经突完整性中也起一定作用 [12] [13] 。维生素D缺乏和功能不全与DPN显示出显著且独立的相关性,补充维生素D可以缓解糖尿病性神经痛。研究显示,单次肌内注射600,000 IU维生素D可明显缓解痛性DPN患者的疼痛症状。40,000 IU/周的高剂量维生素D补充持续24周,可明显改善T2DM周围神经病变患者的临床症状,同时检测出的皮肤微循环和炎症标志物也得到改善 [14] [15] 。
肌少症与糖尿病神经病变的相关性已有文献证实。本病例患者由于严重的直立性低血压导致无法正常下地活动,长期卧床,加上营养不良,体重指数仅有13.67 kg/m2,均直接导致或加重肌肉减少症的病变程度。肌少症亦可以反作用于直立性低血压患者平衡障碍,导致患者易跌倒、下肢无力,形成恶性循环。除此外,如上所述,站立时回心血量的增加一个重要组成部分是肌肉泵,当肌少症存在时,肌肉泵作用减弱,在一定程度上加重了直立性低血压晕厥的症状。
低碳水化合物饮食(low-carbohydrate diets, LCDs)是指限制碳水化合物的摄入(日碳水化合物摄入量常< 150 g,碳水化合物供能占比常 < 45%),相应地增加蛋白质和脂肪摄入的一系列饮食方案,其包括经典的低碳水化合物饮食、生酮饮食、阿特金斯饮食、地中海饮食等。无论何种低碳水饮食方案,实际上都是碳水化合物代谢向脂肪代谢的转变。近些年随着各种低碳水饮食方案的推广,以此来减重的糖尿病患者越来越多。对于肥胖的胰岛素抵抗的2型糖尿病患者,减重可以获得血糖及心血管疾病获益,但如本例胰岛功能差的1型糖尿病患者,过度的饮食控制和过度的体重下降,可能会带来更多的临床不良后果,值得我们关注。低碳水饮食可以通过调节多种激素而抑制食欲 [16] 。摄入食物的多样性减少,使得饮食变得单调,各种营养因子摄入不足,进而引发或加重糖尿病神经病变。国外一研究用低碳水生酮饮食喂养实验动物创造了一种新的饥饿模型,该饥饿模型模拟了慢性营养不良对机体内肌肉的影响,其实验结果表明,低碳水饮食期间可通过高皮质酮血症、低胰岛素血症、IGF-1分泌减少以及破坏氧化还原环境等多种途径激活肌肉内蛋白质水解,导致肌肉含量减少 [17] 。例如本例,对于长期低碳水饮食的糖尿病患者而言,肌肉含量减少进一步加重了肌少症及直立性低血压的症状。早在1996年,Wells和Read [18] 的研究就发现,与对照组相比,低碳水化合物饮食参与者更易虚弱和疲劳。长期低碳水饮食可能会导致人协调性丧失、肌肉无力等表现,可产生更多的负面影响和更少的积极影响。同样的,国外一项随机对照试验发现,低碳水化合物饮食的受试者较其他饮食的受试者更频繁地报告例如虚弱、直立性低血压、头痛、便秘和肌肉痉挛等不良反应 [19] 。所以,身体活跃的健康个体要摄入均衡、多样化的饮食,其中要含有一定量的碳水化合物。近期研究证据表明心脏脂肪酸代谢升高是心功能不全和缺血性心脏病发展的重要因素。Lopaschuk GD [20] 等人指出,脂肪酸作为能源比葡萄糖的工作效率低。低碳饮食时,心肌代谢对脂肪酸依赖性增加,燃料转为脂肪酸会降低心脏效率。心肌线粒体功能异常是参与心功能不全发展的主要位点之一,人体心脏需要大量的能量来维持收缩与舒张功能,这与心肌线粒体系统功能密切相关。Julie L. Horton等发现线粒体蛋白乙酰化增加可能导致心肌线粒体能量代谢紊乱,影响线粒体燃料氧化和呼吸,从而导致或加重心力衰竭。长时间低碳水饮食,特别是生酮饮食时,心肌细胞对酮体的利用增加,酮体氧化产生了大量乙酰辅酶A,过剩的乙酰辅酶A驱动了非酶线粒体蛋白乙酰化,导致心肌线粒体能量代谢紊乱,燃料氧化通量降低和ATP合成减少,从而降低了心肌工作效率 [21] 。低碳生酮饮食、长期营养不良可导致骨密度降低、低密度脂蛋白升高、心肌功能障碍、心动过缓、QRS电压降低和QT间期长,甚至增加了室性心律失常和猝死的风险,这可能与体内酸碱平衡紊乱及高血β-羟基丁酸相关 [22] [23] 。以上低碳水饮食方案对心脏的不良反应均可能诱发或加重糖尿病患者心血管自主神经病变症状。因此,在兼顾低碳水饮食带来益处的同时,糖尿病患者长期应用所产生的不良反应也值得我们学习和重视。
对于糖尿病心血管自主神经病变的治疗,除了常规的营养神经,抗氧化应激、抑制醛糖还原酶活性药物等综合治疗之外,治疗目的还在于减轻症状、延长站立时间、改善患者体能和增强日常活动能力。充分的饮水,补充钠盐可提高直立位血压,改善症状。该患者经过神经病变常规治疗,并给予补充生理盐水、加强营养支持和肌肉功能康复,住院期间直立性低血压已获得有效改善。目前中国糖尿病神经病变专家共识中推荐,对于常规治疗无法达到满意的疗效或患者正在发生晕厥或跌倒,则给予药物治疗,目前FDA批准的治疗直立性低血压的药物仅有米多君和屈昔多巴,另外,推荐使用的药物为氟氢化可的松和吡啶斯的明 [24] 。
总之,糖尿病自主神经病变早期无特异性临床表现,后期症状复杂多变,容易被漏诊,尤其是心血管自主神经病变,随着病程、年龄、营养不良、血糖控制不佳而不断进展,且临床结局不良。因此,糖尿病心血管自主神经病变早期识别,尤其是对直立性低血压患者进行早期筛查、营养支持、运动锻炼十分重要。对已发直立性低血压并肌肉减少症患者,应以缓解症状、预防跌倒为目的,以患者教育和非药物治疗作为基本策略,重在营养补充、运动训练,而非过度使用药物提升血压,对非药物治疗无法缓解的直立性低血压晕厥患者,在应用药物的同时也应警惕卧位高血压的产生。
NOTES
*通讯作者。