摘要: 目的:探讨骨质疏松性椎体骨折患者行椎体成形术后1年内再发椎体骨折的影响因素,并建立风险预测模型。方法:将2020年至2022年期间于山东大学齐鲁医院因骨质疏松性椎体骨折接受椎体成形术治疗的患者纳入研究,并进一步将其分为训练队列和验证队列。利用单因素分析和基于Akaike信息准则(AIC)的逐步logistic回归法分析分析椎体成形术后1年内再发骨折的影响因素,建立风险预测模型并以列线图的形式将其可视化。我们通过Brier评分、受试者工作曲线(ROC)、校正曲线、临床决策曲线分析(DCA)和临床影响曲线(CIC)对模型的性能进行了评估和验证。结果:经排除后,共有780名患者入选。年龄、性别、吸烟史、用药情况、佩戴支具情况、日照情况、
β胶原降解产物、总I型胶原氨基端延长肽、高密度脂蛋白胆固醇9个因素是骨质疏松性椎体骨折患者行椎体成形术后1年内再发椎体骨折的影响因素;预测模型验证结果显示:C指数分别为训练队列0.851,验证队列为0.820,Brier评分为0.090,证明模型的判别能力及准确度较高。临床决策分析和临床影响曲线结果表明,预测模型可为患者带来临床获益。结论:吸烟、不规范使用抗骨质疏松药物、术后佩戴支具时间不足、每日平均日照时间不足等可增加椎体成形术后1年内再发椎体骨折的风险,该模型可以较准确地预测骨质疏松椎体压缩性骨折患者行椎体成形术后1年内再发椎体骨折风险。
Abstract:
Objective: To investigate the influencing factors of recurrent vertebral fracture within one year after vertebroplasty in patients with osteoporotic vertebral fracture, and to establish a predictive model. Methods: Patients who underwent vertebroplasty for osteoporotic vertebral fracture at Qilu Hospital of Shandong University between 2020 and 2022 were enrolled in the study and further divided into a training cohort and a validation cohort. Factors influencing the recurrent fracture within one year after vertebroplasty were analyzed using univariate analysis and stepwise logistic regression based on Akaike’s information criterion (AIC), and a risk prediction model was developed in the form of a column-line graph. We evaluated and validated the performance of the model by Brier scores, receiver operating characteristic (ROC), calibration curves, decision curve analysis (DCA), and clinical impact curves (CIC). Results: After exclusion, a total of 780 patients were enrolled. Nine factors namely, age, gender, smoking history, medication use, brace wear, sun exposure, β-cross, TP1NT, and HDL-C, were the influencing factors for recurrent vertebral fractures in osteoporotic vertebral fracture patients within one year of vertebroplasty. The results of the validation of the predictive model showed that the C-index was 0.851 for the training cohort and 0.820 for the validation cohort, and the Brier score was 0.090, which proved that the model's discriminative ability and accuracy were high. The results of clinical decision analysis and clinical impact curves showed that the predictive model could bring clinical benefits to patients. Conclusion: Smoking, unregulated use of anti-osteoporotic medications, insufficient postoperative support wearing time, and insufficient average daily sunlight exposure can increase the risk of recurrent vertebral fracture within one year after vertebroplasty, and the model can more accurately predict the risk of recurrent vertebral fracture within one year after vertebroplasty in patients with osteoporotic vertebral compression fractures.
1. 引言
骨质疏松症是一种常见的代谢性疾病,通常由多种因素引起,尤其多见于老年人 [1] [2] 。骨质疏松性椎体骨折是骨质疏松症最常见的并发症之一。椎体成形术具有安全、可靠、疗效好的特点,从而成为治疗骨质疏松性椎体骨折的重要手段 [3] 。
然而,作为一种侵入性手术,椎体成形术也面临着与手术相关的风险,其中最常见的是再发生的骨质疏松性椎体骨折 [4] 。以往的研究表明,椎体成形术后再发椎体骨折的增加是多种因素相互作用的结果,如手术方式、骨水泥注入量和骨质疏松症等 [5] 。一旦再发生椎体骨折,患者往往会出现急性或慢性腰背痛,并伴有进行性畸形,甚至会增加其死亡的风险 [6] [7] [8] 。因此,如果能够提前评估椎体成形术后再发骨折的风险,并提前采取干预措施,就可以降低椎体再发骨折的发生率,提高患者术后的生活质量,减轻患者的经济负担。目前,已有这方面的报道,但现有模型不够全面。如Fu Cheng Bian等人 [9] 的这篇研究报道,他们建立了评估再发椎体骨折风险的预测模型,他们主要关注骨水泥渗漏方面带来的风险。然而,他们忽略了一些临床容易获取的血清学指标、患者术后用药情况以及生活习性与再发椎体骨折风险之间的关系。我们正在做的是收集患者的血清学指标、患者术后用药情况以及生活习性等,将这些因素进行经过多因素分析及模型拟合后构建适用于因骨质疏松性椎体骨折行椎体成形术后患者的再发椎体骨折预测模型,从而能更好地为再发椎体骨折风险高的患者提供个体化干预。
回归分析在医学研究中用途广泛,因为它可以测量相关性、预测结果并控制混合变量的影响。logistic回归可以通过量化每个自变量的独特贡献来分析一组自变量对二元结果的影响 [10] 。Akaike信息准则(AIC)是评估统计模型的复杂度和衡量统计模型数据拟合度的一种标准。当候选模型集中没有真正的模型时,Akaike信息准则是有效的,因为它会渐进地选择一个能使预测/估计的均方误差最小的模型 [11] 。
2. 资料与方法
2.1. 研究对象
本研究为回顾性研究。研究纳入了2020年1月至2022年12月期间在山东大学齐鲁医院因骨质疏松性椎体骨折接受椎体成形术的患者。纳入标准:1) 骨密度符合世界卫生组织对骨质疏松症的诊断标准的原发性骨质疏松症;2) 与影像学椎体骨折一致的疼痛或局部压痛;3) 术前脊柱X光和磁共振成像(MRI)结果;4) 椎体成形术的初步治疗以及椎体成形术后MRI发现的新骨折。排除标准:1) 非骨质疏松性椎体骨折或继发于其他因素的压缩性骨折应力。2) 病历信息不完整或电话随访失访。3) 有严重影响骨代谢疾病或正在服用影响骨代谢的药物。数据以7:3的比例随机分为训练队列和验证队列。
由于只收集了去身份化的数据,因此对研究参与者没有风险。根据《赫尔辛基宣言》(1964年)及其后续修正案,这项回顾性研究无需征得患者的正式同意。本研究已通过山东大学齐鲁医院医学伦理委员会批准。
2.2. 研究方法
经医院医务部审核批准,收集了因骨质疏松性椎体骨折接受椎体成形术的患者基本资料,根据纳入和排除标准摘录相关信息。通过翻阅文献、结合临床经验最终选取了32个可能与再发椎体骨折相关的影响因素如下:患者一般资料:年龄、性别、体重指数、平均动脉压、吸烟史(一生中连续或累积吸烟6个月及以上者)、饮酒史(男性一天饮用酒的酒精量超过25 g,或女性超过15 g)、是否为独居生活;诊疗相关资料:高血压病史、冠心病病史、脑血管病史(脑出血或脑卒中)、糖尿病史、骨折与治疗史、抗骨质疏松用药情况(仅关注用药情况,不区分剂型、用法和用药频次,仅计算有效服药时间是否足够)、佩戴支具情况(仅关注佩戴支具情况,不区分支具类型、用法,仅计算佩戴支具时间是否足够)、1年内平均每日日照时间(每日的平均日照时长是否大于1小时);住院期间第一次实验室指标。预测模型的主要结果事件是椎体成形术后1年内椎体骨折的再发生。再发骨折的结局评定源自两方面:一是患者因骨折再次入院治疗记录(医疗诊断明确,新发生的椎体骨折);二是电话随访:患者发生再骨折但未入院治疗,符合2023年骨质疏松性椎体骨折诊断标准[中国老年骨折疏松症诊疗指南2023]。
2.3. 统计学分析
资料收集完成后采用SPSS (27.0)建立数据库,采用R软件进行统计分析。基础资料描述:连续变量采用均值和范围表示,分类变量采用频率和百分比进行描述。预测模型构建:按照选择种子数10,000随机抽取70%立模型,30%证模型。采用R version 4.3.0进行logistic回归单因素分析初步筛选可能有意义的变量,经过初筛后,将P值 < 0.05及P值 > 0.05但临床或既往研究认为该因素确为结局影响因素的指标纳入logistic多因素分析模型。使用AIC准则逐步回归得到最优模型。预测模型诊断采用一致性指数(C-index),预测模型的拟合优度采用霍斯默–莱梅肖检验(Hosmer and Lemeshow goodness)。采用受试者工作曲线(Receiver Operating Characteristic curve, ROC)的曲线下面积(Area Under Curve, AUC)、Brier评分以及校正曲线和临床决策曲线(Decision Curve Analysis, DCA)和临床影响曲线(Clinical Impact Curve, CIC)来评价预测模型,应用R软件绘制模型列线图。双侧0.05为差异有统计学意义。
3. 结果
3.1. 基线人口学特征
经过筛选,2020年1月至2022年12月共有1920例患者于山东大学齐鲁医院接受椎体成形术治疗,符合纳入排除标准者780例。其中,男性213例,女性567例;年龄52~87 (66.74 ± 6.88)岁。按照选择种子数10,000随机抽取7/10即546例用于训练队列,3/10即234例用于验证队列。训练队列和验证队列患者在年龄、性别、体重指数、平均动脉压、吸烟史、饮酒史、用药情况、佩戴支具情况、日照情况、可能与再发骨折相关的体质量指数与血清实验室指标等各变量间的比较差异无统计学意义(P > 0.05)。
3.2. 单因素分析
共计16个因素(年龄、性别、吸烟史、饮酒史、抗骨质疏松药物治疗半年及以上、术后佩戴支具3个月以上、每日平均日照时间大于1小时、体重指数、谷丙转氨酶、高密度脂蛋白胆固醇、甘油三酯、钙、磷、甲状旁腺素、总25羟基维生素D、β胶原降解产物、总I型胶原氨基端延长肽、)被筛出,其中除了性别、抗骨质疏松药物治疗半年及以上、每日平均日照时间大于1小时,其余指标P值均小于0.05 (表1)。性别、抗骨质疏松药物治疗半年及以上、每日平均日照时间大于1小时在临床上被认为是发生椎体再骨折的影响因素,亦被运行到下一步多因素logistic回归分析。

Table 1. Univariate analysis in influence factors of re-fracture after vertebroplasty
表1. 椎体成形术后再发骨折的单因素分析
3.3. Logistic回归分析与预测模型建立
建立预测模型:以椎体成形术后再发椎体骨折为结局变量,将单因素分析结果有意义的指标纳入logistic回归多因素分析,最终筛选出9个变量(表2),构建预测模型,该模型的Brier评分为0.090,小于0.1,说明模型的精准度较高(图1)。通过霍斯默–莱梅肖检验对模型的拟合度进行检验,得出卡方值为7.6387,自由度等于8,P值等于0.4695大于0.05,说明模型拟合优度较好。

Table 2. Multivariate analysis in influence factors of re-fracture after vertebroplasty
表2. 椎体成形术后再发骨折的多因素分析
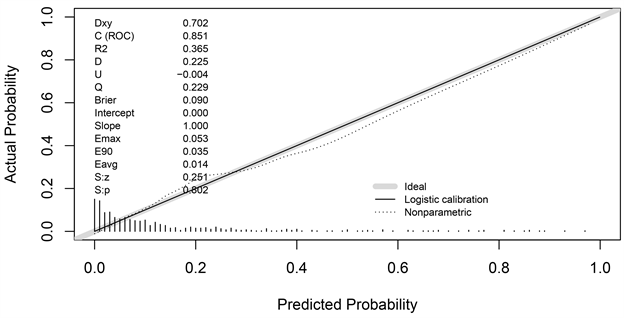
Figure 1. Calibration curve of the predictive model
图1. 预测模型校准曲线
3.4. 模型性能评估
最终模型的辨别能力通过测量ROC曲线的AUC值获得。验证队列和训练队列的AUC值分别为0.851 (图2(a))和0.820 (图2(d)),均>0.75,表明模型具有较好的特异性与敏感性。临床决策曲线(DCA)可以帮助我们判断使用一种模型进行临床决策是否有益,或者哪种模型对临床决策的贡献更大,它的优势在于它倾向于将患者或决策者的偏好纳入分析。这是一个符合临床决策实际需要的概念 [12] 。在我们的研究中,DCA表明,构建的预测模型在阈值概率上增加了更多的净获益,更准确地预测了再发椎体骨折事件(图2(b)),这一结果在验证队列中得到了验证(图2(e))。临床影响曲线(CIC)结果可以表明,模型是否遗漏了真正的阳性患者。在我们的研究中,临床影响曲线显示:构建的列线图能更准确地预测再发椎体骨折事件(图2(c)),这一结果在验证队列中得到了验证(图2(f))。

Figure 2. Receiver operating characteristic curve, decision curve analysis and clinical impact curve for training cohort ((a)~(c)) and validation cohort ((d)~(f))
图2. 模型训练队列((a)~(c))和验证队列((d)~(f))的ROC曲线、临床决策曲线、临床影响曲线
3.5. 预测模型的可视化
根据上述logistic回归多因素分析确定的因素,对纳入预测模型的9个变量进行赋值,结合各个因素在预测模型中的回归系数,构建了一个列线图。各变量在列线图中的评分刻度与各变量的回归系数相关,具体刻度划分由R系统生成(图3)单变量刻度范围为0~100,总分为各变量单项得分累加,总分刻度范围为0~350分。
4. 讨论
本研究共纳入780名因骨质疏松性椎体骨折入院行椎体成形术治疗的患者,其中1年内再发椎体骨折的患者有115名,1年内再发骨折发生率为14.7%。患者行椎体成形术后一旦再发生椎体骨折,往往会造成较严重后果,如较高的医疗费用和持续难以缓解的疼痛等。随着人口老龄化的加剧,骨质疏松症、
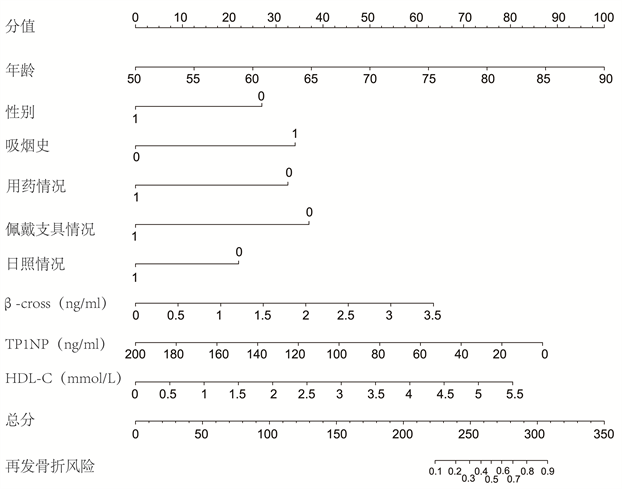 性别:1为男性,2为女性;吸烟史:1为有,0为无;用药情况:1为规律使用抗骨质疏松药物治疗半年及以上,0为未规律使用抗骨质疏松治疗或治疗时间不足半年;佩戴支具情况:1为术后佩戴支具3个月及以上,0为术后未佩戴支具或佩戴支具时间不足3个月;日照情况:1为术后每日平均日照时间大于1小时,0为术后每日平均日照时间不足1小时;β-cross:β胶原蛋白降解产物;TP1NP:总I型胶原氨基端延长肽;HDL:高密度脂蛋白胆固醇。
性别:1为男性,2为女性;吸烟史:1为有,0为无;用药情况:1为规律使用抗骨质疏松药物治疗半年及以上,0为未规律使用抗骨质疏松治疗或治疗时间不足半年;佩戴支具情况:1为术后佩戴支具3个月及以上,0为术后未佩戴支具或佩戴支具时间不足3个月;日照情况:1为术后每日平均日照时间大于1小时,0为术后每日平均日照时间不足1小时;β-cross:β胶原蛋白降解产物;TP1NP:总I型胶原氨基端延长肽;HDL:高密度脂蛋白胆固醇。
Figure 3. Nomogram of predictive model for vertebral re-fracture
图3. 再发椎体骨折风险预测列线图
椎体压缩性骨折等疾病的发病率逐渐升高。尽管许多研究报道了骨质疏松性骨折预防措施的有效性,但这些措施很可能未能够被充分利用。此外,现有的评估工具,如双能定量计算机断层扫描(DEQCT),因测量仪器分布不广、费用较高等原因,使得其在评估再发椎体骨折风险方面的价值有限。有些模型旨在评估椎体成形术后再发椎体骨折的概率。然而,它们大部分仅关注影像学,而忽略了实验室检查与术后患者的生活习惯。与影像学相比,实验室检查的优势在于采集方便。此外,术后是否规律用药及佩戴支具等也是预防再发椎体骨折的重要因素。
在本研究中,将收集的所有变量分别采用logistic回归多因素分析,结合模型拟合结果,最终确定影响椎体成形术后1年内再发骨折的因素包括:年龄、性别、吸烟史、用药情况、佩戴支具情况、日照情况、β胶原降解产物、总I型胶原氨基端延长肽、高密度脂蛋白胆固醇,其中年龄、性别为女性、长期吸烟、β胶原降解产物及高密度脂蛋白胆固醇含量高为危险因素,规律使用抗骨质疏松药物半年及以上,椎体成形术后佩戴支具3个月以上、每日平均日照时长大于1小时及总I型胶原氨基端延长肽含量较高为椎体再骨折的保护因素。
在我们的研究中,数据显示长期吸烟(OR值 = 5.925)是再发椎体骨折的重要危险因素,Wenyuan Hou [13] 等研究发现,长期吸烟的患者,体内可替宁(cotinine)含量会高于不吸烟的患者,这是一种尼古丁在人体代谢后的产物。而他们的研究发现患者体内的可替宁水平与骨质疏松症的发病率呈明显的正相关,尤其是在女性中。同时他们还发现了长期吸烟会导致患者的骨量减少。即使添加了其他因素(教育水平、饮酒状况、贫困状况、身体活动状况、总能量摄入、总胆固醇水平、高密度脂蛋白胆固醇水平、血清钙水平、泼尼松或可的松使用史,以及高血压、糖尿病、心血管疾病和癌症的诊断),这种关系也保持不变。而骨量减少往往意味着骨的脆性增加,从而导致椎体再骨折发生的风险增加。同时,Lars Tue Sørensen等 [14] 及Jean Wong [15] 等研究表明,尼古丁会减少组织灌注,因为血小板聚集增加,微血管前列环素水平降低,以及尼古丁对成纤维细胞、红细胞和巨噬细胞功能的抑制作用。此外,一氧化碳对血红蛋白具有很高的结合亲和力,可通过置换血红蛋白中的氧气来降低组织氧合,从而使得吸烟患者出现术后骨折不愈合率、延迟愈合率和愈合时间增加。
椎体成形术后患者规律使用抗骨质疏松药物半年以上(OR值为0.186)、术后佩戴支具3个月以上(OR值为0.139)及每日平均日照时间大于1小时(OR值为0.296)都可降低患者术后再发椎体骨折的风险。首先Shan-Fu Yu [16] 等提出规律使用抗骨质疏松药物的患者远期再骨折发生率明显低于未规律用药的患者。结合临床经验,我们认为规律使用抗骨质疏松药物半年可有效改善患者的骨质疏松情况,不论是通过促进成骨还是抑制破骨的药物作用,都可以较大程度地改善患者的骨质疏松程度,从而达到降低1年内再发骨折风险的目的。而术后佩戴支具3个月以上可为患者在疏松骨质尚未得到改善之前提供一定的支撑保护作用,减少脆性骨折的发生。此外,Jingwei Cheng [17] 等的研究表明,日晒可以增加患有骨质减少的老年人的骨密度,这可能与日晒促进25羟维生素D3的合成有关。
我们还发现,β-胶原降解产物与再椎体骨折之间存在关联,数据显示其OR值为3.122。这一发现表明,β胶原降解产物是再发椎体骨折的高危因素。目前,β-胶原降解产物代表破骨细胞的活性。当破骨细胞活跃时,椎体内会有更多的骨质被破坏 [18] [19] [20] 。而总I型胶原氨基端延长肽(OR值为0.978)是再发骨折的保护因素,总I型胶原氨基端延长肽(主要反映Ⅰ型胶原蛋白的合成率和成骨效率,是新骨形成的特异性敏感指标,也是首选的骨形成标志物。总I型胶原氨基端延长肽可用于评估成骨活性和监测抗骨质疏松症疗法的疗效。总I型胶原氨基端延长肽还可用于预测骨质疏松症的发生,因为它具有高度的特异性和敏感性,而且不受激素的影响。当总I型胶原氨基端延长肽值升高时,人体成骨细胞的活性增强,骨量增加。因此总I型胶原氨基端延长肽值越高,再发椎体骨折的风险越低 [21] [22] [23] [24] 。
此外,高密度脂蛋白胆固醇(OR值为2.170)是再发椎体骨折的另一个危险因素。高密度脂蛋白胆固醇在脂代谢中起关键因素。通常被认为对人类是有益的,高水平的HDL-C被认为更有利于长远预防心血管疾病 [25] 。而它与骨质疏松之间的关系尚未得到明确的证实,目前的研究仅能证实HDL-C可作用于成骨细胞及破骨细胞从而发挥作用。但具体的作用机制尚未得知。Zhang [26] 等观察到,HDL-C与中国女性腰椎BMD呈负相关,但这些关联的机制尚不清楚。
我们通过列线图的形式将预测模型进行了可视化处理,这样更有利于将预测模型投入临床中应用。同时我们的预测模型通过霍斯默–莱梅肖检验对模型的拟合度进行检验,得出卡方值为7.6387,自由度等于8,P值等于0.4695大于0.05,说明模型拟合优度较好,同时Brier评分为0.090,小于0.1,说明模型的精准度较高。我们还通过AUC值来验证模型的辨别能力,验证队列和训练队列的AUC值分别为0.851和0.820,均>0.75,表明模型具有较好的特异性与敏感性。DCA结果及CIC结果表明该模型的运用可为临床患者带来收益。
最后,我们的研究还存在一些局限性。因为我们的数据是回顾性的,我们还可以通过一些前瞻性的数据研究来进一步验证我们的预测模型。同时关于HDL-C与椎体成形术后1年内再发骨折是否具有明确的关系还可以通过收集更多的样本进行分析验证。
5. 结论
综上所述,我们建立了一个风险预测模型,将其可视化用于帮助外科医生评估骨质疏松性椎体骨折患者行椎体成形术后1年内再发椎体骨折的风险。并更好地为患者提供个体化干预。
NOTES
*通讯作者。