摘要: 目的:研究免疫组织化学(Immunohistochemistry, IHC)结果为错配修复缺陷(Mismatch Repair deficiency, dMMR)的胃癌中微卫星不稳定状态(Microsatellite Instability, MSI),比较胃癌中dMMR/MSI不同检测方法一致性,分析dMMR胃癌临床病理特征。方法:选取2020年3月至2022年7月青岛大学附属医院术前未经治疗、接受胃癌根治术的错配修复(Mismatch Repair, MMR)蛋白IHC检测结果为dMMR的病例85例,由2名病理医师对IHC结果进行复核。利用聚合酶链式反应(Polymerase Chain Reaction, PCR)对85例同样本进行MSI状态的检测,同时分析dMMR胃癌临床病理特征。结果:在85例胃癌样本中,经复核,IHC结果均为dMMR,其中3例经PCR法测定为微卫星稳定(Microsatellite Stability, MSS),免疫组化检测dMMR与PCR检测结果的一致率为96.47%。本研究中dMMR胃癌患者以男性多见(61.2%),初诊时中位年龄在70岁(45岁~86岁),好发于胃窦(76.5%),以MLH1与PMS2这两种MMR蛋白联合缺失为主(94%),Lauren分型中混合型较多(43.5%),分期以II期为主(54.1%),PD-L1表达CPS ≥ 5 (81.2%),EBER表达为阴性(98.9%),HER2基因均无扩增(100%),所有患者中大部分未接受辅助化疗(68.2%),截至随访时间,有85.9%患者未出现复发以及转移(中位随访时间17月)。结论:本研究强调了免疫组化和聚合酶链式反应在检测胃癌错配修复缺陷和微卫星不稳定性方面的显著相关性。主要临床病理特征包括以老年男性为主,好发于胃窦,分期较早,预后较好。
Abstract:
Objective: This study is dedicated to assessing mismatch repair deficiency (dMMR) in gastric cancer utilizing immunohistochemistry (IHC) and determining microsatellite instability (MSI) via polymerase chain reaction (PCR) testing. Its primary aim is to evaluate the consistency between these diagnostic methods for dMMR and MSI in gastric cancer, and to comprehensively analyze the clinical-pathological features that characterize these molecular markers. Methods: Between March 2020 and July 2022, we selected 85 gastric cancer patients from The Affiliated Hospital of Qingdao University who had not received prior treatment and underwent radical surgery. These cases exhibited dMMR based on immunohistochemistry (IHC) results for mismatch repair proteins. The IHC results were reviewed by two pathologists. Polymerase chain reaction (PCR) was employed to evaluate MSI status in the same cohort. Concurrently, we analyzed the clinicopathological characteristics of dMMR/MSI-H gastric cancer. Results: In the analysis, all 85 gastric cancer samples exhibited mismatch repair deficiency (dMMR), as determined by immunohistochemistry (IHC). Polymerase chain reaction (PCR) testing on these samples identified 3 cases as microsatellite stable (MSS). The concordance rate between IHC for dMMR and PCR results in these gastric cancer samples was 96.47%. The cohort predominantly consisted of male patients (61.2%), presenting a median age of 70 years at initial diagnosis (range: 45~86 years). The tumors were primarily located in the gastric antrum (76.5%) and displayed a joint loss of MLH1 and PMS2 MMR proteins in 94% of cases. Regarding histology, the mixed subtype according to the Lauren classification was most frequent (43.5%). Stage II tumors were the most common (54.1%). PD-L1 expression, with a combined positive score (CPS) of ≥5, was observed in 81.2% of the cases. EBER expression was negative in 98.9% of cases, and no HER2 gene amplification was detected across the cohort (100%). A majority of patients (68.2%) did not undergo adjuvant chemotherapy. As of the last follow-up, with a median duration of 17 months, 85.9% of patients exhibited no signs of recurrence or metastasis. Conclusion: This study underscores a significant correlation between immunohistochemistry and polymerase chain reaction in detecting mismatch repair deficiency and microsatellite instability in gastric cancer. Key clinical-pathological features include a predominance of the condition in elderly males and a frequent tumor localization in the gastric antrum, leading to a generally favorable prognosis for these patients.
1. 引言
DNA错配修复(MMR)是DNA损伤修复机制的主要类型之一,对DNA复制和基因重组等过程中产生的碱基错配进行纠正和修复,主要有4个蛋白MLH1,MSH2,MSH6和PMS2 [1] 。4个蛋白之一出现异常时,引起dMMR,导致DNA错误复制中微卫星(microsatellite,具有简单重复单元的DNA序列)重复数目的改变,即MSI。微卫星稳态长时间无法维持会使肿瘤基因组的编码区处于高突变状态即为微卫星高度不稳定(Microsatellite Instability-High, MSI-H) [2] 。目前常用于检测MMR的方法主要有3种:错配修复蛋白的免疫组织化学染色(MMR-IHC)、微卫星区域聚合酶链式反应(MSI-PCR)、MSI二代测序(MSI-NGS)。MMR-IHC检测是临床上MMR状态检测的最常用方法,通过分析四种蛋白来反应MMR的功能状态。PCR法是MSI检测的“金标准”,对正常样本和肿瘤样本扩增的DNA片段大小进行电泳测量和比较。NGS可以检测DNA MSI状态,因其成本较高且耗时长等特点,目前未能在临床实践中常规使用,但有研究证明,不同NGS平台的肿瘤基因测序与PCR法检测MSI的符合率达95% [3] 。
亚洲癌症研究组织(ACRG)将胃癌分为MSI和微卫星稳定(Microsatellite Stability, MSS)两大类型 [4] 。MSI胃癌的发病率差异性较大,占胃癌患者总数的8%~25% [5] ,常见于老年女性,具有远端胃癌、肠型(Lauren分型)、较早的病理分期(II和III期)、少淋巴结转移等特点 [6] 。与MSS胃癌相比,单纯手术治疗的MSI型胃癌患者预后较好 [7] 。另外MSI-H肿瘤具有高肿瘤负荷和细胞毒性T淋巴细胞浸润等特点,表现出活跃的免疫微环境,对于MSI型胃癌来说,传统的治疗方案包括化疗、靶向治疗获益都十分有限,但易从免疫治疗中获益 [8] [9] 。比如在KEYNOTE-062研究中,帕博利珠单抗单药组的ORR为57.1% (95% CI:28.9%~82.3%),帕博利珠单抗联合化疗组的ORR为64.7% (95% CI:38.3%~85.8%),单纯化疗组的ORR为36.8% (95% CI:16.3%~61.6%) [10] 。
目前国内关于胃癌MSI的报道较少,本研究拟对IHC结果为dMMR的胃癌利用多重PCR法进行检测MSI,比较胃癌中MMR/MSI不同检测方法一致性,同时分析dMMR胃癌临床病理特征和预后,指导临床诊疗。
2. 材料与方法
2.1. 材料
研究选取2020年3月至2022年7月青岛大学附属医院术前未经治疗、接受胃癌根治术的错配修复(MMR)蛋白IHC检测结果为dMMR的胃腺癌病例共85例。
2.2. 方法
2.2.1. 免疫组化检测及病理质控
85例术后病理样本均经3.7%中性甲醛固定,石蜡包埋,3 μm切片,在Roche Benchmark XT或Benchmark Ultra平台进行免疫组化染色,使用的原装即用型抗体克隆号分别是:ES05 (MLH1)、FE11 (MSH2)、EP49 (MSH6)、EP51 (PMS2)。
由2名病理医师评估HE切片上的肿瘤组织含量,并对IHC结果进行重新核实,达成一致。
2.2.2. PCR检测MSI状态
对85例dMMR胃癌样本使用商品化试剂盒Microread对肿瘤组织和正常组织NDA中NR21、Bat26、NR27、Bat25、NR24、Mono27 6个单核苷酸微卫星位点进行检测。6个单核苷酸微卫星位点中2个或2个以上出现不稳定状态定义为MSI-H,1个位点出现不稳定状态定义为微卫星低度不稳定(MSI-L),没有位点出现不稳定状态定义为MSS。
2.2.3. 收集85例胃腺癌患者临床资料
包括年龄、性别、肿瘤位置、分化程度、Lauren分型、TNM分期(UICC/AJCC第8版)、HER2 (FISH/SISH检测)、EBER、PD-L1 CPS (22C3)、吸烟史、饮酒史、肿瘤家族史、是否接受术后辅助化疗等临床资料,并对入组患者进行复发及生存随访。本研究经青岛大学附属医院伦理委员会审核批准(审批号QYFYWZLL28299)。
3. 结果
3.1. MMR IHC检测结果
对85例胃癌样本MMR IHC结果的重新判读与复核,均为dMMR,其中MLH1蛋白与PMS2蛋白共同缺失80例(80/85,94%),另PMS2蛋白单独缺失2例,MSH6蛋白表达单独缺失1例,MSH2、MSH6蛋白共同缺失1例,MLH1、PMS2、MSH2蛋白共同缺失1例。
MSI PCR检测结果:85例经PCR法检测MSI胃癌样本中,MSI-H为82例,MSS为3例。在IHC复核为dMMR与经确认MSI-H病例中,dMMR与MSI-H的一致率为96.47% (表1和图1)。

Table 1. Immunohistochemical detection results of mismatch repair protein and microsatellite instability test results based on multiplex PCR method in 85 gastric cancer samples (example)
表1. 85例胃癌样本错配修复蛋白免疫组化检测结果和基于多重PCR法的微卫星不稳定检测结果(例)
MSI-H:微卫星高度不稳定;MSS:微卫星稳定。

Figure 1. Immunohistochemical staining of mismatch repair protein in representative cases between dMMR and MSS (immunohistochemical staining ×100)
图1. dMMR与MSS不一致代表性病例错配修复蛋白免疫组织化学染色(免疫组织化学染色×100)
3.2. dMMR胃癌患者临床病理特征
符合纳入标准的85例患者中,男性52人,女性33人,初诊时中位年龄在70岁(45岁~86岁),有饮酒史患者占31.8% (27/85),有肿瘤家族史患者占30.6% (26/85),好发于胃窦,占76.5% (65/85),Lauren分型方面肠型、弥漫型、混合型分别占33.0%、23.5%、43.5%,分期以II期为主(54.1%),其次为III期(25.9%),I期为20.0%,PD-L1表达CPS ≥ 5 (81.2%)、CPS 1~4 (8.2%)、CPS < 1 (3.5%),EBER表达为阴性(98.9%)、阳性(1.1%),HER2基因均无扩增(100%),未接受辅助化疗的患者68.2%,截至随访时间,有85.9%患者未出现复发以及转移(中位随访时间17月) (表2)。

Table 2. Clinicopathological features of 85 dMMR GC patients
表2. 85例dMMR胃癌患者临床病理特征
续表
3.3. 免疫组化染色和PCR检测示例
如图1。
MSI多重荧光PCR检测结果:
癌组织:NR21阴性 Bat26阴性 NR27阴性 Bat25阴性 NR24阴性 Mono27阴性
正常组织:NR21阴性 Bat26阴性 NR27阴性 Bat25阴性 NR24阴性 Mono27阴性
结果判读:MSS稳定型
如图2。
MSI多重荧光PCR检测结果:
癌组织:BAT26阳性 BAT25阳性 D5S346阳性 D17S250阴性 D2S123阳性
正常组织:BAT26阴性 BAT25阴性 D5S346阴性 D17S250阴性 D2S123阴性
结果判读:MSI-H用药指导:高频型
4. 讨论
胃癌作为目前全球第五大常见恶性肿瘤和第三大癌症死亡原因,其预后不仅与临床分期有关,还取决于不同的组织病理学特征和特定的分子分型。MSI状态可以反应肿瘤的预后情况,例如II期MSI-H结直肠癌(CRC)预后良好,其不能从氟尿嘧啶类辅助化疗中获益,因此不推荐辅助化疗 [11] 。同样MSI-H状态与早期胃癌的良好预后相关 [6] ,但也有研究认为III期MSI-H型胃癌的围手术期化疗可能使患者获得更好的生存获益 [8] 。与此同时MMR检测还可以指导个体化治疗方案的制定。对于dMMR胃癌来说较强的免疫原性、广泛的免疫检查点表达使其对免疫治疗有较强反应。也有研究表明10% MSI胃癌病例表现出家族聚集性,可能与Lynch综合征相关,因此,MMR检测可以帮助早期筛查出家族中有遗传性癌症风险的人群 [12] 。
目前检测MMR的几种方法中常用的是MMR-IHC和MSI分析(利用PCR法或者NGS来检测DNA中的微卫星稳定性)。上述方法各有利弊,需要根据患者具体病情以及经济状况进行选择,其中IHC普及范围广,灵敏度高,便宜易行,通过检测四种错配修复蛋白即可确定,但有可能漏掉一些其他MMR蛋白引起的异常,而且由于肿瘤的异质性,整个肿瘤的评分有可能不一致。PCR检测的稳定性高,能够更客观地进行评估,但费用较高,且对样本的要求高,需要与正常组织对照方能得出结果。NGS是三者当中费用最高的,但优势在于对样本的兼容性更好,肿瘤和血液样本均可以完成检测,对于需要同时检测肿瘤驱动基因、治疗相关基因突变的患者更为合适,同时可以减少人为和实验室间的差异 [13] 。
应用不同MMR检测方法时需要注意不同检测结果一致性问题,有研究表明MMR-IHC和MSI分析的不一致率为1%~10%,故应该重视检测技术相互验证。其中最常见的不一致的原因是MSS状态的MSH6表达缺失,由于MSH6和其他MMR蛋白之间存在功能重复,当MSH6单独缺失时,MSH2/MSH3异源二聚体替代MSH6部分活化MMR系统,从而保持MSS状态 [14] 。本研究利用IHC法检测结果为dMMR的85例胃癌病例作为研究对象,对其结果进行复核和PCR法的验证,结果提示85例经PCR法验证MSI胃癌样本中,有3例dMMR样本检测为MSS,其中有两例为MLH1/PMS2表达缺失(图1),有一例为PMS2表达缺失,未检测到单独MSH6表达缺失,可能与本研究地域不同、样本量不足等有关。
在临床实践中,IHC检测和基于PCR的MSI检测是在胃癌中评估MMR状态的两种常用方法,吻合率和特异度较高,灵敏度 > 90% [15] 。本研究应用多重PCR验证吻合率达96%,与上述研究结果一致。在其他MSI常见肿瘤如结直肠癌和子宫内膜癌中,利用IHC法和PCR法检测MSI理论上也高度一致 [16] ,国内外已有研究报道显示子宫内膜癌中使用免疫组化法检测MMR蛋白和使用多重PCR法检测MSI状态,两者吻合率达90%以上 [17] [18] 。然而,尽管这两种方法通常很可靠,但在特定情况下,可能会出现假阳性或假阴性结果,必要时可以同时使用MMR-IHC和MSI分析两种方法来提高MMR状态的确定性。另外在有条件时可以考虑追加NGS检测。一项包括645例上消化道肿瘤的大型研究发现,MSI-NGS和MMR-IHC之间的一致性为100%,20例MSI患者中有19例(95%)存在至少1种MMR蛋白表达缺失,其中14例MLH1和PMS2缺失;2例PMS2缺失;2例MSH2和MSH6缺失;1例MSH6缺失,最后1例四种MMR蛋白的5%肿瘤核染色,被列入为不确定 [19] 。由此可见,利用NGS法检测MSI状态与IHC法或者PCR法一致性较高,而且可能更具独特的优势,可以实现单瘤种的所有基因变异及泛瘤种的热点基因变异同时检测 [20] ,同时Latham等 [21] 发现,在忽略肿瘤类型、家族遗传史等因素下,MSI-NGS可以帮助确定Lynch综合征在实体肿瘤中的患病率和评估胚系基因的状态。
我们发现除了部分dMMR胃癌患者经PCR法验证为MSS外,还存在少部分pMMR胃癌患者经PCR法检测为MSI-H (图2)。因为MMR蛋白IHC依赖于染色过程,存在假阳性问题,如三分之一的MLH1突变是编码非功能蛋白的错义突变,通过IHC可以检测到MLH1的表达但实际MMR蛋白并无功能,肿瘤为MSI [22] 。其他少见的原因比如实验室技术问题,包括PCR反应条件等,这种情况可能需要重新检测或审查实验室技术的标准化程度,另外还有肿瘤异质性和样本质量问题,肿瘤组织不同区域可能具有不同的MMR状态,样本质量不佳可能会导致不一致的结果 [14] 。近期,美国病理学家协会(CAP)发表MMR和MSI检测指南,推荐在面对上述不一致情况时,首先考虑进行复核,确保检测结果的准确性,包括重新进行免疫组化和PCR检测不同肿瘤组织,以验证结果的一致性,也可以考虑采用其他方法来评估MMR状态,如NGS检测。同时推荐对于正在考虑免疫检查点抑制剂治疗的胃食管和小肠癌患者,应使用MMR-IHC和/或MSI PCR,优于NGS的MSI检测 [23] 。
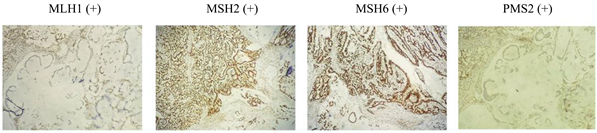
Figure 2. Immunohistochemical staining of mismatch repair protein in representative cases inconsistent pMMR and MSI-H (immunohistochemical staining ×100)
图2. pMMR与MSI-H不一致代表性病例错配修复蛋白免疫组织化学染色(免疫组织化学染色×100)
本研究纳入的85例dMMR胃癌在远端、老年男性患者中更为常见,Lauren分型中差异不明显,TNM分期以II、III期为主。与TCGA的分类结果以及以往研究报道的微卫星高度不稳定的胃癌的患者常见于老年女性、Lauren肠型、TNM分期较早(多为I或II期)有一定差异 [5] [24] [25] 。这种差异很有可能与地理差异有关。同时本研究dMMR胃腺癌患者术后未出现复发转移比例为85.9% (中位随访时间17月),提示总体预后较好,可能与分期相对较早等因素有关,还需要延长随访时间和扩大病例数量,进一步追踪优化生存数据。
MSI-H型胃癌除了具有独特的临床病理特征以外,在分子基因表型方面也值得关注。本研究中,大部分患者呈现出PD-L1高表达,这与之前的研究相似 [26] ,提示我们MSI胃癌微环境中存在多种免疫分子的表达,使其成为免疫治疗的优势人群,通过探究MSI胃癌与PD-L1的相互作用机制,可以为MSI-H型胃癌患者晚期以及围手术期免疫治疗提供更多理论依据。本研究入组的85例患者HER2基因均无扩增,结合亚洲癌症研究小组(ACRG)的研究结果,61例MSI-H胃癌患者均未见HER2扩增,HER2扩增更常见于MSS胃癌患者,提示胃癌MSI-H与HER2基因扩增可能存在互斥关系,但因样本量都较少,所以有待进一步研究。
综上所述,在本研究中dMMR的胃癌IHC和多重PCR检测结果一致率很高,可以互为补充,但仍需要重视检测技术相互验证。dMMR胃癌有独特的临床病理特征,尤其是在分子基因表型方面,评估MMR表达状态和基因表型有助于分析患者预后和指导临床治疗。
另外本研究是一项单队列、回顾性研究,缺少对照数据,由于条件所限缺少使用NGS检测MSI状态的结果,无法进一步分析不同检测手段对胃癌MSI状态的影响。下一步我们将扩充样本量并对纳入研究的患者进行二代测序(NGS)以明确MSI状态,并将开展与MSS人群临床病理特征进行对照的研究来更好地得出不同MMR状态胃腺癌患者的特征及预后情况。同时本研究随访时间较短、随访资料有限,需要继续跟踪随访,为胃癌的预后和治疗提供更多的临床数据信息。
基金项目
中关村精准医学基金编号GXZDH15题目:PTEN介导PI3K/AKT/FOXO3通路促进自噬效应调控胃癌耐药的机制研究。
NOTES
*通讯作者。