1. 引言
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的原发性肝癌,是第六大最常见的肿瘤和第三大癌症相关死亡原因 [1]。大多数肝细胞癌患者起病隐匿且伴有不典型临床症状,确诊时常为中晚期。目前,经动脉化疗栓塞术(transcather arterial chemoembolization, TACE)已被普遍认为是晚期HCC患者的标准治疗方法 [2] [3],然而,TACE已被证实可诱导缺氧并提高HCC组织中促血管生成因子血管内皮生长因子(vascular endothelial growth factor, VEGF)的水平,后者参与肿瘤的生长、发展和转移 [4]。
甲磺酸阿帕替尼片(简称:阿帕替尼)作为一种新型的抗血管生成小分子,通过有效结合和抑制VEGF受体2 (VEGFR-2),可以有效的延缓TACE后肿瘤新生血管形成,进而发挥抗癌作用 [5]。Zhen等人证明阿帕替尼对治疗晚期肝癌有效,疾病控制率(disease control rate, DCR)为60% [6]。因此,将TACE与全身性抗血管生成药物结合的理论基础在科学上是合理的,其目的是控制TACE后血管生成。越来越多的研究报告指出,阿帕替尼联合TACE能够明显地延长中晚期HCC患者的无疾病进展生存期(progression-free survival, PFS) [7]。目前,对于晚期肝癌关于TACE联合阿帕替尼治疗的临床研究并不是很多,因此,本研究的目的是评估TACE联合阿帕替尼治疗晚期肝癌的安全性和有效性。
2. 资料与方法
2.1. 一般临床资料
回顾性分析2017年12月至2018年10月就诊于新汶矿业集团中心医院接受TACE联合口服阿帕替尼的 40例患者临床资料,所有患者诊断符合2017年版原发性肝癌诊疗规范标准 [8],并接受1次或多次TACE,术后3 d均开始口服阿帕替尼治疗。在治疗前获得所有患者的书面知情同意,本研究经过本院伦理委员会的同意。纳入标准:根据美国肝病研究协会肝病指南1) 诊断为原发性肝癌的患者;2) 患者的年龄 ≥ 18岁;3) 巴塞罗那B或C期;4) Child-Pugh A级或B级;5) ECO G评分0或1分。2;6) 患者预期生存时间大于3个月。排除标准为:1) 继发性肝癌患者;2) 严重凝血障碍患者;3) 心、肺、肾和其他重要器官存在严重功能障碍;4) 停用阿帕替尼超过1个月。共有40名患者(29名男性,11名女性)纳入本研究。患者平均年龄53.20 ± 8.90岁。28例(70%)患者伴有乙肝病史,10例(25%)伴有丙肝病史。在所有患者中,29例(72.50%)为Child-Pugh A级,11例(27.5%)为Child-Pugh B级。巴塞罗那临床肝癌B期和C期患者分别为16例(40.00%)和24例(60.00%)。有19名患者(47.50%)的ECOG评分为0,门静脉癌栓18例(45.00%),患者基线资料见表1。

Table 1. Baseline data of patients with primary liver cancer before operation
表1. 原发性肝癌患者术前基线资料
2.2. 治疗方法
采用Seldinger技术常规行右侧股动脉穿刺,置入5F导管鞘,将5F-Yashiro或RH (Terumo, Japan)导管通过5-F血管鞘引入腹腔干动脉,在DSA指导下对肝总动脉进行血管造影,如果未观察到明确的肿瘤供血动脉,应进行肠系膜上动脉、膈下动脉、肾上腺动脉和肠系膜上动脉的血管造影以确定肿瘤供血动脉。在确认肿瘤的血液供应后,2.7F的ProGreat微导管(Terumo, Japan)被超选择性地插管到肿瘤供血动脉中,采用表柔比星及超液化碘油乳剂栓塞肿瘤血管,必要时辅以颗粒栓塞剂。最后,进行另一次血管造影以确定血管闭塞的程度。所有患者至少接受一次TACE,治疗时间考虑每个患者的身体状况,肝功能,肿瘤复发和血液指标。患者最初被建议每天服用阿帕替尼(江苏恒瑞医药股份有限公司产品,国药准字:H20140103)进行治疗500 mg,若服药期间出现与阿帕替尼相关的III级或III级以上不良反应时,剂量减半或暂停用药。阿帕替尼口服给药周期为28天。阿帕替尼从TACE后第4天开始口服,并在每次TACE治疗前4天停药。
2.3. 观察指标和标准
患者每隔1~3个月行增强影像学检查(CT或MRI),近期疗效采用最新修订的实体瘤疗效评价标准(modified Response Evaluation Criteria in Solid Tumors, mRECIST) [9] 标准进行评价,分为完全缓解(complete response, CR):所有靶病灶动脉期没有强化;部分缓解(partial rate, PR):所有目标病灶的长径总和减少≥30%;疾病稳定(stable disease, SD):变化介于PR和PD之间;PD:所有目标病灶的长径总和增加≥20%,或出现新发病灶。分别在术前和术后检测血清白蛋白(ALB)、总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)等参数,以评估患者的肝功能情况。PFS (progression-free survival, PFS)被定义为第一次接受TACE治疗至肿瘤进展的时间。OS (overall survival, OS)指的是患者接受第一次TACE治疗直至死亡或最后一次随访的时间。药物不良反应评价采用美国国家癌症研究所(NCI)常见毒性标准(NCICTC v 4.0)。
2.4. 统计学分析
使用SPSS 21.0统计软件进行数据分析。分类变量表示为数字或百分比(%),连续变量表示为平均值 ± 标准差。患者治疗前后差异采用配对t检验或符号秩和检验比较。Kaplan-Meier生存曲线用于计算PFS和OS。p值 < 0.05表示差异具有统计学意义。
3. 结果
3.1. 近期疗效
截至2019年3月10日,所有患者均随访成功,在整个治疗过程中,29例(90.6%)患者口服阿帕替尼500 mg,只有3例(9.4%)患者由于药物耐受性不好而减至250 mg。TACE治疗频率为3.60 ± 1.10。通常于TACE术后3 d开始口服阿帕替尼,初始剂量250 mg/d,同时根据mRECIST标准评价患者联合治疗1个月、治疗后3个月后的疗效(表2)。治疗后1个月的ORR和DCR分别是62.50%和92.50%。治疗后3个月,ORR (65.00%)略高,DCR (90.00%)较低。

Table 2. The follow-up results according to mRECIST criteria n (%)
表2. 根据mRECIST标准的随访结果n (%)
CR: complete response; PR: partial response; SD: stable disease; PD: progressive disease; ORR: objective response rate; DCR: disease control rate.
3.2. 肝功能的变化
与术前相比,术后1周AST、ALT和TBil升高,并且ALB水平降低,差异具有统计学意义(p < 0.05),但所有这些水平在第一次手术后的第一个月恢复到基线水平。见表3。

Table 3. The changes of liver function indexes in patients with primary liver cancer before and after treatment
表3. 原发性肝癌患者治疗前后肝功指标的变化
3.3. 治疗相关的不良反应
包括栓塞后综合征和阿帕替尼相关的不良反应。常见的不良反应,如腹部疼痛、体温升高、呕吐或恶心等胃肠道反应,以及阿帕替尼相关的副作用,主要包括乏力、骨髓抑制、血压升高、手足反应、腹泻和蛋白尿,都是轻微的,在本研究中没有发生中毒性死亡。在40名患者中,4名患有高血压,2名患有3级腹泻,他们被迫将阿帕替尼的剂量减少一半。15例(37.50%)有发热,6例(15.00%)有呕吐,2例(5.00%)有蛋白尿。11名患者(27.50%)有手足综合征,8名(20%)患者有疲劳症状。
3.4. 远期疗效
图1和图2分别描绘了PFS和OS的Kaplan-Meier曲线。中位数PFS为10.50个月(95% CI,8.95~12.05个月),中位OS为23.00个月(95% CI,14.95~31.07个月) (图2)。

Figure 1. The median progression-free survival time curve
图1. 中位无进展生存时间曲线
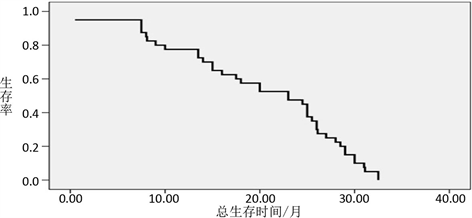
Figure 2. The median overall survival time curve
图2. 中位总生存时间曲线曲线
4. 讨论
肝动脉化疗栓塞术目前是中晚期肝癌首选的微创治疗方式 [10]。但是,该治疗方式存在一些缺点,如短时间内需要多周期的反复介入治疗、不能彻底灭活肿瘤、局部缺氧诱发肿瘤新生血管的生成和易出现肿瘤复发和转移。最新的VEGFR-2抑制剂——阿帕替尼具有以下作用:VEGF刺激的内皮细胞迁移和增殖得到明显的抑制、微血管密度显著降低,肿瘤细胞加速凋亡,从而延缓肿瘤的复发 [11]。多项研究指出,肿瘤患者接受阿帕替尼治疗后,其OS和PFS得到显著延长,DCR得到显著提升 [12]。在目前的研究中,患者的肝功能在治疗后第一周恶化,并在手术后1个月恢复。与以前专注于传统TACE的研究相比,我们研究中的肝脏损伤相对较轻 [13]。虽然这种联合疗法在肝癌的治疗中取得了很好的疗效,但也说明了一些不良反应。总的来说,不良反应可分为两类,包括栓塞后综合征和阿替尼相关的不良反应。然而,没有观察到4级AEs和治疗引起的死亡。在整个过程中,两个人患有高血压,一个人患有3级腹泻,他们被迫将阿帕替尼的剂量减少一半。其余患者均耐受不良反应,经对症治疗后所有症状均缓解。总的来说,患者的不良反应是可以接受的,没有发生严重的不良反应。
在我们的研究中,我们发现TACE联合阿帕替尼对晚期HCC患者显示出良好的疗效:术后1月和术后3月的ORR率分别为62.5%和65.0%。此外,术后1月和术后3月的DCR率分别高达92.50%和90.00%,与李等人所做比较,在接受TACE联合阿帕替尼治疗的晚期肝癌患者中,我们研究中术后1月的ORR略低(62.50%比66.70%),但在术后3月的ORR高得多(65.00%比45.80%) [14]。虽然这些不是面对面的比较,但仍然可以得出结论,TACE联合阿帕替尼与单独使用TACE或阿帕替尼单一疗法相比较,无论在OS还是PFS方面,得到显著改善,显示出良好的治疗效果。在目前的研究中,我们发现中位数OS比既往报道的TACE单药治疗的中位OS长(23.00个月对11.50个月) [15]。研究(13个月)相比,我们的研究可以看到生存时间的轻微优势 [16]。索拉非尼与TACE联合治疗的II期试验显示出良好的局部疾病控制率和生存率 [17]。越来越多的研究表明,TACE (或DEB-TACE)与Apatinib (或sorafenib)联合治疗对晚期HCC患者有生存益处 [18]。
综上所述,TACE联合阿帕替尼治疗晚期肝癌患者,安全、有效,这种联合治疗有希望能够提高中晚期HCC的临床疗效,降低肿瘤的负荷,可以明显提高患者的生存质量。本研究研究对象很少,随访时间不够,此研究可能受到主观选择偏差的影响,仍需要进行大样本多中心前瞻性研究,以验证DEB-TACE与阿帕替尼联合应用的效果。
基金项目
吴阶平医学基金(320.6750.19088-23)。