1. 引言
蝉花是由蝉棒束孢寄生在蝉若虫体内并利用寄主体内的营养物质,在适宜的环境中生长形成的虫菌复合体 [1]。蝉花又名蝉菌、蝉蛹草、胡蝉等。蝉花在微生物分类学中属于虫草科棒束孢属。蝉花富含多糖、甘露醇、虫草酸、蛋白质、麦角固醇、多种微量元素等有效成分,与冬虫夏草一样同属于虫菌复合体。温鲁等学者将蝉花孢梗束与蛹虫草和冬虫夏草进行了比较,测定结果表明蝉花孢梗束是一种优质虫草,具有很大的研究前景 [2] [3]。
蝉花孢梗束作为药用真菌的使用已有多年的历史了,具有多方面的药用价值。Fujita等从蝉花孢梗束中分离得到的ISP-1,具有显著的免疫抑制性 [4]。现代医学也对蝉花孢梗束进行了研究,研究表明蝉花孢梗束具有调节免疫功能、散热镇静、调节肾功能等作用 [5]。
超高压提取技术的原理是在高压力的推动下一方面可以将提取剂迅速地渗透到细胞内部,另一方面在升压和卸压的过程中压力的骤变对细胞造成强烈的冲击致使其发生裂解,使细胞内部的有效成分随着溶剂快速地流到细胞外 [6]。超高压技术已广泛应用于提取工艺的研究中,并证实该技术不仅操作简单而且提取率高,超高压技术提取可以有效避免有效物质因热效应而导致生理活性的降低甚至是分解 [7]。
目前,日本在超高压技术这方面的研究位居领先的水平 [8]。在我国,胡小松等利用超高压技术研究其对果蔬汁的杀菌效果、果蔬感官及品质、果蔬汁黏度及颜色、嗜热链球菌活性等 [9] [10] [11]。也有人研究了超高压对鲈鱼、茶叶等挥发性成分多方面的影响 [12] [13]。
此项研究利用超高压技术处理蝉花孢梗束,研究蝉花孢梗束超高压处理的最佳工艺,以期为今后的蝉花孢梗束加工及其他制品的超高压工艺提供理论上的支持。
2. 材料与方法
2.1. 实验材料与仪器
2.1.1. 材料和试剂
蝉花孢梗束粉:购于浙江泛亚生物医药股份有限公司;真空包装袋:购于兴隆包装。
乙醇(分析纯,天津市科密欧化学试剂有限公司)、冰醋酸(分析纯,江苏强盛功能化学股份有限公司)、盐酸(分析纯,上海振企化学试剂有限公司)、磷酸二氢钾(分析纯,天津博迪化工股份有限公司)、考马斯亮蓝G250 (85%,国药集团化学试剂有限公司)、乙酸铵、高碘酸钠、磷酸、乙酰丙酮(分析纯,天津市科密欧化学试剂有限公司)、甲醇、乙腈(色谱纯,天津市科密欧化学试剂有限公司)。
2.1.2. 仪器与设备
S-433D全自动氨基酸分析仪(德国赛卡姆),FA2204B电子分析天平(上海越平科学仪器有限公司),JP-400B小型高速粉碎机(浙江永康市久品工贸有限公司),DP-01真空泵(天津市东康科技有限公司),DHG-9070B电热恒温鼓风干燥箱(上海中贤恒温设备厂),1260高效液相色谱仪(安捷伦仪器有限公司),T6新世纪紫外可见分光光度计(北京普析通用仪器有限公司),超高压仪(天津华泰森淼生物工程技术股份有限公司),超声波仪(金坛市文华科教实验仪器厂。
2.2. 实验方法
2.2.1. 蝉花孢梗束的核苷提取工艺
1) 工艺流程
蝉花孢梗束粉末→加溶剂混匀→超声波处理30 min→真空包装(5 mL/包)→超高压提取→离心→取上清液→检测
2) 操作要点
将精确称量的蝉花孢梗束粉末和水按比例装在真空包装袋中。在30℃、300 W条件下超声波提取30 min,超声处理时一样要将包装袋完全浸没在水中。真空包装采用的条件为真空30 s,封口3 s,冷却3 s,使用封口机封口后充分混匀。每个样品需要进行高效液相色谱仪的样品都要经0.45 μm微孔滤膜过滤。
2.2.2. 实验设计
1) 单因素实验
影响超高压对蝉花孢梗束成分的溶出有很多因素。如压力强度、保压时间、蝉花孢梗束的料液比以及溶剂等。在进行正交实验之前,应先通过单因素实验来选取合适的因素和水平。分别以不同的压力、保压时间、料液比以及溶剂做单因素实验,并以腺苷的提取量为指标,考察各单因素对腺苷的影响。
① 压力强度
设定保压时间为15 min、蝉花孢梗束料液比为1:20 (m:V)、提取剂为50%的乙醇的条件下:考察在(0、100 MPa、200 MPa、300 MPa、400 MPa、500 MPa)的压力梯度下对蝉花孢梗束中的腺苷含量的影响。
② 保压时间
设定为最佳压力、蝉花孢梗束料液比为1:20 (m:V)、提取剂为50%的乙醇的条件下:考察(0、5 min、10 min、15 min、20 min、25 min)的保压时间的梯度下对蝉花孢梗束中的腺苷的影响。
③ 料液比
设定为最佳压力和保压时间、提取剂为50%的乙醇的条件下:考察不同在(1:10、1:50、1:100、1:150、1:200,m:V)的蝉花孢梗束料液比梯度下对蝉花孢梗束中的腺苷含量的影响。
④ 溶剂
设定为最佳压力和保压时间、蝉花孢梗束料液比的条件下:考察不同乙醇浓度的溶剂(0、25%、50%、75%、100%)对蝉花孢梗束中的腺苷含量的影响。
2) 正交实验
根据单因素实验的结果,选取最佳料液比、压力强度、保压时间以及溶剂的水平,详见表1,采用L9(34)进行正交实验。按照“2.2.1”的方法处理并检测。

Table 1. Factor levels of orthogonal experimental design
表1. 正交实验因素水平表
将正交实验结果进行分析总结得到最优方案后再进行3组验证实验,通过与上述单因素实验和正交实验得到的结果进行对比。验证实验组所得到的数据结果与上述正交实验的得到的数据进行对比,若没有显著性差异,说明上述实验可靠,就能进一步确定提取过程中的最佳工艺条件。
2.3. 测定方法
2.3.1. 腺苷含量的测定
腺苷含量参考牛聪聪等人的方法进行测定 [14] [15]。
2.3.2. 甘露醇的测定
甘露醇含量参考李颜等人方法的比色法进行检测 [16]。
2.3.3. 麦角固醇的测定
麦角固醇含量的测定参考孙佰申等的方法 [17]。
2.3.4. 可溶性蛋白质的测定
可溶性蛋白质含量参考黄婉玉等人的方法测定 [18]。
2.3.5. 游离氨基酸的测定
游离氨基酸的测定参考姜荷等人的方法测定 [19]。
2.3.6. 荧光光谱的扫描
采用李双芳的荧光扫描方法,利用荧光分光光度计,对样品进行扫描 [20]。
2.3.7. 紫外光谱的扫描
用紫外分光光度计进行200~400 nm之间的全波段扫描。
2.4. 数据处理与统计分析
采用SPSS 19.0软件进行显著性分析,采用Duncan新复极差法对不同实验组间数据进行差异显著性比较分析,P < 0.05表示差异显著,P < 0.01
表示差异极显著。
3. 结果与分析
3.1. 单因素实验
蝉花孢梗束经不同压力强度处理后,腺苷提取量在0~400 MPa随压力强度的升高而上升,但在500 MPa时有明显的下降趋势,如图1(A)所示。根据Le Chatelier原理,当压力强度增大时,体系的平衡总是向着减少压强的方向移动,这样便有利于乙醇进入到细胞的内部与腺苷物质结合,逐渐使这种结合达到平衡状态 [21] [22]。由于在升压和卸压的变化过程中,细胞容易破裂,从而扩大了乙醇与腺苷物质的接触面积,使有效成分更迅速的与溶剂结合,减少了提取的时间。从图1上可以看出当压力强度为400 MPa时,腺苷提取量最高,且于附近两个水平的差异较大,所以正交实验压力强度设定范围在300 MPa到450 MPa之间。
从图1(B)可知,随着保压时间的延长,蝉花孢梗束中的腺苷提取率先是有显著增加;但超过15 min后,腺苷浸出量增加趋于平缓可能是因为腺苷溶出已经达到平衡状态,再延迟时间腺苷含量也很难再增加。故后续实验中考虑到提取的成本,最佳保压时间定在15 min,而正交实验中保压时间设定在15 min到20 min之间。
不同料液比下所测得的样品中腺苷提取量,结果见图1(C)。随着溶剂量的不断增大,腺苷浸出量也不断增加。当乙醇与蝉花孢梗束粉末的比值增大时,乙醇与有效成分接触的机会就会增多。当达到饱和状态之前,腺苷浸出量不断增加的。但当料液比过大时腺苷的提取量呈现出下降趋势,料液比为1/50腺苷的提取量最高。正交实验时选择料液比的水平范围在1:40和1:60 (g/mL)之间。
不同浓度的乙醇溶液所提取的样品中的腺苷提取量,结果见图1(D)。由图可以看出,腺苷的提取量呈现出先增加后减少的变化趋势,25%乙醇腺苷提取量高于其他乙醇浓度。故选25%乙醇最佳水平,正交实验的设定范围为20%~30%乙醇溶液。
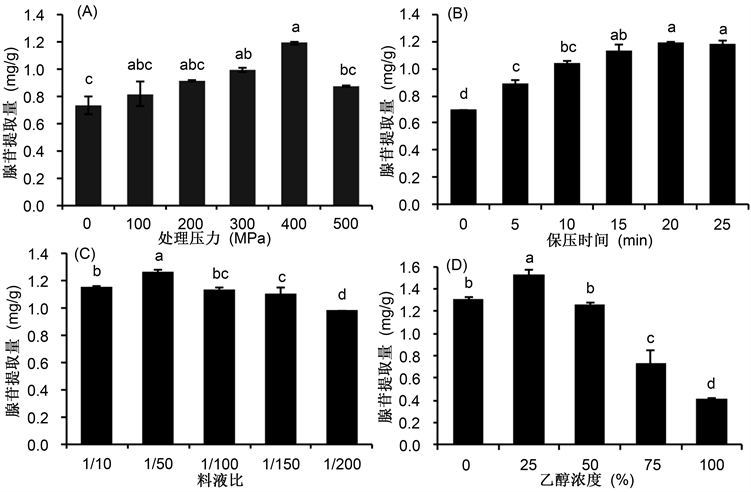
Figure 1. Effects of different factors on the extraction rates of adenosine
图1. 不同因素对腺苷提取量的影响
3.2. 正交实验分析
在单因素实验的基础上,确定蝉花孢梗束中腺苷提取工艺的压力强度、保压时间、料液比、溶剂的最佳水平范围。采用L9(34)设计实验,样品按照“2.2.1”处理;用高效液相色谱仪测定腺苷提取量,结果如表2。

Table 2. Results of orthogonal experiment
表2. 正交实验结果分析
从表2可看出,4个因素影响蝉花孢梗束腺苷提取率大小依次是:压力强度 > 溶剂 > 保压时间 > 料液比。当压力为350 MPa,溶剂为20%的乙醇,保压时间为15 min,料液比为1:40时腺苷提取量最高。在此条件下进行验证实验,腺苷提取量为(1.80 ± 0.17) mg/g。经分析得两者之间的无显著性差异(P > 0.05),表明此最佳工艺参数具有良好的可靠性。
3.3. 主要成分变化分析
在超高压最佳工艺条件下和未经超高压处理,其余条件:溶剂为20%乙醇、保压时间15 min、料液比1:40分别对蝉花孢梗束样品进行提取处理。分别测定提取液中麦角固醇、甘露醇、可溶性蛋白和游离氨基酸的含量,结果如表3所示。由表3可知,经过超高压处理后的样品提取液中的麦角固醇、甘露醇、可溶性蛋白和游离氨基酸的含量明显高于未经超高压处理样品提取液(P < 0.05)。表明超高压技术能有效促进蝉花孢梗束中的营养和功能成分溶出。

Table 3. Composition comparison of extracts before and after ultra-high pressure process
表3. 超高压前后提取液的成份比较
注:不同小写字母表示同行数据之间在P < 0.05水平差异显著。
3.4. 图谱分析
3.4.1. 紫外全波段扫描分析
如图2所示,在220 nm及260 nm附近出现2个明显的吸收峰,表明蝉花孢梗束提取液中含有大量的具有共轭双键基团的物质和芳香族化合物 [23]。且在超高压前后,250~280 nm附近的吸收峰强度明显提高,佐证了经超高压处理后核苷、麦角固醇等物质的提取率显著增加。
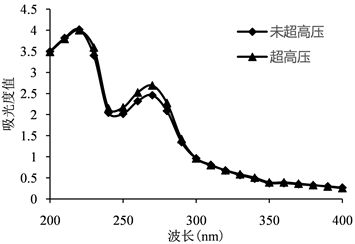
Figure 2. Ultraviolet spectra of the extracts before and after ultra-high pressure process
图2. 超高压前后提取液的紫外光谱图
3.4.2. 荧光分析
将经未经超高压处理(图3(A))和过超高压处理(图3(B))的蝉花孢梗束提取液使用荧光光谱仪在200~600 nm进行光谱扫描,如图3所示,经过超高压处理后,在280~300 nm以及350~400 nm之间的峰强度有了明显的上升。由于超高压处理使蛋白质变性,使原本在蛋白质内部的产生荧光的分子外露。蛋白质的内源荧光的荧光峰位波长为282 nm、303 nm以及348 nm,因此经超高压处理后的样品在这两个波段范围内的峰有明显的增强 [24]。
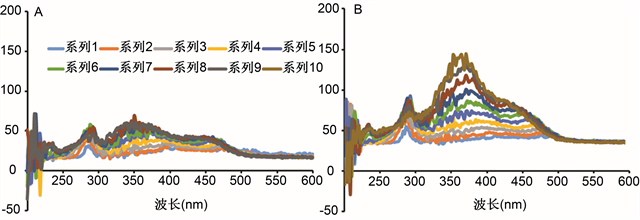
Figure 3. Fluorescence spectra of extracts before and after ultrahigh pressure process
图3. 超高压前后提取液的荧光光谱图
4. 结论
通过单因素和正交实验分析得出超高压提取蝉花孢梗束中腺苷成分的最优工艺为:压力为350 MPa,20%的乙醇,保压时间为15 min,料液比为1:40。经超高压处理后,麦角固醇、甘露醇、可溶性蛋白和游离氨基酸的提取量明显增加,在此条件下的样品经光谱扫描分析发现经过超高压处理后蝉花孢梗束提取液中的紫外和荧光吸收物质都有明显的增多,超高压技术可以有效促进蝉花孢梗束营养和功能物质释放和溶出。本研究的不足之处在于只以腺苷为指标探究了超高压提取蝉花孢梗束成分的提取工艺,下一步将利用多个评价指标研究超高压提取蝉花孢梗束营养和功能物质的工艺。
基金项目
科技部星火计划项目(2015GA710033);滁州学院科研项目(2017PY04);国家级大学生创新创业训练计划项目(201910377026)。