1. 引言
癌症是严重危害人类健康的常见病。传统的肿瘤治疗方法如化疗、放疗、手术常常伴有副作用高、易复发、治疗效率低、耐药性大等缺点 [1] [2] [3]。光动力治疗(PDT)作为一种新的治疗方法,它具有选择性高、治疗效果快、耐药小的优点而备受关注 [4]。光源、光敏剂和氧气是光动力疗法的基本要素 [5]。其原理为:光敏剂(Ps)在适当波长光辐照下,从基态跃迁到三重激发态(3Ps),3Ps与周围氧分子发生能量转移,产生具有细胞毒性的活性氧(ROS),产生的ROS能立即破坏肿瘤细胞内的蛋白质分子和核酸,引起细胞凋亡或坏死 [6]。在光动力疗法中,光敏剂占据至关重要的作用。已有报道使用天然叶绿素降解产物叶绿酸(PPa)为PDT光敏剂 [7] [8]。PPa可用于荧光成像,具有较高的单态氧量子产率、良好的生物相容性和较强的组织穿透能力,表现出良好的PDT效率 [9]。但是,由于其分子小、水溶性差、在生理环境下容易聚集等缺点,限制其广泛应用到肿瘤治疗中 [10]。近年来,金属有机框架(MOFs)在气体储存、化学分离、催化转化、磁性、传感、锂离子储存、智能材料和药物传递等方面具有广泛的应用前景 [11] [12] [13] [14] [15]。特别是在生物医学领域方面,金属有机框架的良好的生物相容性和低毒性优势明显。在光动力中、药物释放中具有广泛应用 [16] [17] [18]。付鑫伟等 [19] 利用金属有机框架(ZIF-8)负载二氢卟吩类光敏剂(Ce6),解决了光敏剂在肿瘤组织中容易聚集的问题。刘志亮等 [20] 合成了不同纳米尺度改性的金属有机框架(UIO-66-NH2)考察了它对5-FU的负载能力和释放能力,结果表明它成功负载5-FU和对5-FU的控释能力。
在本文中,我们采用溶剂热法和物理搅拌法制得Zr-MOF-PPa@PAH,我们验证了ZZr-MOF-PPa@PAH在癌细胞中产生ROS的能力。此外,我们还研究了Zr-MOF-PPa@PAH的体外PDT效率、细胞吸收能力。经实验证实,Zr-MOF作为纳米载体克服了游离PPa在生理环境下容易结块的局限性,提高了PDT的效率。此外,PAH修饰提高了Zr-MOF的稳定性和生物相容性,延长了血液循环时间。因此,我们新设计的PPa传递系统可能是一个很有前途的肿瘤纳米药物PDT平台。
2. 实验部分
2.1. 实验药品及仪器
2.1.1. 实验药品
N,N-二甲基甲酰胺(DMF)、乙酸、乙醇、甲醇均为分析纯品;实验室自制的焦脱镁叶绿酸-a (PPa)无需纯化即可直接使用。2-氨基对苯二甲酸(98%)、ZrCl4 (97%) 、亚甲基蓝(MB 99%) 、PAH (Mw = 15,000~18,000)、1,3-二苯异苯呋喃(DPBF, 97%) [上海麦克莱林生化技术有限公司]。4’,6-二脒基-2苯基吲哚(DAPI高效液相色谱法90%)、2',7'-二氯二氢荧光素二乙酸酯(DCFH-DA 98%)、MTT (97%)、高糖培养基(DMEM)、胎牛血清、0.25%胰蛋白酶、AM/PIA双染色试剂[哈尔滨百杰斯生物公司]。人肝癌细胞HepG-2由哈尔滨工业大学提供。
2.1.2. 仪器
扫描电子显微镜(SEM) (日立S-4800,日立有限公司,日本);透射电镜(TEM, Tecnai G2 f200s-twin);紫外–可见分光光度计(日立有限公司,日本);傅里叶变换红外光谱仪(FTIR) (布鲁克公司,德国);D5005型X射线衍射仪(西门子,德国);酶标仪(WD-2102A,北京六一;物科技有限公司);荧光倒置显微镜(DM IL IED, Leica HistoCore PEARL);X射线光电子能谱(日本UlVAC-PHI公司)。
2.2. 化学合成
2.2.1. Zr-MOF的合成
本文采用溶剂热法合成了MOF。2-氨基对苯二甲酸(NH2-BDC) (108.6 mg)溶于DMF (5 mL)。八水氯化锆(ZrCl4) (56.2 mg)溶于DMF (5 mL)。两种溶液在高压反应釜中混合,并在反应混合物中加入醋酸(1.0 mL)。溶液在120℃加热24小时,产生MOF。然后对样品进行纯化,离心(9000 rpm, 20 min)收集,然后进行溶剂交换(3 × DMF),提取NPs孔内残留的DMF,将沉淀浸泡在丙酮中24 h。此过程重复2次。然后将样品粉末在室温下真空干燥。
2.2.2. Zr-MOF-PPa@PAH的合成
将20 mg MOF纳米材料分散于20 mL乙醇中,超声分散30 min。然后加入5 mL PPa乙醇溶液(1 mg/mL),室温下避光搅拌24 h,样品经纯化后离心(9000 rpm, 20 min),然后进行溶剂交换(3 × 乙醇,3 × 水)。20 mg MOF-PPa在水中分散,超声分散30 min。PAH水溶液(Mw = 18,000, 5 mL, 20 mg)用NaOH溶液(2 M)调节pH值为7.25。然后将PAH溶液加入到上述Zr-MOF-PPa溶液中,在室温下混合,避光搅拌过夜。将获得的Zr-MOF-PPa@PAH纳米颗粒用水洗涤几次,样品离心(9000 rpm, 20 min),真空干燥。
2.3. 粒径、电位和稳定性的试验
利用动态光散射仪(DLS)测定50 μg/mL MOF-PPa的粒径、电位及在含有10% FBSDMEM和PBS的稳定性试验。
2.4. PPa的pH的响应释放实验
称取30 mg Zr-MOF-PPa@PAH,放入透析袋中,一份加入10 mL pH = 7.4的PBS (0.01 M)缓冲溶液,一份加入10 mL pH = 6.4的PBS (0.01 M)缓冲溶液,一份将PBS加入10 mL pH = 5.6的PBS (0.01 M)缓冲溶液缓冲液,放于磁力搅拌器上保持恒温37℃,并以100 rpm的搅拌。从0~12小时,每隔1小时分别取样用紫外–可见分光光度计测量波长670 nm处的峰的吸光度,计算PPa的释放量。
2.5. Zr-MOF-PPa@PAH单线态氧的测定
用DPBF (在DMF中1 mg/mL)为1O2捕获剂,以MB为参比样品,测定PPa,Zr-MOF-PPa@PAH的1O2量子产率。首先,固定待测样品和MB在671 nm处的吸收相同,约为0.10 OD。然后分别加入DPBF (30 µL),经670 nm激光照射(功率密度为0.1 W/cm2),测量在不同时间DPBF溶液在415 nm吸光度,计算随辐照时间的衰减速率ln(A0/At),拟合出一阶线性方程。按公式(1)计算光敏剂的1O2量子产率。
(1)
其中ts和tMB分别为待测样品和MB存在时DPBF的吸收降低至一阶指数衰减的时间。 为MB在DMF中的1O2量子产率,定为0.49. 求得样品Zr-MOF-PPa@PAH和自由PPa的1O2量子产率分别为38.4%和53.6%。
2.6. 细胞培养
肝癌细胞(HepG-2)在含10%胎牛血清和1% 100 mg/mL抗生素(青霉素链霉素)的DMEM中培养,37℃,95%的湿度和5%的CO2。DMEM培养基每2天更换一次。在所有的实验中,细胞用胰蛋白酶从培养板上消化,然后重悬在新鲜培养基中培养。
2.7. 细胞毒性检测
将HePG-2细胞置于DMEM中96孔(100 μL,4000个细胞)中。每孔孵育24 h。然后将不同浓度的PPa或Zr-MOF-PPa@PAH孵育细胞,PPa的浓度为(0.625, 1, 1.25, 2.5, 3.75, 5 μg/mL)时。细胞与不同浓度的孵化PSs 4 h和暴露于光线10分钟(通过670 nm过滤器氙灯,10 mW/cm2)。照射后,细胞在pH = 7.4的DMEM中继续培养24小时。丢弃全部液体,将细胞置于含3-(4,5-二甲基噻唑-2-基)-2,5-二苯四唑溴化(MTT, C = 0.5 mg/mL)的培养基中孵育4 h,将150 μL二甲基亚砜(DMSO)加入到溶出的紫色甲砜中,用酶标仪在490 nm波长下检测吸光度(A)值。细胞存活率(%)按下式计算:
细胞存活率(%) = As/Ac × 100%
暗毒对照组与未辐照实验组相同。
2.8. Zr-MOF-PPa@PAH的细胞摄取
将HepG-2细胞接种于6孔细胞培养板(每孔1 × 105个细胞),孵育24小时。Zr-MOF-PPa@PAH在37℃下分别孵育15、30、60、75和180 min。弃去培养基,PBS洗3次,2.5%戊二醛固定10分钟。弃去戊二醛溶液,PBS洗3次。后用2 mg/mL DAPI对HepG-2细胞进行10分钟染色。最后用PBS冲洗三次以去除DAPI染料后,盖上玻璃,放在载玻片上,使用倒置显微镜进行荧光成像。
2.9. Zr-MOF-PPa@PAH在细胞内活性氧(1O2)观察
DCFH-DA为单线态氧1O2探针,在488 nm激发下发出绿色荧光。用1 mL含Zr-MOF-PPa@PAH的DMEM,PPa浓度为2.5 μg/mL处理六孔板上的粘附HePG-2细胞(细胞密度为1 × 105),孵育2 h。PBS洗2次,50 μM DCFH-DA孵育30 min。PBS洗3次,然后用670 nm激光,功率密度为10 mW/cm2的光照射0、2、3、6、10 min。曝光后用PBS洗3次,立即用FIM观察。
2.10. 活死细胞双染色实验
将HepG-2细胞接种于6孔细胞培养板(每孔1 × 105个细胞),孵育24小时。用1 mL含PPa、Zr-MOF-PPa@PAH的DMEM,PPa浓度为2.5 μg/mL处理六孔板上的粘附HePG-2细胞(细胞密度为1 × 105),不同的材料经过3个小时的吞噬作用,细胞与PBS冲洗三次,然后1 mL PBS,用670 nm光照射0、2、5、10 min,加入AM (2 mmol/L)和PI (4 mmol/L)孵育15分钟。孵育15分钟后进行FIM分析。
3. 结果与讨论
3.1. Zr-MOF-PPa@PAH的表征
用SEM和TEM拍摄了Zr-MOF-PPa@PAH的形态(如图1(a))。Zr-MOF-PPa@PAH的表面光滑,纳米的平均粒径为68 nm,动态光散射(DLS)表明Zr-MOF-PPa@PAH在去离子水中的粒径为98 nm (如图1(b))。如图1(c)可知,Zr-MOF、Zr-MOF-PPa、Zr-MOF-PPa@PAH的Zeta电位分别为−22.1 ± 1.12 eV、−13.12 ± 1.5 eV、20.7 ± 1.08,由于PAH为盐酸盐,带有大量正电荷,产生电位反转。在7天内Zr-MOF-PPa@PAH在含有血清的培养基和PBS中尺寸没有显著的变化(如图1(d))。
 (a)
(a) 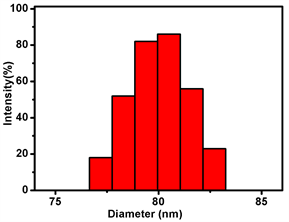 (b)
(b) 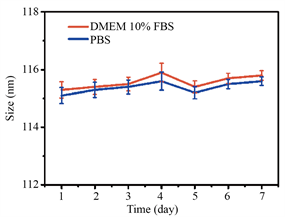 (c)
(c) 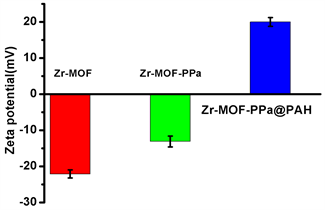 (d)
(d)
Figure 1. (a) SEM image of Zr-MOF-PPa@PAH. Inset is the TEM image; (b) DLS of Zr-MOF-PPa@PAH; (c) Zeta of Zr-MOF, Zr-MOF-PPa, Zr-MOF-PPa@PAH; (d) The hydrodynamic value of Zr-MOF-PPa@PAH was cultured in PBS or DMEM (containing 10% FBS) for 7 days
图1. (a) Zr-MOF-PPa@PAH的SEM图像。插图是TEM图像;(b) Zr-MOF-PPa@PAH的DLS;(c) Zr-MOF、Zr-MOF-PPa、Zr-MOF-PPa@PAH Zeta电位图;(d) Zr-MOF-PPa@PAH的水动力大小在PBS或DMEM (含10%胎牛血清)中培养7天
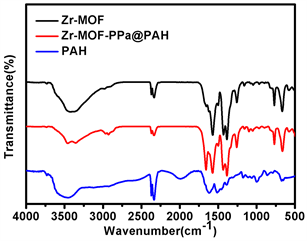
如图2(a)为傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FT-IR),Zr-MOF在3100~3550 cm−1有强振动峰,归属于羧基和氨基伸缩振动峰,双峰是伯氨基的N-H伸缩振动特征峰。1574 cm−1为苯环骨架上C=C双键的伸缩振动,1386 cm−1,1258 cm−1分别为C-O单键和C-N单键的伸缩振动,690~900 cm−1三个峰为1,2,4-三取代苯环的C-H面外弯曲振动,1528 cm−1峰为PAH的亚甲基C-H变形振动峰,1100 cm−1的峰为C-C单键骨架振动峰。这些特征峰在Zr-MOF-PPa@PAH的红外吸收曲线上中均有对应的峰,证明成功地得到Zr-MOF-PPa@PAH。如图2(b)为纳米材料的X-射线衍射(XRD),Zr-MOF在2θ = 7˚,8˚,12˚,26˚处特征峰均与文献报道的相符 [21],2θ = 7˚峰对应晶面(111),2θ = 8˚峰对应晶面(200)。尖锐的峰型表明Zr-MOF是高度结晶体。Zr-MOF-PPa@PAH的衍射峰均与Zr-MOF的衍射峰相同,说明表面PAH化晶体的结构没有发生变化,具有结构稳定性。图2(c)为Zr-MOF-PPa@PAH的X射线光电子能谱。由图可知,Zr-MOF-PPa@PAH中存在C、O、N、Zr元素。Zr-MOF、Zr-MOF-PPa@PAH、PPa的紫外吸收光谱如图2(d)所示,Zr-MOF在可见光及红外光区没有吸收,PPa在可见光区400~800 nm有5个吸收峰,其中400 nm附件有一个最强的吸收峰,在660 nm附近有次强峰,其余3个吸收峰在500~630 nm区域,这些峰是PPa (卟吩类化合物)的特征峰。Zr-MOF-PPa@PAH在400~800 nm也有5个吸收峰,在400 nm处有一个最强的吸收峰,在680 nm处有一个次强峰,说明PPa成功负载于Zr-MOF上,并且660 nm峰红移了10 nm,这可能是Zr-MOF材料的中心离子与PPa络合的结果。
 (a)
(a) 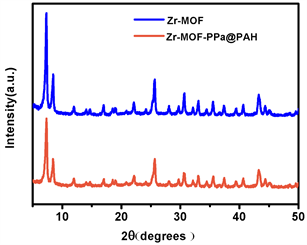 (b)
(b) 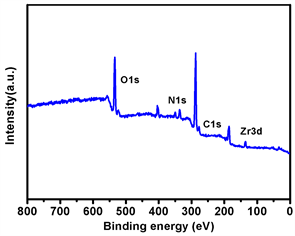 (c)
(c)  (d)
(d)
Figure 2. (a) FT-IR spectrum of Zr-MOF, Zr-MOF-PPa@PAH, PAH; (b) XRD diffraction spectra of Zr-MOF, Zr-MOF-PPa@PAH; (c) XPS spectra of Zr-MOF-PPa@PAH; (d) UV-vis spectrum of Zr-MOF, Zr-MOF-PPa@PAH, PPa
图2. (a) Zr-MOF、Zr-MOF-PPa@PAH、PAH的红外吸收光谱;(b) Zr-MOF、Zr-MOF-PPa@PAH的XRD衍射谱;(c) Zr-MOF -PPa@PAH的XPS能谱;(d) Zr-MOF、Zr-MOF -PPa@PAH、PPa的紫外–可见光吸收光谱
3.2. Zr-MOF-PPa@PAH的活性氧(1O2)量子产率
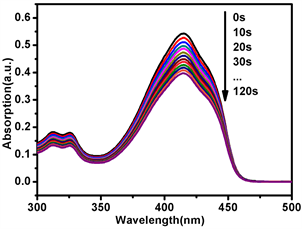
光敏剂PPa在660 nm的激光照射下产生活性氧(1O2)。我们以DPBF为活性氧(1O2)探针,亚甲基蓝(MB)为参照光敏剂,测量Zr-MOF-PPa@PAH的1O2量子产率。DPBF在415 nm处有很强的吸收,当DPBF被活性氧氧化降解吸收峰逐渐减弱直至消失。将DPBF和与待测样品混合后光照,DPBF吸光度变化和降解速率与时间关系图如图3(a),图3(b)所示,DPBF降解显著,Zr-MOF-PPa@PAH的1O2量子产率为38.6%,单独 PPa的1O2量子产率58.4%,Zr-MOF-PPa@PAH的1O2量子产率低的原因可能是是纳米载体接受了部分PPa的能量,导致PPa与O2分子之间的能量转移效率降低。虽然量子产率低了,但是Zr-MOF载体抑制了PPa因疏水性导致的自聚荧光猝灭现象,从而有利于提高光动力治疗的效果。
 (a)
(a) 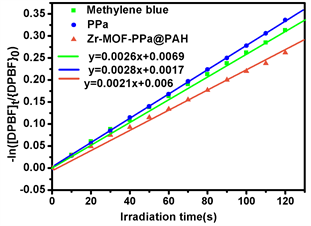 (b)
(b)
Figure 3. (a) UV-vis absorption spectra of decomposition of DPBF after irradiation of the Zr-MOF-PPa@PAH NPs in DMF; (b) First-order plots for the photodecomposition of PPa, Zr-MOF-PPa@PAH and MB
图3. (a) DPBF在Zr-MOF-PPa@PAH NPs的DMF溶液中光降解紫外–可见光光;(b) DPBF降解速率与光照时间关系曲线
3.3. Zr-MOF-PPa@PAH中PPa的pH响应释放
该纳米材料在化学上具有稳定性,可在人体中性生理环境中随血液到达病变部位,并可在肿瘤微环境中轻易释放,避免对正常细胞的损伤。人体人的生理环境约为7.4,肿瘤组织的pH值为6.0~6.8,而在某些细胞器和核内体中,pH值可低至5.2。因此,我们在不同pH值(5.6, 6.5, 7.4)进行了释放实验。记录样品在0~12 h内释放PPa的量。如图4可以看出,pH值为5.6,PPa的释放率最高,6 h释放率为45.8%,
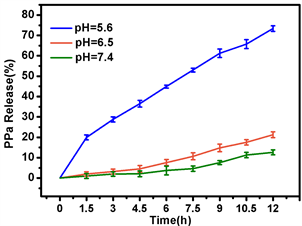
Figure 4. Zr-MOF-PPa@PAH is released in response to pH stimulation
图4. Zr-MOF-PPa@PAH pH刺激响应释放PPa
12释放率为76%,pH = 7.4时,PPa的释放率最低,综上所述,Zr-MOF-PPa@PAH在酸性肿瘤微环境下能有效释放PPa,而在正常人体生理环境下释放较少。因此,该Zr-MOF-PPa@PAH纳米粒子在正常生理环境下正常,使能更好的在肿瘤部位聚集,提高光动力疗效。
3.4. Zr-MOF-PPa@PAH的细胞摄取及细胞内活性氧检测
在癌症治疗过程中纳米药物能否进入细胞内尤为重要。我们研究了HepG-2细胞对Zr-MOF-PPa@PAH纳米颗粒的吞噬行为。DAPI为核染色剂,在荧光倒置显微镜下显蓝色。Zr-MOF-PPa@PAH纳米颗粒在荧光显微镜下显红色。用Zr-MOF-PPa@PAH处理HepG-2细胞,在CO2培养箱孵育之后,用荧光倒置显微镜下观察细胞的内化行为,结果如图5(a)所示。药物处理后15 min时,细胞内有微弱的红色荧光出现,表明Zr-MOF-PPa@PAH进入细胞内,随着时间的延长,细胞内红色荧光越来越强,说明Zr-MOF-PPa@PAH完全进入细胞,而在整个过程,细胞状态没有发生变化,说明Zr-MOF-PPa@PAH无暗毒性。清晰的活细胞红色荧光图像表明Zr-MOF-PPa@PAH能够成为细胞的荧光成像剂。
在前面已经讨论过关于1O2量子产率的问题(图3),但是细胞内生理环境复杂,有多种因素影响1O2的产率。因此,我们用2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)作为ROS的检测器,测试了Zr-MOF-PPa@PAH在细胞内产生1O2的能力 [22]。DCFH-DA可被细胞吸收,细胞内酯酶水解为DCFH,再被ROS氧化为7-二氯荧光素(DCF),在488 nm的光激发下产生绿色荧光 [23]。用Zr-MOF-PPa@PAH处理的实验组加入DCFH-DA (50 μM),并用660 nm激光(功率10 mW/cm2)照射10分钟(图5(b))。在荧光倒置显微镜下观察到,10分钟后发出绿色荧光非常强,说明纳米粒子几乎都进入细胞,在660 nm光照射下进入细胞后会产生大量1O2。说明Zr-MOF-PPa@PAH具有良好的产氧能力。
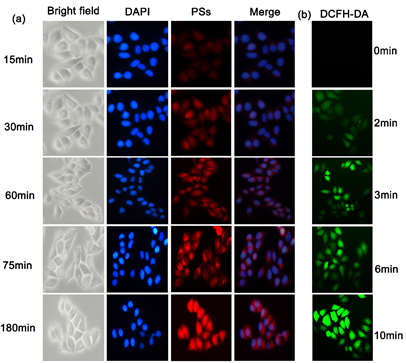
Figure 5. (a) Fluorescence imaging of HepG-2 cells after phagocytosis Zr-MOF-PPa@PAH; (b) DCFH-DA qualitative detection of reactive oxygen species in HepG-2 cells (1O2)
图5. (a) HepG-2细胞吞噬Zr-MOF-PPa@PAH后的荧光成像;(b) 用DCFH-DA定性检测HepG-2细胞内活性氧(1O2)
3.5. Zr-MOF-PPa@PAH的PDT疗效
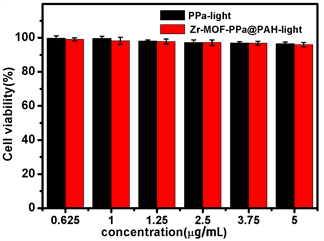
纳米材料作为药物传递系统,要求其在运输过程中对机体具有低毒性或无毒性,通过MTT法在HePG-2细胞中研究纳米粒子在无光和光照条件下的细胞毒性,采用MTT法评价MOF-PPa@MnO2-PAH纳米药物对HePG-2细胞的细胞毒性,用PPa与含有相同PPa浓度的Zr-MOF-PPa@PAH (0.625, 1, 1.25, 2.5, 3.75, 5 μg/mL)纳米粒子处理HePG-2细胞,验证该纳米粒子在光照与不光照下的细胞毒性。如图6(a)所示,在无光照射下,PPa与Zr-MOF-PPa@PAH纳米粒子处理后的HePG-2细胞的存活率将近100%,说明二者无暗毒性,很安全。如图5(b)所示,光照后,PPa比Zr-MOF-PPa@PAH纳米粒子处理过的HePG-2细胞存活率要高,这表明Zr-MOF-PPa@PAH具有良好的生物相容性,更好的进入细胞,解决单独PPa在生理环境下的自聚合,提高了光动力疗效。
HePG-2细胞双染可以清楚直观的反应上述两种物质的致死率(如图6(b)),在共聚焦激光扫描显微镜下,AM染色的活细胞为绿色,PI染色的死细胞为红色,由此可见,当用670 nm照射10 min后,PPa处理的细胞显示出荧光变化微弱,而用Zr-MOF-PPa@PAH处理过的细胞,绿色急剧减少,红色急剧增加,表明处理后的细胞受到了明显的破坏,这种结果与上述毒性结果一致,经过纳米材料负载的光敏剂可以提高光动力疗效。
 (a)
(a) 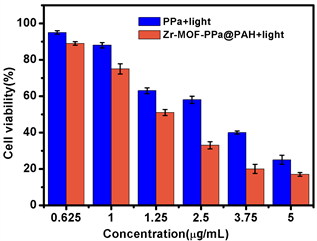 (b)
(b) 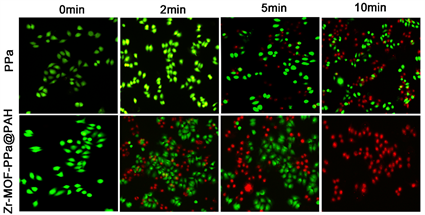 (c)
(c)
Figure 6. (a) Zr-MOF-PPa@PAH composite and free PPa with HepG-2 cells without irradiation; (b) In vitro PDT phototoxicity of Zr-MOF-PPa@PAH and free PPa to HepG-2 cells; (c) HepG-2 cell double staining assay cell imaging
图6. (a) PPa、Zr-MOF-PPa@PAH的无光照的柱状图;(b) PPa、Zr-MOF-PPa@PAH的光照下的柱状图;(c) HepG-2细胞双染色实验细胞成像
4. 结论
在本实验中,我们合成了Zr-MOF-PPa@PAH纳米粒子,Zr-MOF负载PPa解决了游离的PPa在生理环境下容易自聚集的缺陷,从而提高了PDT疗效。此外,细胞实验表明,Zr-MOF-PPa@PAH不明显的暗毒性和细胞内摄取行为进一步增加了其在临床实践中的应用潜力。简单的合成方法、良好的生物相容性和优异的PDT效率使Zr-MOF-PPa@PAH作为PDT肿瘤治疗的前景广阔。
NOTES
*通讯作者。