1. 引言
CuO和Cu2O作为p型半导体,禁带宽度较窄,分别为1.2 eV和2.17 eV,可见光吸收性能好,常被用于催化降解有机污染物 [1] [2] [3]。然而目前商用的CuO和Cu2O催化剂多为粉末 [4] [5],在循环使用过程中需要离心回收,过程繁琐,容易造成样品质量损失,而块状催化剂在循环使用过程中只需简单清洗便可重复使用。因此,Li [6] 等人以铜网为基底制备了块状的Cu/Cu2O/CuO材料,120 min降解了80%的RhB。Uthirakumar [7] 等人以铜盘为基底制备了Cu/Cu2O/CuO材料,120 min降解了93%的RhB,重复循环降解实验5次后,RhB降解率仍有89%。块状催化剂虽然容易回收,循环稳定性好,但是由于表面积较小,不能与有机污染物充分接触,因此降解能力较弱。
而半导体复合形成异质结的方法可以有效提高催化降解性能 [8] [9] [10] [11]。ZnO是一种直接带隙半导体材料,禁带宽度约为3.37 eV,价带顶与导带底同处于K空间的同一位置,电子跃迁可以直接进行,不需要晶格原子的参与,电子跃迁率较大,具有较高的电子迁移率,因此ZnO具有优良的光电性能,能够与铜氧化物结合形成异质结,有效抑制光生电子和空穴的复合,促进光生载流子的分离。目前常用的氧化锌制备工艺有水热/溶剂热反应法,溶胶–凝胶法,电化学沉积法以及模板法等。Men [12] 等人采用水热法,以还原氧化石墨烯为基底,制备了ZnO/rGO复合材料。Ba-Abbad [13] 等人采用溶胶–凝胶法制备了平均尺寸为20 nm的ZnO纳米颗粒。Anand [14] 等人采用电化学沉积法制备了球形的ZnO纳米材料,平均大小为50~100 nm。相比之下,水热法具有设备简单、操作容易、成本低廉、反应过程可控且可在室温下进行等优点,是制备CuO/ZnO异质结构的理想方法。
本文以泡沫铜为基底,依次采用阳极氧化法和水热法制备了CuO/Cu2O/ZnO复合材料,对ZnO纳米棒的生成机理进行了探讨,研究了CuO/Cu2O/ZnO复合材料的晶体结构和化学组成,同时重点研究了不同水热时间对CuO/Cu2O/ZnO复合材料微观结构和可见光芬顿催化性能的影响,并分析了其催化降解机理。
2. 实验方法
2.1. 样品的的制备
CuO/Cu2O/ZnO复合材料的制备流程如图1所示,依次采用阳极氧化法和水热法制备CuO/Cu2O/ZnO复合材料。

Figure 1. Schematic illustration for fabricating CuO/Cu2O/ZnO composites
图1. CuO/Cu2O/ZnO复合材料的制备流程图
2.1.1. CuO/Cu2O纳米阵列材料的制备
采用阳极氧化法制备CuO/Cu2O纳米阵列材料,主要制备流程如下:将高纯泡沫铜(99.99%)裁剪成2 × 1 cm2大小,依次使用乙醇(分析纯)、去离子水清洗干净后,作为阳极使用,高纯钛片(99.99%)作为阴极,配制150 g/L NaCl (分析纯)、40 g/L NaOH (分析纯)和1 g/L聚乙二醇(PEG20000,分析纯)的水溶液作为电解液,直流稳压稳流电源提供恒定的电流进行阳极氧化反应,恒定的电流密度为10 mA/cm2,温度为65℃,经过60 min电化学反应后,得到阳极氧化产物,将该产物去离子水清洗干燥后,得到CuO/Cu2O纳米阵列材料。
2.1.2. CuO/Cu2O/ZnO复合材料的制备
采用水热法制备CuO/Cu2O/ZnO复合材料,主要流程如下:首先,将CuO/Cu2O纳米阵列薄膜材料浸泡在0.02 mol/L Zn(CH3COO)2乙醇溶液中20 s,在空气中自然风干,重复此步骤3~5次。将风干后的产物放于马弗炉中350℃空气气氛中退火30 min,待产物冷却至室温后,得到长有ZnO纳米晶粒的CuO/Cu2O纳米阵列材料。然后将其放入装有0.01 mol/L Zn(NO3)2·6H2O (分析纯)和0.01 mol/L C6H12N4 (分析纯)水溶液的聚四氟乙烯高压釜中,恒定95℃的水热温度下,反应2~6 h后,待反应釜冷却至室温后,将所得产物依次使用蒸馏水、乙醇反复洗涤,干燥后,得到所要制备的CuO/Cu2O/ZnO样品。将得到的CuO/Cu2O/ZnO样品按照反应时间依次标记为CuO/Cu2O/ZnO-2,CuO/Cu2O/ZnO-4,CuO/Cu2O/ZnO-6。
2.2. 可见光芬顿催化降解实验
可见光芬顿催化降解实验装置如图2所示,在可见光芬顿催化降解实验中,以RhB溶液作为目标降解物,通过测定室温下,RhB在中性条件下的降解速率,研究待测样品的催化性能。将大小2 × 1 cm2的样品放入盛有100 ml浓度为20 mg/L RhB溶液的方形石英杯中,再加入20 ml质量分数为30%的H2O2溶液,以500 r/min的转速进行磁力搅拌,使用装有截止波长420 nm滤波片功率250 W的氙灯光源进行光照实验,光源与溶液相距30 cm,辐射强度为50 mW·cm−2,每隔一定的时间,用紫外可见分光光度计测试RhB溶液(吸收光谱特征峰值为554 nm)的吸光度,以确定RhB的降解效率。
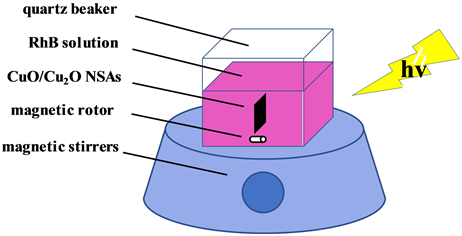
Figure 2. Schematic illustration of the setup for visible light Fenton catalytic degradation experiment
图2. 可见光芬顿催化降解实验装置示意图
根据Lambert-Beer定律,RhB溶液的浓度和吸光度之间存在如下关系:
(1)
式中Ct:时间t时,RhB溶液的浓度;
C0:初始时,RhB溶液的浓度;
At:时间t时,RhB溶液的吸光度;
A0:初始时,RhB溶液的吸光度。
光催化降解的动力学过程可以用降解速率来表示,而RhB的光催化降解属于Langmuir-Hinshelwood (L-H)一级动力学模型,降解常数k可通过如下公式计算得到:
(2)
式中k:动力学常数;
Ct:时间t时,RhB溶液的浓度;
C0:初始时,RhB溶液的浓度;
t:光催化降解的时间。
3. 结果与讨论
3.1. CuO/Cu2O/ZnO复合材料的表征与分析
图3为CuO/Cu2O-60纳米阵列材料在不同水热时间下获得的CuO/Cu2O/ZnO复合材料的XRD衍射图谱。作为对比,将CuO/Cu2O-60纳米材料的XRD图谱也列于图中,结果显示,在所有样品中,43.1˚、50.4˚和74.1˚均观察到相应的衍射峰,分别对应立方晶系铜的(111)、(200)和(220)晶面(PDF# 04-0836),并且在35.5˚和38.7˚观察到了与CuO/Cu2O-60纳米材料基底相同的两个衍射强度相对较低的衍射峰,分别对应于CuO单斜晶体的(002)和(111)晶面(PDF#45-0937)。水热2 h后,产物除了基底CuO/Cu2O-60的衍射峰外,在29.6˚、42.3˚和73.5˚观察到了新的衍射峰,分别对应于Cu2O晶体(110)、(200)和(311)晶面(PDF#05-0667) [15],并且Cu2O晶面的衍射峰显著增强,表明高温、高压环境下过程中有新的Cu2O生成,在61.5˚观察到衍射峰,对应于CuO单斜晶体的(−113)晶面(PDF#45-0937),在36.3˚、66.4˚和68˚观察到了三个衍射峰,分别对应于ZnO晶体的(101)、(200)和(112)晶面(PDF#36-1451),表明水热反应有大量的ZnO生成 [12]。水热4 h后,CuO、Cu2O和ZnO的衍射峰强度同时增加,表明铜氧化物和氧化锌在不断生长。水热6 h后,CuO、Cu2O和ZnO的衍射峰强度基本和反应60 min时一致,表明铜氧化物和氧化锌不再生长。
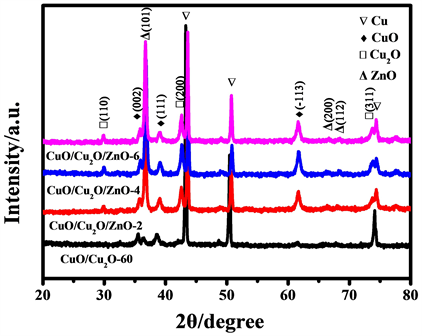
Figure 3. XRD patterns of the CuO/Cu2O/ZnO composites prepared with different hydrothermal times
图3. 不同水热时间制备的CuO/Cu2O/ZnO复合材料的XRD图谱
为了分析样品中存在的元素及其价态,我们对CuO/Cu2O/ZnO样品进行了XPS分析,图4所示为水热4 h制备的CuO/Cu2O/ZnO复合材料样品的XPS能谱分析结果,所有数据均以C 1s峰的284.6 eV为参考进行校准。图4a所示是CuO/Cu2O/ZnO复合材料的全谱,表明样品中存在Cu、Zn、O和C元素 [16]。如图4b所示,932.5 eV和933.9 eV的峰对应Cu 2p3/2的特征峰,分别对应Cu2O和CuO,953.6 eV的峰对应Cu 2p1/2的特征峰,并且图中另有两个伴随峰对应相应的主峰 [15]。如图4c所示,Zn 2P能谱由1022.3 eV和1045.2 eV的两个峰组成,对应Zn 2p3/2和Zn 2p1/2,表明Zn以Zn2+的形式存在 [17]。图4d中O 1s能谱可以分为529.7 eV和531 eV两个特征峰,529.7 eV特征峰对应CuO,531 eV特征峰对应Cu2O和ZnO。
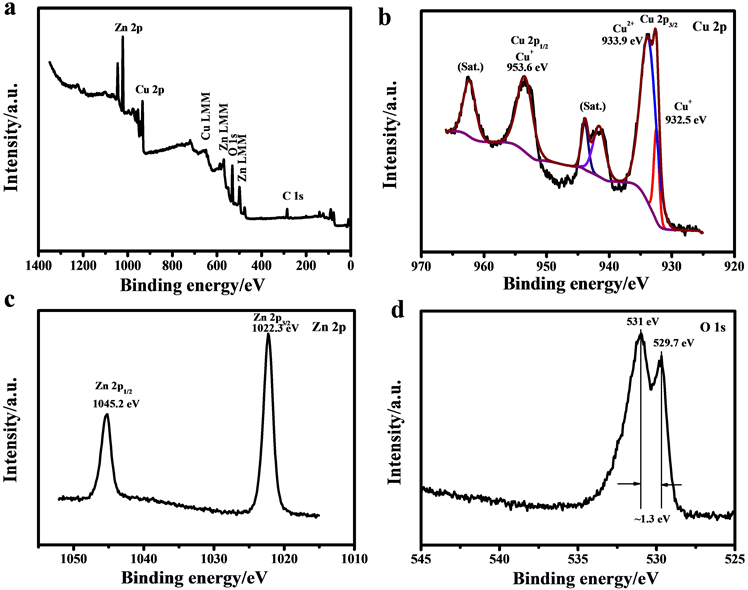
Figure 4. XPS patterns of the CuO/Cu2O/ZnO-4 samples: (a) survey pattern; (b) Cu 2P; (c) Zn 2P; (d) O 1s
图4. CuO/Cu2O/ZnO-4样品的XPS能谱:(a) 全谱图;(b) Cu 2P;(c) Zn 2P;(d) O 1s
为了研究不同水热时间对ZnO纳米棒生长的影响,探讨纳米棒生长的机理,我们对样品进行了SEM观测与分析。如图5a所示,泡沫铜表面垂直生长了密集均匀的CuO/Cu2O纳米片。图5b表明,水热反应2 h后,CuO/Cu2O纳米片上零散、均匀生长了细小的ZnO纳米棒。如图5c所示,水热反应4 h后,CuO/Cu2O纳米片表面生长的ZnO纳米棒变长,并且分布更密集,使得CuO/Cu2O纳米片整体呈现密集的树枝状。图5d中是水热反应6 h后的CuO/Cu2O/ZnO纳米复合材料,CuO/Cu2O纳米片表面ZnO纳米棒继续生长,密集的ZnO纳米棒几乎包裹了CuO/Cu2O纳米片,并且观察到CuO/Cu2O纳米片有一定的断裂痕迹。
图6为CuO/Cu2O/ZnO复合材料纳米阵列生长机理示意图,以CuO/Cu2O纳米材料为基底,首先,Zn(CH3COO)2受热分解生成ZnO,在CuO/Cu2O纳米片表面生成ZnO种子,遵循以下反应式(3),随后,Zn2+在碱性环境中生成Zn(OH)2,OH−过多生成[Zn(OH)4]2−络合物,最终[Zn(OH)4]2−络合物在高温高压下分解生成ZnO纳米材料,如以下反应式(2)所示。因此使用水热法,可在CuO/Cu2O纳米片表面生成粒径小,分布均匀的ZnO纳米棒。
(3)
(4)

Figure 5. SEM images of the CuO/Cu2O/ZnO composites prepared with different hydrothermal time: (a) CuO/Cu2O-60; (b) CuO/Cu2O/ZnO-2; (c) CuO/Cu2O/ZnO-4; (d) CuO/Cu2O/ZnO-6
图5. 不同水热时间下制备的CuO/Cu2O/ZnO复合材料样品的SEM照片:(a) CuO/Cu2O-60;(b) CuO/Cu2O/ZnO-2;(c) CuO/Cu2O/ZnO-4;(d) CuO/Cu2O/ZnO-6
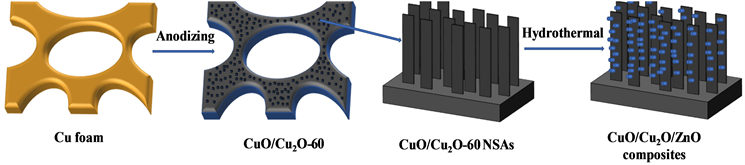
Figure 6. Schematic illustration for fabricating CuO/Cu2O/ZnO composite
图6. CuO/Cu2O/ZnO复合材料生长机理示意图
为了研究CuO/Cu2O/ZnO复合材料样品的光吸收性能,我们对样品进行了紫外可见分光光度计分析。图7为基底CuO/Cu2O-60纳米阵列材料和不同水热时间制备的CuO/Cu2O/ZnO复合材料的紫外可见分光谱图。由图可知,CuO/Cu2O/ZnO复合材料和CuO/Cu2O-60纳米阵列材料的紫外可见分光谱图整体规律相同,350 nm左右光吸收性能均有所下降,表明水热生成ZnO前后,CuO/Cu2O-60纳米阵列材料基本框架不变。而随着ZnO的生成,CuO/Cu2O/ZnO复合材料的可见光吸收性能相比于基底CuO/Cu2O-60纳米阵列材料均有大幅提高,其中CuO/Cu2O/ZnO-2和CuO/Cu2O/ZnO-4在400~800 nm的可见光吸收范围内,对可见光的吸收能力相近。
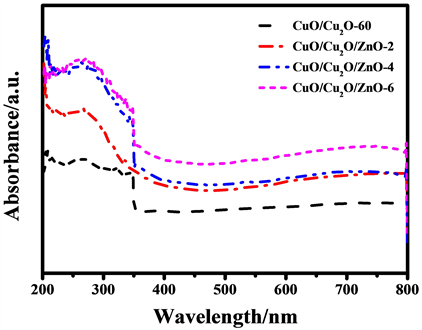
Figure 7. UV-vis absorption spectra of CuO/Cu2O-60 and CuO/Cu2O/ZnO composites after different hydrothermal times
图7. CuO/Cu2O-60和不同水热时间制备的CuO/Cu2O/ZnO复合材料的紫外可见分光谱图
3.2. CuO/Cu2O/ZnO复合材料的可见光芬顿催化降解性能
为了进一步研究不同水热时间制备的CuO/Cu2O/ZnO复合材料可见光芬顿催化降解RhB溶液的性能,我们测试了中性环境下样品添加H2O2的条件下,可见光下对100 ml 20 mg/L RhB的催化降解性能。图8a为CuO/Cu2O-60纳米阵列材料和不同水热时间制备的CuO/Cu2O/ZnO复合材料在可见光下,芬顿催化降解的降解曲线。无光照情况下,CuO/Cu2O/ZnO复合材料在H2O2存在的条件下,芬顿降解RhB溶液30 min,未发现RhB溶液浓度曲线明显下降,表明光照条件不可或缺。由图8a中可以得出,ZnO纳米棒修饰CuO/Cu2O-60纳米阵列,可以增强其可见光催化性能,CuO/Cu2O-60纳米阵列材料30 min降解约96%的RhB,水热反应2 h制备的CuO/Cu2O/ZnO-2复合材料25 min即可降解约95%的RhB,4 h制备的CuO/Cu2O/ZnO-4复合材料25 min降解约98%的RhB,反应30 min后,有机污染物RhB几乎完全降解。CuO/Cu2O/ZnO-2和CuO/Cu2O/ZnO-4材料的降解性能相近有可能是因其可见光吸收性能相近导致的。然而水热6 h生成的CuO/Cu2O/ZnO-6材料可见光芬顿催化降解性能明显下降,30 min仅降解了70%的RhB,这可能是因为,虽然从紫外–可见光谱图可以看出,CuO/Cu2O/ZnO-6的可见光吸收性能是最强的,但是其SEM形貌表明,大量的ZnO纳米棒堆满CuO/Cu2O纳米片,并伴随部分CuO/Cu2O纳米片的断裂,阻碍了CuO/Cu2O芬顿反应的进行,影响了其可见光芬顿催化性能。
为了对比分析不同样品的降解速率,我们对样品进行了光催化动力学分析。图8b为CuO/Cu2O纳米阵列材料和不同水热时间制备的CuO/Cu2O/ZnO复合材料可见光下的芬顿催化降解RhB溶液的可见光光催化动力学曲线,结果表明对于不同的样品,ln(C/C0)和t均呈线性关系,计算得到CuO/Cu2O、CuO/Cu2O/ZnO-2、CuO/Cu2O/ZnO-4、CuO/Cu2O/ZnO-6的一级反应动力学常数k1、k2、k3、k4分别为0.12 min−1、0.15 min−1、0.18 min−1、0.04 min−1。CuO/Cu2O/ZnO-4复合材料的动力学常数最大,是CuO/Cu2O材料的1.5倍,与图8a相印证。适当ZnO纳米棒修饰CuO/Cu2O纳米片催化性能提升的原因可能是:1) CuO/Cu2O/ZnO复合材料相较于CuO/Cu2O纳米阵列材料可见光吸收性能有所提高,增强了可见光和芬顿体系的协同作用,提升了芬顿催化性能;2) CuO/Cu2O/ZnO复合材料是CuO/Cu2O和ZnO形成的异质结材料,能够有效的抑制光生电子和空穴的复合效率,提升电子迁移率,提高可见光芬顿催化性能。

Figure 8. (a) Photocatalytic degradation rates of RhB under visible light irradiation for CuO/Cu2O/ZnO composites; (b) Kinetic constants of the photocatalytic degradation of RhB for CuO/Cu2O/ZnO composites
图8. (a) CuO/Cu2O/ZnO复合材料可见光下降解RhB溶液效率;(b) CuO/Cu2O/ZnO复合材料降解RhB 溶液动力学分析

Figure 9. (a) Recyclability testing curve of the CuO/Cu2O/ZnO composites for RhB degradation when reused for 5 times; (b) The surface morphology of the CuO/Cu2O/ZnO composites after recyclability test for 5 times
图9. (a) CuO/Cu2O/ZnO复合材料重复循环5次可见光芬顿降解RhB溶液性能;(b) CuO/Cu2O/ZnO复合材料重复循环实验5次后的SEM形貌
为了进一步评价CuO/Cu2O/ZnO复合材料的可循环性能和稳定性,我们对CuO/Cu2O/ZnO-4复合材料进行了5次重复循环降解100 ml 20 mg/L RhB的实验。如图9a所示,CuO/Cu2O/ZnO-4经过5次循环实验后,可见光下,30 min降解了93%的RhB,降解性能略有所下降,催化降解性能下降的原因可能是随着循环次数的增加,ZnO纳米棒从CuO/Cu2O纳米片表面脱落。图9b表明CuO/Cu2O纳米片整体形貌和结构保持不变,表面ZnO纳米棒脱落。这些结果表明CuO/Cu2O/ZnO复合材料催化剂具有良好的循环性能和稳定性。
综上所述,与CuO/Cu2O-60纳米阵列材料光照30 min降解96%的RhB溶液相比,CuO/Cu2O/ZnO复合材料单次降解RhB性能更好,25 min即可降解约95%的RhB,表明CuO/Cu2O/ZnO复合材料催化剂具有更好的可见光芬顿催化降解性能。
3.3. CuO/Cu2O/ZnO复合材料的可见光芬顿催化降解机理分析
基于以上分析,CuO/Cu2O/ZnO复合材料可见光芬顿催化降解有机污染物的机理示意图如图10所示,由于ZnO的费米能级高于CuO/Cu2O,因此CuO/Cu2O和ZnO形成的异质结时,电子会从ZnO一侧迁移至CuO/Cu2O一侧,当费米能级平衡时,形成了一个从ZnO指向CuO/Cu2O的内建电场。当光照能量足够强时,ZnO和CuO/Cu2O会产生光生电子和空穴,而在该内建电场的作用下,光生电子会从CuO/Cu2O的导带自发的迁移至ZnO的导带,而光生空穴则会从ZnO的价带迁移至CuO/Cu2O的价带,从而使光生电子和空穴得到了有效地分离,增加了有效光生电荷的数量,从而提高了光生电子分别与H2O和H2O2反应生成超氧自由基和羟基自由基的数量,进而导致了CuO/Cu2O/ZnO复合材料可见光芬顿催化降解性能的提高 [18]。
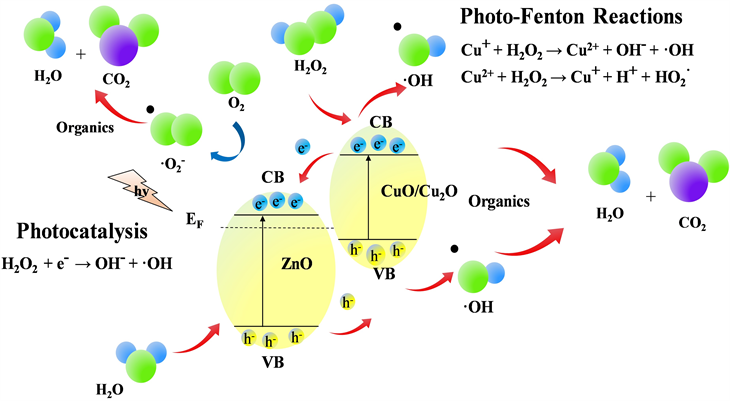
Figure 10. Schematic illustration of the possible mechanism for the RhB visible light Fenton catalytic degeneration by the CuO/Cu2O/ZnO composites
图10. CuO/Cu2O/ZnO复合材料可见光芬顿催化降解RhB机理
4. 结论
采用水热法,以CuO/Cu2O-60纳米阵列材料为基底,成功制备了CuO/Cu2O/ZnO复合材料,通过调整反应时间,调节ZnO纳米棒的负载量。XRD分析和XPS图谱表明成功在CuO/Cu2O-60纳米阵列材料基底上生成了氧化锌物相,SEM图像分析表明生长的ZnO纳米棒密集的分布在CuO/Cu2O-60纳米片上,并且紫外可见光谱图显示CuO/Cu2O/ZnO复合材料可见光响应性能优于CuO/Cu2O-60纳米阵列材料。
可见光芬顿催化降解测试表明,CuO/Cu2O/ZnO-4复合材料具有最好的催化降解性能,在可见光下降解RhB溶液,25 min降解了98%的RhB,动力学常数为0.18 min−1,是CuO/Cu2O-60材料的1.5倍,重复循环5次催化降解试验后,30 min对RhB溶液的降解率为93%。表明CuO/Cu2O/ZnO纳米材料可见光芬顿催化剂具有良好的催化性能和循环稳定性。半导体氧化物ZnO与基底CuO/Cu2O-60纳米阵列材料的复合,形成了异质结,提高了可见光吸收性能,增加了光生电子与空穴的分离与传输,有效提高了可见光芬顿催化性能。
基金项目
本项目得到国家自然科学基金(52072107)和中央高校基本科研业务费专项资金(JZ2019HGBZ0142)的支持。