1. 引言
鸡肉肉质细嫩,营养丰富,是人们日常生活中除猪肉外食用最多的肉类,且其消费比例呈现逐年上升趋势。但生鲜鸡肉较易腐败变质,储存时间较短 [1]。一般情况下生鲜鸡肉4℃条件下保存期限不超过四天。腐败的鸡肉如果误食会对人体健康造成危害,若废弃则会造成食物的浪费,因此探究鸡肉高效的保鲜方法,用以延长其保鲜期具有重要意义。当前国内外对生鲜鸡肉保鲜的研究主要有低温储存保鲜、化学保鲜剂保鲜以及生物保鲜等保鲜方式 [2]。其中使用天然安全的保鲜剂对生鲜鸡肉进行保鲜是目前研究的热门方法之一。在国家标准GB2760-2014“食品添加剂使用标准”中明确指出可以添加到肉类食品中的防腐剂包括乳酸、茶多酚、蔗糖脂肪酸酯、柠檬酸等 [3]。
谷胱甘肽(GSH)是一种常见的三肽,由谷氨酸(Glu)、半胱氨酸(Cys)及甘氨酸(Gly)组成,在人体的多个组织和器官中均存在,主要作用是维持各类细胞的生理功能,清除自由基,且有一定的抗氧化作用,可用于多类食品的保鲜。若以谷胱甘肽作为肉类的保鲜剂,还能强化肉类的风味,查阅相关资料发现,谷胱甘肽此前在国内的研究中主要用于生物医药行业和化妆品行业,在保鲜剂应用方面的研究较少,仅查阅到其在荔枝保鲜 [4] 和刀额新 [5] 对虾保鲜方面的研究,且根据他人研究的发现,谷胱甘肽确实能够延长荔枝和虾的保鲜期。因此本实验选择使用谷胱甘肽作为鸡肉的防腐剂之一来进行探究。
柠檬酸是一种无臭的结晶性粉末,在水中有较大溶解度,具有较强的酸性。柠檬酸的酸味滋美,可以增加食品的风味,还能够释放出氢离子,降低食品pH值,柠檬酸还具有螯合作用,是食品的抗氧化剂可以用于食品的保鲜 [6]。
山梨醇又叫山梨糖醇,是一种无臭,易溶于水,微溶于乙醇等有机溶剂的白色结晶性粉末。山梨醇味甜而清凉,其甜度约是蔗糖甜度的二分之一,热值与蔗糖热值相近。山梨醇可以螯合金属离子,改善组织,因此可用作食品防腐剂。此外,山梨醇可使食品保持一定量的水分,以此来提高食物保水性。
对鸡肉的营养成分进行研究分析表明,其含有维生素C和维生素E等,且含有多种类型的蛋白质,蛋白质含量也较高,人体消化系统能够很好地对鸡肉进行消化,其中的蛋白质、维生素等也易被人体吸收利用。此外鸡肉能为人体提供磷脂类物质,可以在很大程度上促进人体内各个组织器官的生长发育。中医学也认为鸡肉能够温中补脾,益气养血,因此鸡肉具有很好的食疗作用。
本实验参考谷胱甘肽复配型保鲜剂对刀额新对虾保鲜效果的探究,通过L9(34)正交试验设计,将还原型谷胱甘肽、柠檬酸和山梨醇三种保鲜剂按照一定浓度进行复配,比较各组处理中鸡肉的菌落总数、离心汁液流失率、pH值 [7]。以期得到还原型谷胱甘肽、柠檬酸、山梨醇三种复配型保鲜剂对鸡肉保鲜的最佳组合,为保证鸡肉的质量提供技术支持。
2. 实验材料、试剂与仪器
2.1. 实验材料和试剂
鸡胸肉:购于新乡市红旗区世纪华联超市易购店。
葡萄糖,柠檬酸,酵母浸膏、蛋白胨,琼脂粉,磷酸氢二钠,磷酸二氢钾,山梨醇,谷胱甘肽(还原型)等。
2.2. 实验仪器
分析天平,型恒温培养箱,4℃冰箱,pH计,双人单面净化工作台,立式高压蒸汽灭菌锅,培养皿,三角瓶,量筒、移液枪等。
3. 试验方法
3.1. 鸡肉的处理
购买新鲜鸡肉,切成小块,每100 g一份,共10份,用无菌水清洗干净,沥干表面水分后放入干净的一次性纸杯中,并用封口膜密封,置于4℃冰箱中 [8]。将谷胱甘肽、柠檬酸、山梨醇三种保鲜剂按一定比例复配,通过L9(34)正交试验优化出由三者组成的复配型保鲜剂的最佳组合,每个组合三个重复,并做三个空白对照。具体见表1。

Table 1. Orthogonal experimental design of content ratio of compound preservative
表1. 复配保鲜剂含量配比正交实验设计
配置A到I组复配型保鲜剂,并将鸡肉分别在A到I组保鲜剂溶液中浸泡20 min后取出并沥干表面水分,用封口膜密封,置于4℃冰箱中。同时对于对照组J组的鸡肉,用无菌水浸泡20 min后取出沥干表面水分,封口后置于4℃冰箱中保存备用。然后在0 d、2 d、4 d、6 d、8 d分别对各组鸡肉进行取样,测定各组处理的菌落总数、pH值、离心汁液流失率三项指标。
3.2. 菌落总数的测定
3.2.1. 培养基配制
实验中选用平板计数琼脂培养基(PCA),其成分为:酵母浸膏2.5 g/l,葡萄糖1.0 g/l,蛋白胨5.0 g/l,琼脂粉15.0 g/l,将以上四种成分按照规定浓度称取相应量添加到蒸馏水中,煮沸使其溶解,再用NaOH溶液或HCl溶液调节培养基pH 至7.0 ± 0.2。将配置好的培养基进行分装,并将分装好的培养基放入高压蒸汽灭菌锅中,温度设定121℃,灭菌15 min [9]。
3.2.2. 生理盐水的配制
鸟类的生理盐水浓度不同于哺乳动物,为浓度0.75%的氯化钠溶液。因此鸡肉的生理盐水浓度也为0.75%,即7.5 g/l。配置1000 mL 7.5 g/l的NaCl溶液,于高压蒸汽灭菌锅中进行灭菌,温度设定121℃,时间设定15 min。
3.2.3. 实验操作步骤
每组称取三份鸡肉,每份1 g,将其绞碎,分别放入三个盛有9 mL生理盐水的试管中,振荡试管,使绞碎后的鸡肉与0.75%的生理盐水充分混合,配置成浓度为1:10的样品匀液。用移液枪将1 mL 1:10样品匀液加入盛有9 mL 0.75%生理盐水的试管中,充分震荡试管,使1:10的样品匀液与9 mL生理盐水混合均匀,制备成1:100的样品匀液。再依照此法制备出1:1000的样品匀液。
用移液枪吸取1:10的样品匀液1 mL,吸取两次,分别加入两个灭菌培养皿内,对配置好的PCA培养基进行加热融化,待其温度降至46℃左右时,向培养皿内加入15~20 mL培养基,缓慢转动培养皿,使样品匀液和培养基混合均匀。再依照此法继续接种1:100和1:1000两个稀释度的样品匀液。将倒好的平板放置冷却,等待其凝固后,将培养皿倒置放于恒温培养箱中,设定培养箱温度为36℃,培养时间为48 h ± 2 h。可直接用肉眼对各平板的菌落数量进行计数,必要时借助放大镜观察菌落数量。
3.2.4. 结果计算
用于进行菌落计数的平板要求无蔓延菌落,且菌落数在30~300 CFU之间。若所有平板菌落数都大于300 CFU,则只计数最高稀释度平板菌落数。若所有平板菌落数都小于30 CFU,则只对最低稀释度平板进行计数。
若只有一个稀释度的平板上的菌落数符合30~300 CFU的要求,则计算该稀释度平板菌落数的平均值,再乘上相应的稀释度,即为该组每g鸡肉所含有的菌落总数。
若连续两个稀释度的平板菌落数都在30~300 CFU范围内,则按下式进行计算 [10]:
式中:N为某组鸡肉的菌落总数;C为参与菌落计数的平板数之和;
和
分别为两个稀释度中参与计数的平板个数;d为稀释因子,即第一稀释度。
要求最终以CFU/g为单位报告各组鸡肉的菌落总数。
3.3. 汁液流失率
用电子天平称取2 g左右的鸡肉,记录鸡肉重量为m1,然后置于离心机中,4500 r/min离心10 min。离心结束后从离心管中取出鸡肉,并用吸水纸吸干鸡肉表面的水分,称重m2。鸡肉的离心汁液损失率按下式计算 [11]:
3.4. pH值测定
3.4.1. 标准缓冲溶液的配制
将恒温干燥箱的温度设定为110℃,称取适量磷酸二氢钾、磷酸氢二钠,并将其放入干燥箱内进行干燥,至二者恒重。用电子天平称量出3.402 g干燥后的磷酸二氢钾,称量干燥后的磷酸氢二钠3.549 g (对两者进行称取时均需精准至0.001 g)。将两者一起溶于蒸馏水中,转移至1 L容量瓶并洗涤烧杯,然后定容至1 L。此缓冲溶液的pH值在室温(20℃)时即为6.88 [12]。其他温度时该标准溶液pH值分别为:0℃时pH值6.98。10℃时pH值6.92,30℃时pH值6.85。
用电子天平称取7.010 g一水柠檬酸(精确到0.001 g),然后将其溶于500 mL蒸馏水中,再量取1 mol/L的氢氧化钠溶液375 mL,加入到柠檬酸溶液中,最后用蒸馏水将该溶液定容至1 L。此溶液pH在10℃时为5.42,在20℃时为5.45,在30℃时为5.48 [12]。
3.4.2. pH测定步骤
本次实验所用pH计为PHS-3C型,设有“定位、温度补偿、斜率”按钮,此类pH计需要两点标定,即要使用两种标准缓冲液对其进行校准。在使用该型号的pH计时,选择先用上述pH值为6.88的标准缓冲溶液对其进行“定位”校正,然后选用上述pH值为5.45的标准缓冲溶液进行“斜率”校正。
4. 实验数据处理与分析
4.1. 复配型保鲜剂对菌落总数的影响
参考对鸡肉新鲜度划分的相关标准,以菌落总数的多少为依据对鸡肉的新鲜等级进行划分,当菌落总数小于1 × 104 CFU/g时鸡肉为新鲜肉。当鸡肉菌落总数大于1 × 104 CFU/g,小于1 × 106 CFU/g时鸡肉为次新鲜肉。当鸡肉菌落总数大于1 × 106 CFU/g时为变质肉。即对鸡肉菌落总数取l g值后,若其小于4,为新鲜肉。若其大于4小于6则为次新鲜肉,若其大于6则为变质肉。
从表2和表3可知,在0 d时,各组鸡肉的菌落总数均小于1 × 104。其中H组鸡肉的菌落总数最少,为5.90 × 102 CFU/g,C组菌落总数最多,为2.32 × 103 CFU/g。随着鸡肉冷藏天数的增加,实验组及对照组的菌落总数均逐渐上涨。其中J组(对照)菌落总数增长最多,8 d后达到了3.83 × 108 CFU/g。与空白对照组相比,实验组H组鸡肉的菌落总数增长最为缓慢,在8 d后,H组鸡肉的菌落总数为9.89 × 105 CFU/g;E组增长最快,在8 d后达到了8.71 × 107 CFU/g。即在抑制鸡肉菌落总数增长方面,H组复配型保鲜剂的效果最好,E组复配型保鲜剂的效果最差。

Table 2. Changes in total number of colonies in groups A to E (unit: CFU/g)
表2. A~E组菌落总数变化表(单位:CFU/g)

Table 3. Change of total colony number in groups F to J (unit: CFU/g)
表3. F~J组菌落总数变化情况(单位:CFU/g)
4.2. 复配型保鲜剂对离心汁液流失率的影响
从表4和图1可知:随着鸡肉冷藏时间的延长,各组鸡肉的离心汁液流失率均逐渐上升。计算各组离心汁液流失率的平均值后发现,空白对照组的均值最大。而在九个实验组中H组的离心汁液流失率最小,I组的离心汁液流失率最大。由此可以看出,H组保鲜剂对保持鸡肉水分方面最好,I组保鲜剂在保持鸡肉水分方面效果较差。但各组复配型保鲜剂均能在不同程度上减少鸡肉汁液的流失,分析原因可能是因为保鲜剂中加入了山梨醇,山梨醇可以在一定程度上保持鸡肉的水分,从而减少汁液流失率。

Table 4. Change of centrifugal juice loss rate in groups A~J
表4. A~J组离心汁液流失率变化情况
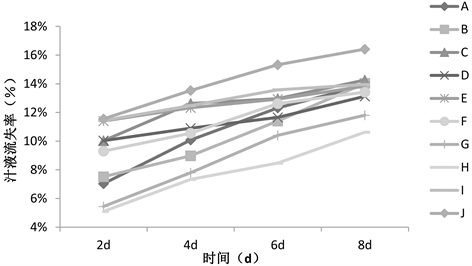
Figure 1. Change trend of centrifugal juice loss rate in groups A~J
图1. A~J组离心汁液流失率变化趋势
4.3. 复配型保鲜剂对鸡肉pH值的影响
从表5可以看出,随着鸡肉冷藏天数的增加,各组鸡肉的pH值均有不同程度的上升。参考GB 5009.237-2016“食品pH值测定”,按照pH把鸡肉划分为以下几个新鲜度等级:当pH值小于等于6.2时,判定鸡肉的新鲜度等级为一级;当pH值大于6.3但小于6.6时,判定鸡肉的新鲜度等级为二级;当鸡肉pH值大于等于6.7时其已成为腐败肉。从表中可以看出,两天后除对照组外,各组鸡肉均为一级新鲜度。四天后A组、B组、E组鸡肉为一级新鲜度,其它各实验组及对照组鸡肉为二级新鲜度。六天后A组、B组、E组、F组四组鸡肉仍为二级新鲜度,其他各实验组及对照组鸡肉均已成为变质肉。八天后各实验组鸡肉和空白对照组鸡肉的pH值均超过6.7,表明从pH值进行观测判定,八天后各组鸡肉已经全部变质,但E组鸡肉的pH值最小。

Table 5. Change of pH value in groups A~J
表5. A~J组pH值变化情况
5. 小结
实验显示以菌落总数为依据所有组的鸡肉在两天后均由新鲜鸡肉变为了次新鲜鸡肉。四天后,对照组鸡肉变为了变质肉。六天后,实验组的E组变为了变质肉。八天后除H组外其他各组鸡肉均变成了变质肉;以pH值为依据进行分析发现,各组复配型保鲜剂均能在一定程度上延缓鸡肉pH值的增长,其中E组复配型保鲜剂在抑制鸡肉pH值增长方面效果最好。但综合对各实验组及对照组鸡肉的新鲜程度进行分析可以看出,各组复配型保鲜剂对鸡肉均能起到一定的保鲜作用,可延长鸡肉保鲜期2到4天不等,可以减缓菌落增长速度,减少离心时的汁液流失率,减缓pH值的增长。其中以H组0.6 g/l谷胱甘肽 + 0.5 g/l柠檬酸 + 0.5 g/l山梨醇复配型保鲜剂的效果最佳。在第8天时,H组比空白对照组菌落总数低3.82 × 108 CFU/g,H组鸡肉的离心汁液流失率比空白对照组少6.32%,H组鸡肉的pH值比对照组低0.33。
基金项目
2018年度河南科技学院大学生“百农英才”创新项目“谷胱甘肽对鸡肉保鲜的应用研究”(项目编号为BNYC2018-2-49);河南省首批课程思政样板课《植物学》(教高【2020】531号)。
NOTES
*第一作者。
#通讯作者。