1. 引言
工业上,烯烃类化合物是合成不同有机化合物的重要原料。自由基介导的两种不同官能团对烯烃的加成,即烯烃的双官能化,为烯烃的应用提供了一种有效且经济的方法。一般来说,该反应高度依赖于烯烃的电子性质,主要局限于活化烯烃 [1]。从机理上讲,该反应通过邻位基团或杂原子P-P共轭来稳定烯烃接受自由基进攻产生的碳自由基,这有利于第二个官能团的引入。然而,非活化烯烃的自由基双功能化仍然是一项挑战性的任务。
自由基介导的分子内官能团迁移是非活化烯烃实现双官能团化的有效策略 [2]。在过去的几十年里,不光通过1,2-芳基迁移实现了烯烃的芳基化 [3],还发展了不同迁移位点的芳基迁移 [4]。然而,除芳基以外的官能团的迁移还没有得到进一步的研究。直到2016年,Zhu课题组首次开发了未活化烯烷烃的远端氰化迁移 [5]。此后,又研究了杂芳基,亚氨基,羰基,炔基和烯基等官能团。这是一个新兴的研究领域,本文将简要介绍已经实现的官能团迁移反应。因为羟基在一定程度上可以稳定邻位的碳自由基,所以目前只有α-羟基醛可以进行该反应(图1)。

Figure 1. Difunctionalization of unactivated olefins by means of distal functional group migration
图1. 通过远端官能团迁移实现未活化烯烃的双官能化
2. 分子内官能团远端迁移反应
2.1. 芳基迁移反应
2014年,Pohmakotr等人 [4] 公开了一种通过芳基取代的叔醇1合成3,3-二氟-2-丙酰基双环-[3.3.0]辛烷2的方法,该方法涉及到分子内自由基环化和1,4-芳基迁移级偶联(图2)。

Figure 2. Radical cyclization/1,4-aryl migration coupling reaction
图2. 自由基环化/1,4-芳基迁移偶联反应


Figure 3. Remote aryl migration for the synthesis of cyclic and acyclic ketones
图3. 远程芳基迁移用于环酮和无环酮的合成
基于芳基迁移策略,最近Liu等人报道了一种合成苯并环酮的有效方法(图3)。该方案涉及1,4或1,5-芳基迁移。该反应向芳基叔醇3外加各种自由基引发的迁移(例如,N3、CnF2n+1、P(O)Ph2、ArSO2等)。新产生的烷基自由基I环化产生双环自由基II。中间体II开环最终生成产物4。该方法为中、大环环状支架的构建提供了一种新的策略。
2.2. 氰基迁移反应
烷基腈通常作为胺、酰胺、羧酸和其他有用化学产品的前体,烷基腈的合成具有重要意义。自由基介导的烯烃氰化反应为将氰基添加到不饱和分子中生成烷基腈提供了新方法。然而,未活化烯烃的自由基腈化反应鲜有报道 [6]。2016年,Zhu等人(图4)利用远端氰基迁移策略首次公开了未活化烯烃的叠氮腈化反应 [5]。触发迁移的叠氮自由基由PIDA和TMSN3反应生成。该反应显示出对官能团的广泛耐受性,在温和的反应条件下获得了多种合成有用的烷基腈。
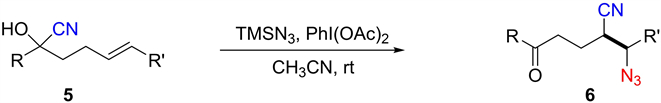
Figure 4. Azide cyanation of unactivated olefins
图4. 未活化烯烃叠氮氰基化反应
通过研究羟基和烯烃之间的链长发现n = 2和n = 3的反应以良好的产率得到了相应的叠氮腈化产物,但n = 1和n = 4的反应的产率较低。产生差异的原因是迁移经历的过渡态,五元或六元环过渡态比四元或七元环过渡态在动力学上更有利(图5)。
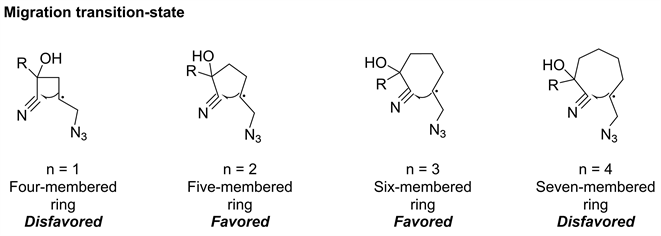
Figure 5. Transition states experienced by migration reactions
图5. 迁移反应经历的过渡态
作者假设了一种可能的反应机理(图6)。将TMSN3和PIDA相互作用产生的叠氮自由基添加到氰醇5中,形成不稳定的烷基自由基I。中间体I通过对C-N不饱和键加成形成亚胺自由基II。II的均裂解形成热力学上有利的III。最后,产物2可通过两种可能的途径获得:a)自由基III被PIDA氧化形成碳正离子IV,然后进行脱质子;b) PhI(N3)2捕获自由基III产生叠氮醇V,然后转化为产物。
由于SCF3的高度亲脂性,将SCF3加入分子中通常会显著提高其生物活性 [7]。Zhu等人 [8] 将该氰基迁移方案应用于未活化烯烃的氰基三氟甲基硫代反应。将AgSCF3和K2S2O8反应产生的CF3S自由基,添加到氰基醇5中,在室温下以良好产率得到产品7 (图7)。
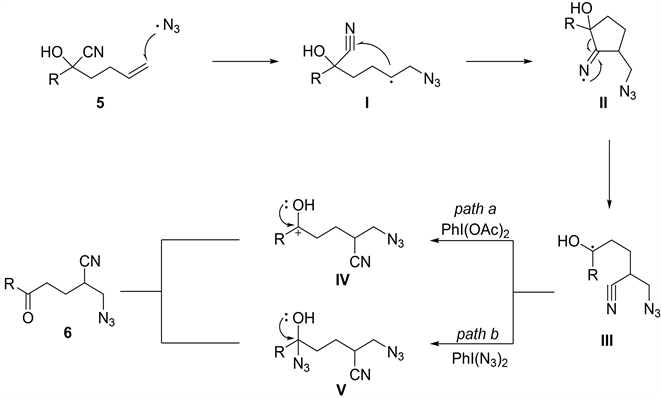
Figure 6. Proposed mechanism for azidocyanation of unactivated olefins
图6. 未活化烯烃的叠氮氰基化机理


Figure 7. Cyanotrifluoromethylthiolation of unactivated olefins
图7. 未活化烯烃的硫三氟甲基氰基化反应
图8描述了未活化烯烃的硫三氟甲基氰基化反应机理。首先,将源自AgSCF3和K2S2O8反应产生的CF3S自由基添加到氰基醇5中得到不稳定的烷基自由基I,其经历自由基环化以形成亚氨基自由基II。不稳定的亚氨基自由基触发了环状C-C键的均裂,产生更稳定的自由基III。中间体III氧化为IV最终脱质子得到产物7。
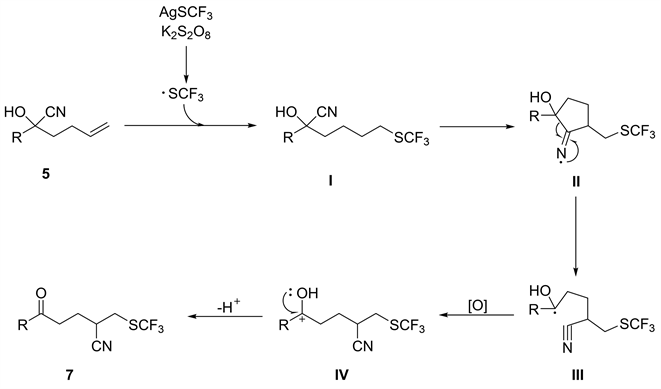
Figure 8. Proposed mechanism for cyanotrifluoromethylthiolation of unactivated alkenes
图8. 未活化烯烃的硫三氟甲基氰基化反应机理
含氟化合物广泛应用于医药、农药和高分子化学,因为氟原子的引入常常导致化学稳定性、亲脂性和生物活性的显著变化 [9]。同时向烯烃中引入氟烷基和氰基可以得到多种有用结构。Zhu等人证明远端氰基迁移反应可以实现这一想法。在可见光照射下,光敏剂催化下生成的二氟烷基自由基加到烯烃中引发接下来的氰基迁移 [10]。该反应展示出广泛的底物范围,在该反应条件下以良好的产率获得多种二氟和单氟烷基腈。温和的反应条件(图9)。除二氟乙酸盐外,二氟乙酰胺、二氟甲烷磺酰基苯、溴二氟甲烷和单氟乙酸盐也可与氰基醇反应。

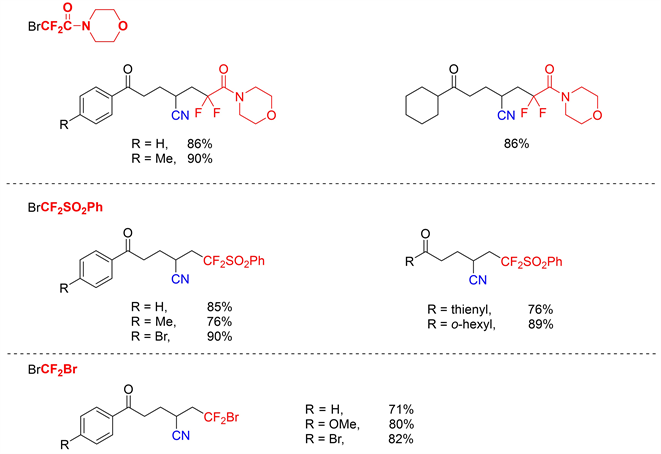

Figure 9. Cyano di/mono-fluoromethylation of unactivated olefins
图9. 未活化烯烃的氰基二/单氟甲基化反应
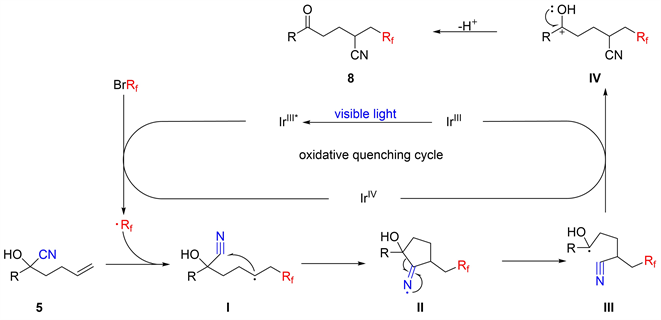
Figure 10. Plausible mechanism of cyano di/mono-fluoromethylation of unactivated olefins
图10. 未活化烯烃氰基二/单氟甲基化的反应机理
图10描述了该反应机理。强还原激发态*Ir(III) [E(Ir III*/IV) = −1.73 V vs. SCE]通过单电子转移(SET)被烷基溴代物猝灭,生成Ir(IV)和氟烷基自由基。氟烷基自由基与烯烃的亲电加成得到中间体I,该中间体5-exo环化下形成亚氨基自由基II。随后中间体II的C-C键均裂产生更稳定的III,氧化性IrIV物种[E(IrIV/III) = 0.77 V vs. SCE]对III的单电子氧化生成相应的碳正离子IV,再脱质子后生成产物8。
最近,Liu等人 [11] 报告了类似方案实现未活化烯烃的氰基化(图11)。使用TMS保护的氰基醇9作为起始材料。1,4或1,5-氰基迁移过程由多种自由基触发,包括氟烷基、膦酰基、叠氮基和磺酰基。在铜盐、银盐催化下实现反应。与上述反应机理类似的反应机理也以α-烷氧基自由基的单电子氧化和随后保护基团的脱除而结束,得到酮产物10。

Figure 11. Cyanofunctionalization of unactivated olefins triggered by various radicals
图11. 各种自由基引发的未活化烯烃的氰基化反应
2.3. 杂芳基迁移反应
除了C-N三键的氰基外,含有C-N双键的官能团的也展现了出色的迁移能力。含C-N双键的杂芳基在天然产物中普遍存在,在前200种药物中几乎有一半都含有杂芳基 [12]。最近,Zhu等人 [13] 开发了自由基介导的杂芳基远端迁移在未活化烯烃杂芳基化中的应用。在Langlois试剂(CF3SO2Na)和PIFA存在下,发生了杂芳基迁移(图12)。无论电子效应和空间效应如何,在室温条件下以良好产率得到产物12。除苯并噻唑外,其他五元杂芳基,如噻唑、苯并恶唑和咪唑也可迁移。此外,六元杂芳基如吡啶和喹啉也能发生迁移。实验结果显示,当五元杂芳基和六元杂芳基同时存在时,五元杂芳基的迁移比六元杂芳基容易。
图13中描述了一种合理的反应机理。PIFA与CF3SO2Na的相互作用生成三氟甲基自由基,该自由基添加到烯烃中产生不稳定的烷基自由基I。I经历五元环过渡态的分子内环化得到双环N中心自由基II。II的C-C键均裂解促使1,4-杂芳基迁移产生更稳定的中间体III。III单电子氧化和随后的脱质子最终得到产物12。
之后又将远端杂芳基迁移策略应用于未活化烯烃的杂芳基二氟烷基化/单氟烷基化(图14) [14]。以苯并噻唑取代叔醇11为底物,氟烷基化反应在可见光照射下顺利进行。该反应表现出良好的官能团耐受性。富电子或缺电子取代基得到的相应产物13的产率均较高。除苯并噻唑外,该方案还适用于多种五元和六元含氮杂芳基的迁移。
最近,Gu等人 [15] 报道了通过远端杂芳基迁移实现未活化烯烃的双官能团化。该反应由添加烷基自由基引发(图15),二烷基醚14被用作自由基供体,反应机理与Zhu (图13)所提出的类似。

Figure 13. Plausible mechanism of distal heteroaryl ipso-migration
图13. 远端杂芳基迁移反应机理


Figure 14. Heteroarylfluoroalkylation of unactivated alkenes
图14. 未活化烯烃的杂芳基氟烷基化反应
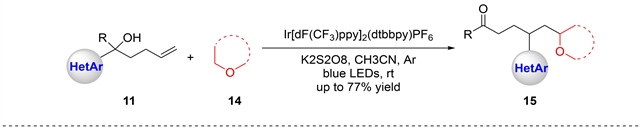

Figure 15. Alkylheteroarylation of unactivated alkenes
图15. 未活化烯烃的烷基杂芳基化反应
2.4. 亚氨基与羰基迁移反应
亚胺基团,另一种C-N双键,可以转化为许多其他有价值的官能团(例如胺、腈和醛),也能够进行迁移反应。最近,Zhu等人 [14] 以亚胺基取代的叔醇16为底物,反应在可见光照射下容易进行,以得到相应的亚氨基迁移产物17 (图16)。富电子和缺电子底物均能很好地耐受,得到氟化烷基酮。

Figure 16. Iminofluoroalkylation of unactivated olefins
图16.未活化烯烃的亚氨基氟烷基化反应
与不饱和C-N键类似,不饱和C-O键(即羰基)也具有远端迁移的潜力。Liu等人 [16] 公开了烯烃的1,2-羰基官能化,通过向烯烃中添加各种外部自由基(例如N3、CnF2n+1、P(O)Ph2、ArSO2等)引发的羰基迁移,由铜盐或Ir络合物催化,从而产生多种醛19。此外,基于该策略,在环扩张后,构建了各种苯环化中型和大型环支架21 (图17,顶部)。
Zhu等人 [14] 还揭示了未活化烯烃在可见光光催化下通过二氟烷基/单氟烷基自由基诱导的分子内甲酰基迁移进行的自由基介导的甲酰基氟烷基化反应(图17,底部)。在反应中,瞬时烷基自由基I添加到羰基中,形成环氧基自由基II,该自由基II通过烷氧基促进的β键裂解为更稳定的III。随后的III氧化和脱质子化得到氟化烷基醛23。
2.5. 炔基迁移反应
不久之后,Zhu等人 [17] 将这一策略扩展到炔烃的分子内迁移,可转化为在有机化学、药物化学和生物化学中有用的多种官能团。当使用炔基取代的叔醇24作为底物时,在Umemoto试剂作为自由基源经蓝色LED照射和fac-Ir(ppy)3的催化下,很容易得到的炔基迁移产物25 (图18)。底物的电子效应和立体效应对反应结果没有太大影响。除苯基外,杂环芳基(例如噻吩基和苯并呋喃基)和烷基在反应中也具有良好的耐受性。

Figure 18. Distal alkynyl migration under photocatalysis
图18. 光催化炔基迁移反应

Figure 19. Proposed mechanism for trifluoromethyl-alkynylation of unactivated olefins
图19. 未活化烯烃三氟甲基炔基化反应机理
三氟甲基炔基化反应的可能机理如下(图19)。光催化fac-Ir(ppy)3在可见光照射产生的激发态*IrIII被Umemoto试剂氧化猝灭,形成CF3自由基和IrIV。CF3自由基的亲电加成到24生成中间体I,该中间体进行环化得到烯基自由基II。II的开环产生更稳定的III。最后,IrIV物种被还原为IrIII,随后进行脱质子化,得到产物为25。
之后,Studer等人 [18] 披露了另一个炔基迁移。通过使用全氟烷基碘作为全氟烷基自由基源,首次实现了未活化烯烃同时引入全氟烷基和炔基(图20)。该反应还显示出广泛的底物范围,以较高产率得到所需的产物26。
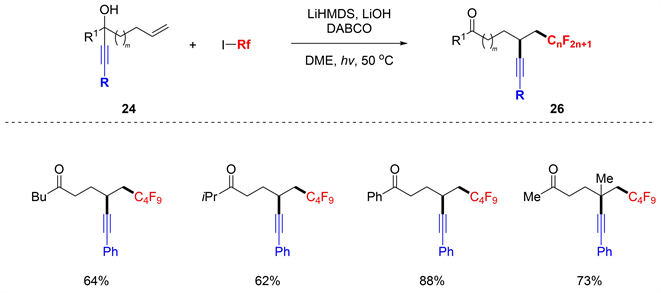

Figure 20. Distal alkynyl migration by electron-catalysis
图20. 电子催化下炔基远端迁移反应
图21中展示了一种合理的反应机理。在400 W灯的照射下,DABCO存在的情况下,最初的全氟烷基自由基是由全氟烷基碘生成的。全氟烷基自由基添加到原位形成的醇酸盐24-Li中得到烷基自由基I。I自由基环化得到乙烯基自由基II,环状结构的β-键断裂,生成III。最后,全氟烷基碘作为强还原剂发生电子转移,得到所需产物26。这个连锁过程假定是一个电子催化的过程 [19]。
最近,国内课题组报告了类似的通过炔基迁移策略对未活化烯烃进行二氟烷基/单氟烷基化(图22)。在两个方案中,在可见光光催化下生成的氟烷基自由基添加到炔丙醇24中,得到炔基迁移产物27。虽然是不同的自由基引发剂,但是炔基迁移步骤,与图19中提出的机理类似。

Figure 21. Plausible mechanism of distal alkynyl migration using perfluoroalkyl iodides
图21. 全氟烷基碘远端炔基迁移反应的可能机理
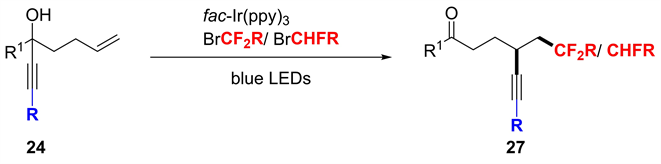
Figure 22. Radical di-/mono-fluoroalkylation
图22. 炔基二/单氟烷基化反应
2.6. 烯基迁移反应
最近,Liu和Studer组开发了未活化烯烃通过自由基介导的烯基迁移进行1,2-烯基官能化,得到多种氟烷基化烯烃。Liu [20] 公开了通过自由基1,3-、1,4-或1,5-乙烯基迁移用于烯烃1,2-氟烷基烯基化的催化C-C键重组策略(图23)。该过程由氟烷基自由基区域选择性进攻的末端烯烃28产生瞬时烷基自由基I,经历了环化和β-键断裂来完成环扩张和乙烯基迁移。该方案还提供了一种方法,用于制备各种难以制备的含全氟烷基的中等尺寸和大环烯烃。

Figure 23. Vinyl migration by CuI catalysis
图23. CuI催化乙烯基迁移反应
同时,在Studer [20] 的报告中,描述了过渡金属催化自由基实现未活化烯烃的全氟烷基化(图24)。可见光照射下的1,4-或1,5-烯基迁移反应无论取代基的影响如何,得到了良好的氟烷基化烯烃30。所提出的机理类似于图21中报告的末端炔基迁移机理。
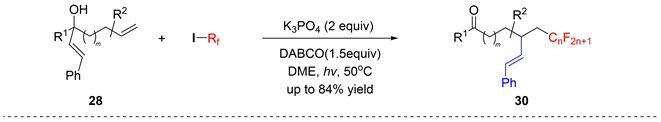
Figure 24. Distal vinyl migration by electron-catalysis
图24. 电子催化乙烯基远端迁移反应
3. 总结
本文总结了近年来通过分子内远端官能团迁移实现未活化烯烃双官能化的研究进展。包括芳基、氰基、杂芳基、亚氨基、羰基、炔基和烯基在内的一系列官能团的迁移能力。在过去几年中,许多有机化学家在自由基介导的远端官能团迁移方案上不断创新与发展,构建了许多有用的结构。
参考文献