1. 引言
合理利用农业废弃物资源以减少对环境的污染是当前绿色发展的途径,堆肥发酵是畜禽粪便资源化利用最有效可行的方式之一 [1]。堆肥过程本质上是由群落结构复杂多样的微生物相互作用而形成的一种复杂、动态的生化过程,其中微生物对基质的转化和分解发挥着重要作用 [2]。堆肥过程中细菌是分解有机物和产热的主要微生物种群,也是整个堆肥过程中最普遍、数量最多的微生物 [3]。堆肥是一个微生物功能丰富的资源库,但对高寒地区堆肥发酵过程中可培养功能细菌的研究鲜少报道。鉴于此,本研究以高寒地区的油菜秸秆和猪粪为主要原料,进行了功能菌株的筛选,为丰富堆肥中有益微生物的菌株资源以及功能利用奠定基础,同时为当地农作物秸秆的高效利用提供依据。
2. 材料与方法
2.1. 试验材料
2.1.1. 供试菌株
课题组前期在自然堆肥中分离获得,编号为DF200620,保存于4℃冰箱备用。
2.1.2. 培养基的制备
参照文献 [4] 进行如下改进:NB固体培养基:蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,琼脂15 g/L,121℃灭菌20 min;NB液体培养基:蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,121℃灭菌20 min。
2.2. 试验方法
2.2.1. 菌株活化与复壮
将保存的菌株DF200620采用平板划线法接种于NB固体培养基中,置于37℃培养箱中培养24 h。
2.2.2. 菌体形态学观察
将菌株在NB固体培养基上37℃下培养48 h后,观察菌落大小、形状、颜色和表面特征,并通过革兰氏染色用光学显微镜观察菌株的细胞形态。
2.2.3. 生物学特性研究
生长曲线的测定 参照王安妮等人的方法进行如下改进 [5]:菌种的培养:将赖氨酸芽孢杆菌以无菌操作的方法接入NB液体培养基,37℃置于恒温培养箱培养12 h左右,此菌液作为测定时的种子液。取菌株种子液,按5%接种量转接至已标记好培养时间的试管中,硅胶塞封口,每个时间点设置3次重复。将已接种的试管置摇床37℃,120 r/min振荡培养,每隔两小时测定一次,共测定24 h,按标记的培养时间取出试管,立即测定OD值,记录数据。对未接入菌种液的试管选用600 nm波长测定,在分光光度计上调节零点,以作为测定时的对照组。最后以OD600nm值为纵坐标,培养时间为横坐标,绘制生长曲线。
运动性观察 采用针穿刺接种的方法将菌株接种至NB半固体培养基的试管中(1000 mL培养基–5 g琼脂),在37℃恒温培养箱中培养24 h后观察生长状况。若菌株只生长在穿刺线上,边缘十分清晰,表示该菌不具有运动特性;若菌株沿着穿刺线向四周呈明显的云雾状扩散带,则表示该菌具有运动特性。
需氧性观察 参照张亚楠的方法进行如下改进 [6]:将菌株采用针穿刺接种的方法接种至NB半固体培养基的试管中(1000 mL培养基–5 g琼脂),在37℃恒温培养箱中培养24 h后观察生长状况。若菌株生长在穿刺线底部,则表示该菌是厌氧性细菌;若菌株生长在整个穿刺线上,则表示该菌是兼性厌氧菌;若菌株生长在穿刺线上部,则表示该菌是微好氧菌;若菌株生长在培养基表面,则表示该菌是好氧菌。
温度试验 将5%的细菌培养物接种在NB液体培养基上,分别在5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃下培养,每个温度梯度下分别做3个平行重复,观察其生长状况,并采用分光光度法在波长为600 nm条件下测定相应0D值。
pH试验 将5%的细菌培养物接种到pH值分别调至5、6、7、8、9、10、11的NB液体培养基中,每个梯度下分别做3个平行重复,37℃培养24 h后,采用分光光度法在波长为600 nm条件下测定相应0D值。
盐度试验 将5%的细菌培养物接种在含1%、2%、3%、4%、5%、6%、7% NaCl (W/V)的NB液体培养基中,每一浓度的液体培养基做3个平行重复,37℃培养24 h后,采用分光光度法在波长为600 nm条件下测定相应0D值。
耐旱性试验 参照文献 [7],用PEG6000 (聚乙二醇)形成模拟干旱环境,将5%的细菌培养物接种到PEG6000质量浓度为5、10、15、20、25、30、35 g/100mL的NB液体培养基中,每一浓度的液体培养基做3个平行重复,37℃培养24 h后,采用分光光度法在波长为600 nm条件下测定相应0D值。
2.2.4. 16S rDNA分子生物学鉴定
菌株基因组DNA提取 采用Ezup柱式细菌基因组DNA抽提试剂盒提取基因组DNA,具体步骤按照操作说明进行。
16Sr DNA基因PCR扩增 采用细菌通用引物27F (5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R (5’-CTACGGCTACCTTGTTACGA-3’)对基因组DNA进行扩增。
PCR反应体系的配制 在薄壁PCR管内配制50 μL反应体系,按下表准确加入各反应物(表1)。
PCR反应条件的设置 在PCR热循环仪上设置程序,按程序设置的条件进行扩增:1) 94℃预变性5 min;2) 94℃变性1 min;3) 57℃退火1 min;4) 72℃延伸90 s;5) 重复步骤2)~4) 30次;5) 72℃延伸15 min;6) 6℃ for ever。关闭PCR仪,取出PCR扩增产物进行琼脂糖凝胶电泳检测,确认PCR扩增片段。
序列测定 将DNA样品送到上海生物工程有限公司进行测序,参照文献 [8] 分别采用Neighbor-Joining法和Maximum Likelihood法构建系统进化树。
2.3. 数据处理
每次试验的数据均为3次独立试验平均值,采用Microsoft Excel 2010对原始试验数据进行整理分析。
3. 研究结果
3.1. 菌株形态学观察
如图1所示,菌株DF200620菌落形成表面光滑平坦并伴有光泽的边缘整齐的淡黄色,不透明,直径为2~4 mm的圆形菌落。穿刺试验结果表明菌株沿着穿刺线向四周呈明显的云雾状扩散带,表示该菌是具有运动特性的细菌,且菌株大量生长在培养基表面,少量生长在穿刺线中上部,表明该菌是好氧菌。在光学显微镜下观察菌株的细胞形态为杆状,革兰氏染色结果为紫色,说明该菌株是革兰氏阳性细菌。
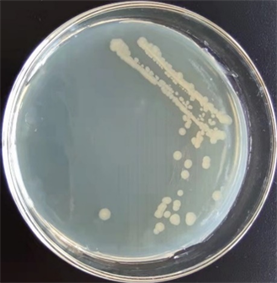
Figure 1. Colonies and cells morphology
图1. 菌落及细胞形态
3.2. 生物学特性研究
3.2.1. 生长曲线的测定
如图2所示,OD值随着时间的延长,前期呈现“S”型曲线,8 h后逐渐趋于平稳,16 h达到最高峰后逐渐下降。菌株DF200620在0~2 h内生长曲线较为平坦稳定,为调整期;2~8 h内曲线以几何级数快速增长,为对数期;8~16 h内曲线总体处于较为平坦的阶段,为稳定期;16 h以后曲线呈缓慢下降趋势,此时期为衰亡期。在调整期和对数期时,OD值差异显著(P < 0.05);稳定期时,12~16 h的OD值差异显著(P < 0.05);衰亡期时,18~20 h,22~24 h的OD值差异显著(P < 0.05)。
3.2.2. 温度试验
如图3所示,菌株DF200620在NB液体培养基中的OD值随着温度的增加呈现先升高后降低的变化趋势:在5℃~35℃时,随着温度的升高,OD值不断升高;35℃~40℃时,OD值下降。在5℃~40℃的各个温度阶段,OD值差异显著(P < 0.05)。结果表明菌株DF200620在10℃、15℃、20℃、25℃、30℃、35℃和40℃下均能够生长,且最适生长温度为35℃。

Figure 3. The growth of strains at different temperatures
图3. 不同温度下菌株的生长情况
3.2.3. pH试验
如图4所示,菌株DF200620在NB液体培养基中的OD值随着pH的增加呈现先升高后降低的趋势,当pH在5~7范围内时,OD值升高;pH在7~10范围内时,OD值急剧下降;pH在10~11范围内时,OD值下降缓慢。当pH在5~6,8~10范围内时,OD值差异显著(P < 0.05)。结果表明菌株DF200620在NB液体培养基的pH分别为6、7、8和9时均能够正常生长,最适生长pH为7,说明菌株DF200620具有一定的耐碱性。
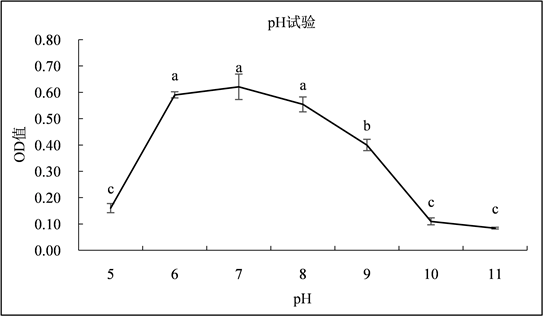
Figure 4. The growth of strain at different pH
图4. 不同pH下菌株的生长情况
3.2.4. 盐度试验
如图5所示,菌株DF200620在NB液体培养基中的OD值随着NaCl浓度的增加呈现逐渐下降的变化趋势,当NaCl浓度在0%~1%,2%~3%,5%~6%范围内时,OD值差异显著(P < 0.05)。结果表明菌株DF200620在含有0%、1%、2%、3%、4%、5%、6%和7%的NaCl的液体培养基上均能够生长,说明菌株DF200620具有一定的耐盐性。
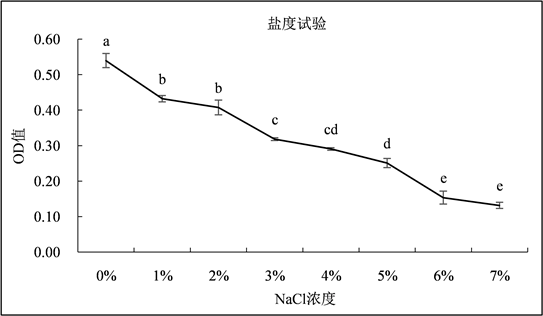
Figure 5. The growth of strain at different NaCl concentrations
图5. 不同NaCl浓度下菌株的生长情况
3.2.5. 耐旱性试验
如图6所示,菌株DF200620在NB液体培养基中的OD值随着PEG6000质量浓度的增加呈现逐渐下降的变化趋势,当PEG6000质量浓度在0~10 g/100mL,20~25 g/100mL范围内时,OD值差异显著(P < 0.05)。结果表明菌株DF200620在PEG6000质量浓度为5、10、15、20、25 g/100mL的NB液体培养基中均能生长,说明菌株DF200620具有一定的耐旱性。
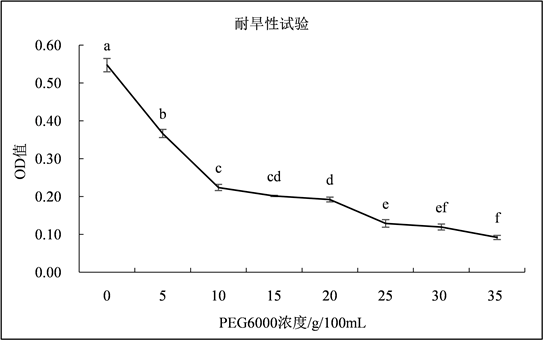
Figure 6. The growth of strain at different PEG6000 mass concentrations
图6. 不同PEG6000质量浓度下菌株的生长情况
3.3. 菌株的16S rDNA分子生物学鉴定
将菌株DF200620的DNA样品(DNA及PCR产物电泳检测结果如图7所示)送到上海生物工程有限公司进行16S rDNA完整长度测序,获得长度为1410 bp的序列。将菌株DF200620的16S rDNA序列在Blast网站进行比对后得到相似性较高的16S rDNA序列,最后利用MAGA7.0.26软件对所获得的菌株序列以及与其相似性较高的16S rDNA基因序列进行排列,鉴定结果如图8、图9所示,两种方法的结果均表明菌株DF200620与MK574994.1 Lysinibacillus sp. strain PF66X和JQ956508.1 Lysinibacillus sp. enrichment culture clone MJJ-12系统发育关系最为密切,同属于一个分支,并具有100%的同源性。
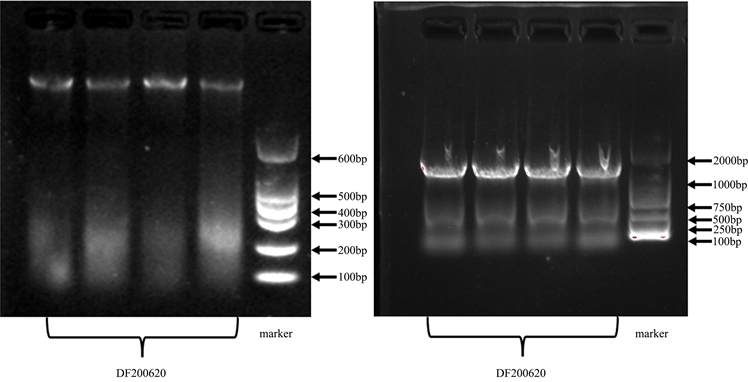
Figure 7. DNA figure and PCR run plastic figure
图7. DNA和PCR产物电泳检测

Figure 8. Phylogenetic tree constructed by Maximum Likelihood
图8. Maximum Likelihood法构建系统发育树
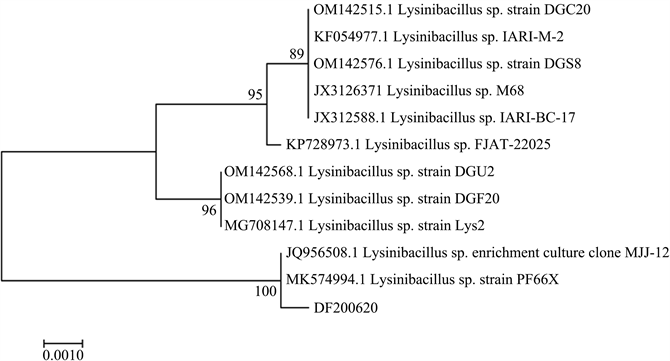
Figure 9. Phylogenetic tree constructed by Neighbor-Joining
图9. Neighbor-Joining法构建系统发育树
4. 讨论
本研究以课题组前期从猪粪和油菜秸秆自然堆肥条件下筛选获得的1株编号为DF200620的细菌为材料,对其生物学特性进行研究。结果表明,菌株DF200620有着与赖氨酸芽孢杆菌属的成员一致的表型特征,如菌落为表面光滑的圆形,呈杆状,为革兰氏阳性菌。Neighbor-Joining法和MaximumLikelihood法的结果均表明菌株DF200620与JQ956508.1 Lysinibacillus sp. enrichment culture clone MJJ-12和MK574994.1 Lysinibacillus sp. strain PF66X在同一分支上,亲缘关系最近,支持率高达100%,说明菌株DF200620的16S rDNA基因高度保守未发生异化。分子鉴定结果确定菌株DF200620为赖氨酸芽孢杆菌。生长曲线结果表明菌株DF200620的生长曲线在0~2 h为调整期,2~8 h内为对数期,8~16 h为稳定期,16 h以后为衰亡期。菌株在10℃~40℃内均可生长,最适温度为35℃;pH为6~9范围内均可生长,最适pH为7;在0%~7% (W/V) NaCl浓度范围均可生长;在聚乙二醇浓度为5~25 g/mL范围内均可生长。综上所述,说明菌株DF200620具有一定的耐旱耐盐碱特性。
目前为止,国内外的研究发现赖氨酸芽孢杆菌在多个领域具有极大的应用价值,主要集中在以下几个方面:1) 生物降解方面,Lysinibacillus属一些菌株具有一定的降解甲酚、硫化钠等污染物的作用 [9],可以降解食物和农产品的黄曲霉毒素B1 [10];2) 抑制病原生物方面,赖氨酸芽孢杆菌B-CM18对植物病原真菌的生长有抑制作用 [11];AHMAD等 [12] [13] 从果蔬中分离得到的赖氨酸芽孢杆菌(JX416855、JX416856)具有抗食源性细菌的潜力;3) 在畜牧生产方面,邢月腾等从猪肠道食糜中分离并筛选出高产赖氨酸的芽孢杆菌,可以减少赖氨酸添加剂在饲粮中的使用量及替代部分抗生素 [14];4) 在植物促生性和抗逆性方面,努斯热提古丽·安外尔等 [9] 从胡杨茎秆液分离得到1株赖氨酸芽孢杆菌ML-64,具有一定的耐旱、耐盐、耐高温特性;福建农林大学 [15] 研究发现两株具有较好溶磷效果的球形赖氨酸芽孢杆菌(YP17和P19)在促进巨桉幼苗生长方面具有较高潜力。总体来说,目前国内外对赖氨酸芽孢杆菌的研究报道较少,本课题组将持续致力于对该菌株的多方面深入研究与探索,为拓宽其利用价值提供一定的实验基础和理论参考,为丰富堆肥中有益微生物的菌株资源以及功能利用奠定基础,同时为当地农作物秸秆的高效利用提供依据。
基金项目
1) 青海省科技厅科技成果转化专项项目,禾/豆混播的微生物调控及菌肥研发(2022-SF-147)。2) 青海大学农牧学院大学生科研训练项目,1株赖氨酸芽孢杆菌的生物学特性及促生功能研究(NKX202112)。
NOTES
*通讯作者。