1. 引言
苯唑草酮是巴斯夫公司开发的一种新型高选择性苯甲酯吡唑酮类除草剂 [1] ,具有安全性高 [2] [3] 、选择性好 [4] 等特点,能有效防除玉米地一年生禾本科杂草和阔叶杂草 [5] [6] ,是玉米地除草剂中对哺乳类动物毒性最小 [7] 、最安全的一种除草剂 [8] [9] 。近年来苯唑草酮的使用范围也扩大到棉花和大豆等农作物 [10] ,具有广阔的市场前景。目前苯唑草酮原药的专利已到期,开发一条工艺简单、安全风险低、生产成本低,具有自主知识产权的工业化生产路线以满足本国市场需求意义重大 [11] [12] [13] 。根据起始原料的不同,代表性的合成路线如图1所示:
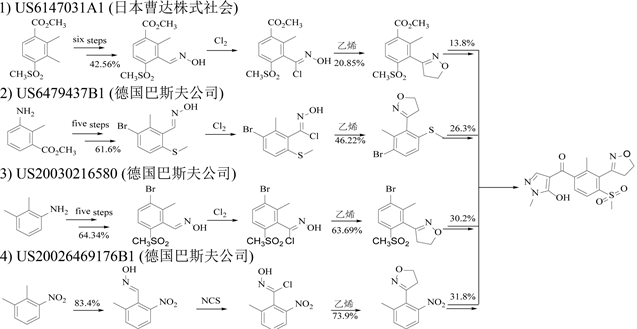
Figure 1. Synthesis process of oxazolidone
图1. 苯唑草酮的合成工艺
路线1和路线2分别使用甲磺基苯甲酸酯和氨基苯甲酸酯作为起始原料,经多步转化为肟中间体,后经环加成反应得到4,5-二氢异噁唑,然后经多步转化为苯唑草酮。上述工艺中所用起始原料是非常见的化工原料,价格昂贵,多步反应收率低,尤其是环加成反应(分别是20.85%和46.22%的收率)导致目标产物的总收率不高。路线3和路线4起始原料分别为邻硝基二甲苯和邻氨基二甲苯,廉价易得,且各步收率较高,更具工业化前景。对比二者,邻硝基二甲苯是邻氨基二甲苯上游原料,其作为原料在价格上具有优势。此外,硝基和氨基邻位甲基去质子后与亚硝酸酯进行亲核取代反应生成苯甲醛肟是工艺路线的重难点之一。以邻氨基二甲苯为原料的工艺,邻位甲基的肟化发生在氨基被甲磺酰基取代后。对比硝基和甲磺酰基,由于硝基的吸电子更强,更有利于甲基的去质子化,相应亲核取代反应更容易进行。因此,对路线4进行工艺改进,从而实现工业化生产的可行性更强。在路线4中,[3-(2-硝基-6-甲基)苯基]-4,5二氢异噁唑是关键中间体,是该路线的难点之一,需要先实现甲基的肟化,然后经过亲电氯化生成肟酰氯,最后在碱性作用下发生1,3-偶极环加成反应制备得到。现有对路线4进行的改进工艺 [14] [15] [16] 包括路线1~3都不可避免地需要使用氯气或NCS作为卤化试剂,氯气毒性大,腐蚀性强,是国家重点监管危险化学品。此外,NCS进行亲电氯化会伴随当量的有机酰胺副产物产生,不利于产物的提纯。因此,以邻硝基二甲苯为起始原料,探索[3-(2-硝基-6-甲基)苯基]-4,5二氢异噁唑合成工艺(其结构式如图2所示),尤其是避免使用氯气或NCS作为卤化试剂具有重要实用意义。
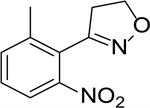
Figure 2. Structural formula of intermediate [3-(2-nitro-6-methyl) phenyl]-4,5-dihydroisoxazole
图2. [3-(2-硝基-6-甲基)苯基]-4,5二氢异噁唑中间体结构式
2. 实验部分
2.1. 实验材料与仪器
实验材料:2,3-二甲基-3-硝基苯(C8H9NO2, 98%),亚硝酸异戊酯(C5H11NO2, 95%),甲醇钠(CH3ONa, 98%),甲醇钾(CH3OK, 98%),氢氧化钠(NaOH, 99%),四氢呋喃(C4H8O2, 99%)和N,N-二甲基甲酰胺(DMF, 99.8%)等分析纯试剂购自于探索平台试剂网。盐酸(HCl, 36%)等购自国药集团有限公司。高纯氮气和高纯乙烯气体(99.999%)购自嘉兴南开气体有限公司。
实验仪器:ME104E型电子天平(梅特勒–托利多仪器有限公司);高温高压反应釜(上海予申仪器有限公司);Nicolet Thermofisher IS50型红外光谱仪(上海泽权仪器设备有限公司);400M-400MR型超导核磁共振仪(美国瓦里安技术有限公司);DSC3+/TRACE 1300-ISQ7000型质谱仪(塞默飞世尔科技有限公司);SR-3000 UltiMate3000高效液相色谱仪(美国戴安有限公司)。
2.2. 实验操作
2.2.1. 2-硝基-6-甲基苯甲醛肟的合成
50 ml四口圆底烧瓶,加入DMF (10 mL),甲醇钠(1.36 g, 25 mmol, 2.5 eq),在N2保护下降温至−45℃。然后缓慢滴加5 mL亚硝酸异戊脂(1.85 g, 15.0 mmol, 1.5 eq) DMF溶液,随后缓慢滴加10 mL 3-硝基邻二甲苯(1.53 g, 10.0 mmol) DMF溶液。待反应结束将反应液倒入60 mL冰水,用浓HCl调节pH值至3~4至固体完全析出。随后抽滤得米白色固体并水洗3次,烘干称重,HPLC监测纯度。1H NMR (400 MHz, DMSO) δ: 3.74 (s, 3H, ArCH3), 6.14 (d, 1H, Ar-H), 6.18 (d, 1H, Ar-H), 6.23 (d, 1H, Ar-H), 8.10 (s, 1H, ArCH=N), 10.77 (s, 1H, NOH). 13C NMR (400 MHz, DMSO) δ: 161.97, 159.61, 142.78, 102.77, 91.35, 91.03, 40.31, 40.10, 39.89, 39.69, 39.48, 39.27, 20.21. ESI-MS (m/z): 181. 17 [M + H]+.
2.2.2. [3-(2-硝基-6-甲基)苯基]-4,5二氢异噁唑的合成
向20 mL高压反应釜加入10 mL CH2Cl2溶液,随后依次加入2-硝基-6-甲基苯甲醛肟 (1.0 g, 5.5 mmol),氢氧化钠(5.5 mmol, 1.0 eq),次氯酸钠(6.6 mmol, 1.2 eq),最后通入的乙烯气体达到气压1.0 MPa,50℃下反应24 h。反应结束后将反应液进行萃取,洗涤,减压蒸馏得黄色固体。1H NMR (400 MHz, CDCl3) δ: 2.36 (s, 3H, ArCH3), 3.23 (q, 1H, CH2), 3.26 (q, 1H, CH2), 3.29 (q, 1H, CH2), 3.31 (q, 1H, CH2), 4.50 (q, 1H, CH2), 4.53 (q, 1H, CH2), 4.55 (q, 1H, CH2), 4.58 (q, 1H, CH2), 7.45 (d, 1H, Ar-H), 7.47 (d, 1H, Ar-H), 7.52 (d, 1H, Ar-H), 7.88 (d, 1H, Ar-H), 7.92 (d, 1H, Ar-H), 7.94 (d, 1H, Ar-H). 13C NMR (400 MHz, CDCl3) δ: 155.30, 148.78, 139.79, 135.55, 129.80, 125.15, 122.47, 77.40, 77.09, 76.77, 69.33, 38.94, 19.61. ESI-MS (m/z): 228.19 [M + Na]+.
3. 结果与讨论
3.1. 2-硝基-6-甲基苯甲醛肟的工艺优化
2,3-二甲基硝基苯合成2-硝基-6-甲基苯甲醛肟需要在亲核试剂和缚酸剂协同作用下进行,图3是笔者设想的机理。

Figure 3. Synthesis mechanism of 2-nitro-6-methylbenzaldehyde oxime
图3. 合成2-硝基-6-甲基苯甲醛肟的机理

Table 1. Effect of nitrite and base on affinity substitution reaction
表1. 亚硝酸酯、碱对亲和取代反应的影响
a反应温度:−40℃,原料:酯:碱 = 1:1.5:2.5;b温度:−30℃;c温度:−35℃;d温度:−45℃。
基于2,3-二甲基硝基苯合成2-硝基-6-甲基苯甲醛肟的原理,即硝基邻位甲基在碱性作用下被去质子化生成碳负离子,碳负离子进攻亚硝酸酯电正性氮原子完成亲核取代反应得到亚硝基甲基苯中间体,该中间体在碱性作用下互变为更稳定的肟酸盐。不同种类的碱的去质子化能力直接影响碳负离子的生成,亚硝酸酯的电正性强弱直接决定亲核取代反应能否发生,所以首先对碱的种类和酯的种类进行筛选,结果如表1所示。
笔者首先对碱的种类进行了探究,如表1中反应1~4所示,亚硝酸异戊酯为肟化试剂,在甲醇钠的作用下,该反应可以得到相对较好的收率(80.2%) (反应4)。碱性更强的叔丁醇钾的并不利于目标反应的进行,虽然原料完全转化,但得到的都是副产物,经质谱分析为两分子邻硝基二甲苯偶联副产物(反应1)。乙醇钠作为去质子化试剂时,原料可以完全转化,但反应收率不及甲醇钠(反应2)。相比于甲醇钠,甲醇钾在相同的时间内原料未完全转化且副产物较多(反应3)。最终笔者选择甲醇钠作为最优去质子化试剂。随后,考察了亚硝酸酯对反应的影响(反应4~7),从实验结果来看,亚硝酸异戊酯为最优的肟化试剂,使用其他亚硝酸酯时,反应的收率大大降低且其副产物较多。随后,对反应的温度进行了考察(反应8~10),结果表明低温更加有利于该反应。在−45℃反应时,该反应收率可以提高至86.9%,考虑到工业化后能耗方面问题,最终选择−45℃作为最优的反应温度。通过上述对碱的种类、酯的种类及温度的筛选,确定对2-硝基-6-甲基苯甲醛肟合成最佳工艺条件:以甲醇钠作缚酸剂,以亚硝酸异戊酯作肟化试剂,温度为 −45℃,最后以最高86.9%的收率得到目标产物。
3.2. [3-(2-硝基-6-甲基)苯基]-4,5二氢异噁唑的工艺优化
异噁唑是含有相邻氧原子和氮原子的五元杂环类化合物 [17] ,其作为重要结构单元普遍存在于具有生物活性的天然产物和药物分子中 [18] 。因此,关于异噁唑的有机合成方法受到广泛的关注和研究。在这方面,由甲醛肟进行亲电卤化生成肟酰卤素中间产物,随后在碱性条件下脱去一分子酸生成腈氧化合物和烯烃亲偶极体进行1,3-偶极环加成反应是构建该类化合物的最主要的方法 [19] [20] 。目前,根据文献检索结果,除了上述专利方法提到的使用氯气和NCS作为亲电卤化试剂外,使用PhICl2 [21] 、t-BuOCl [22] 在有机碱作用下进行亲电卤化也可以顺利进行1,3-偶极环加成反应得到目标产物(图4-1a,图4-1b)。然而PhICl2、t-BuOCl制备复杂,价格昂贵,该方法只适合于实验室制备,较难在工业化生产上进行推广。利用NaBrO2 [23] 作为亲电卤化试剂时也可以制备得到目标产物(图4-1c),该过程需要在Bu3SnCl的作用下进行,不可避免的带来了金属污染和工艺成本的增加。利用氧化卤化 [24] 的方法得到肟酰氯中间体也有少量报道(图4-1d),然而该过程会有等量的还原产物产生,增加了后处理成本。使用氯氨-T [25] 与甲醛肟反应也可得到相应的肟酰氯中间体,从而顺利进行环加成反应,然而当量的对甲苯磺酰胺副产物的产生增加了目标产物的提纯难度(图4-1e)。
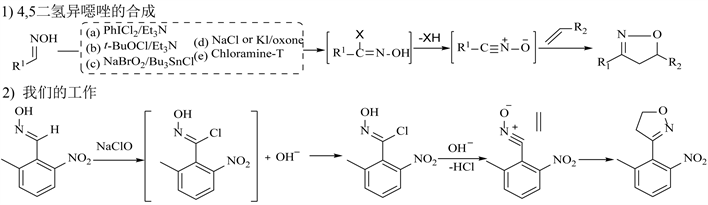
Figure 4. Synthesis of chemical intermediate and related literature reports of [3-(2-nitro-6-methyl) phenyl]-4,5-dihydroisoxazole
图4. [3-(2-硝基-6-甲基)苯基]-4,5二氢异噁唑的合成及相关文献报道
本文用次氯酸钠作为亲电氯化试剂,正一价的氯原子可以在苯甲醛肟亚胺基碳原子上发生亲电取代反应生成肟酰氯中间体,同时生成一分子的OH−。随后中间产物苯甲醛肟酰氯在碱性条件下脱去一分子HCl生成具有高活性的腈氧化合物,继而与乙烯亲偶极体进行1,3-偶极环加成生成目标产物(图4-2)。在该路线的创新之处在于次氯酸钠与苯甲醛肟亲电取代反应生成的OH−可以直接作用于苯甲醛肟酰氯中间体,实现HCl的消去,整个过程无需添加其他缚酸剂,且对苯甲醛肟酰氯进行分离提纯操作,而是以一锅两步法进行上述过程,与传统方法相比,大大较少了操作的难度。在该反应中,原料乙烯为气体,其溶解度受到压强影响,除了温度和溶剂等常见的条件以外,笔者对乙烯的压强也进行了筛选。

Table 2. Effects of solvent, temperature and ethylene gas pressure on cycloaddition reaction
表2. 溶剂、温度和乙烯气体压强对环加成反应的影响
a反应温度:50℃,b IPA为异丙醇,DCE为二氯乙烷,EA为乙酸乙酯,DCM为二氯甲烷,THF为四氢呋喃。
表2数据结果表明,在不额外加碱来缚酸的情况下,该环合反应可以顺利进行,且过程中无需对中间产物苯甲醛肟酰氯进行分离提纯,证明该设想可以实现。首先在对反应的溶剂进行筛选时,实验结果表明二氯甲烷作为溶剂时结果最佳(反应1~6),反应收率为86.5%。二氯乙烷和三氯甲烷也能取得较高收率,随着溶剂极性的增大,该反应的收率大幅度下降,可能是因为极性的溶剂不利于高活性腈氧化合物中间体的稳定。随后考察了反应温度对反应的影响,结果可以表明,在一定范围内升高温度有利于反应,而过高的温度反而会对反应产生不利影响(反应7~11),最终确定该反应的最优温度为50℃。笔者对乙烯压强进行了考察,结果表明压强对该反应的影响不大,但该反应的原料乙烯是气体,压强不够导致乙烯溶解量减少,反应时间变长,反应限度也会因为乙烯的量而受限,所以提供适当的压强有助于该反应(反应12)。通过对温度、溶剂和乙烯压强等条件进行筛选,确定了1,3-偶极环加成反应的最佳工艺条件:以二氯甲烷为溶剂,在50℃、1.2倍当量次氯酸钠,1.0 MPa乙烯压力下,反应时间24 h,收率达到86.5%。
4. 结论
本文首先对2-硝基-6-甲基苯甲醛肟中间体的合成工艺进行了研究,通过对碱的种类、酯的种类及温度的筛选,确定了以甲醇钠(2.5 eq)作缚酸剂,以亚硝酸异戊酯(1.5 eq)作肟化试剂,在−45℃反应温度下,以86.9%的收率得到目标产物。随后以2-硝基-6-甲基苯甲醛肟为原料合成[3-(2-硝基-6-甲基)苯基]-4,5二氢异噁唑,通过对温度、溶剂和乙烯压强等条件进行筛选,溶剂为二氯甲烷作为溶剂时,反应温度50℃,1.0 MPa乙烯压力条件下,收率达到86.5%。该工艺创新性地利用次氯酸钠作为亲电氯化试剂,避免了传统工艺中的剧毒氯气和NCS的使用,且需进行传统工艺中对中间产物苯甲醛肟酰氯分离提纯,直接以一锅两步法进行亲电氯化和1,3-偶极环加成反应,步骤经济型好。此外,该过程无需添加缚酸剂,副产物仅为氯化钠,后处理简单,对环境影响小,适合工业化。
致谢
感谢李以名副教授的指导,感谢王陶教授的帮助,感激储明明讲师的帮忙,也感谢同门的出谋划策。
基金项目
浙江省基础公益研究计划项目(LGG21B030003)。
参考文献