1. 引言
进入新世纪以来,随着重工业的飞速发展,出现了大量环境被工业废水所污染的新闻并且存在排放量大,成分复杂等问题,因为重金属不能自行降解,即使在很低的浓度下也会呈现很大的毒性,很容易造成对环境造成巨大污染,其中以Pb2+、Hg2+、Cr3+等重金属离子污染最为严重,因此如何有效经济地处理工业废水成为现代改善环境的一大难题。现代科研工作者也对此做了大量研究,如刘雨等人 [1] 利用膜技术处理工业废水,该技术虽具有效率高,损耗低等优点,但废水中往往存在酸性物质使得膜的老化很严重且无法避免,因此其对使用环境要求很高。刘明言 [2] 则提倡通过电化学的方法进行污水处理,但经过实验表明其虽可以有效去除重金属污染物,但其存在电能利用效率等缺点,不适合大规模应用,经济性欠佳。最近有学者提出生物炭协同微生物体系进行污水处理,利用生物炭与微生物协同吸附作用以达到处理废水重金属的目的,但体系研究较少且由于微生物的生存等原因导致其对环境要求很高。
现如今使用以催化剂为载体的活性炭应用最为广泛,其由于发达的孔隙结构以及制备简便等特点,因此具有很强吸附性和低成本的特点,但在吸附时却一直存在吸附材料的再生能力差,固液分离困难等缺陷,在实际处理水中受到很大限制。所以为了弥补传统吸附材料的缺陷,纳米磁性吸附材料逐渐进入研究人员视野,其于20世纪80年代问世是一种新型磁性材料,当颗粒尺寸达到纳米级别时,其会有宏观颗粒所不具备的性质如纳米颗粒的小尺寸效应、宏观量子隧道效应、表面效应及量子尺寸效应,这些效应会使粒子的电学性能、磁学性能等发生变化,使其具备与宏观颗粒所不一样的特性 [3] 。因此所制备的磁性纳米材料也使材料磁性能发生了质的飞跃。通过进行磁性材料的磁化和纳米化所制备的吸附剂在提升吸附效果的同时,也可以在外加磁场作用下与废水进行分离,具有良好的固液分离能力,并且经过后续的洗涤和脱附处理即可实现二次利用,进一步提高废水处理的经济性和实用性。
随着研究深入,研究人员通过对磁性粒子表面进行接枝改性、酸或碱改性使其吸附性能又得到进一步提升。其可以处理废水中重金属、染料、苯酚等其他污染物,因此磁性纳米吸附材料在废水处理领域受到广泛关注,如目前合成技术较成熟的TiO2基纳米材料,钛酸氢纳米片和Ag-ZnFe2O4纳米复合材料等。
介于此本文制备并研究了一种新的重金属吸附剂——铁酸锰纳米微球,基于铁酸锰纳米颗粒合成机理,运用尿素来提供OH−,调控其用量进行对铁酸锰纳米颗粒形貌的控制,在制备过程总添加聚乙烯吡咯烷酮(PVP)利用其较强的比表面能提高捕获重金属粒子的能力同时也在磁性粒子表面形成保护膜,保护磁性粒子,不被外界环境破坏,保留磁性粒子特征 [4] 。通过外界磁场控制实现其与工业废水的脱离,在洗脱液的作用下实现磁性粒子与重金属分离,实现吸附材料的重复利用并将其应用在废水处理领域提高传统废水处理吸附材料的实用性及其经济性 [5] [6] [7] 。
2. 实验制备
2.1. 实验原料
本实验采用溶剂热法制备铁酸锰纳米微球,其中采用的原料及其来源如表1所示。

Table 1. Chemical reagents used in the experiments
表1. 实验用化学试剂表
2.2. 实验原理
将乙二醇作为溶剂,使六水合氯化铁与四水醋酸锰溶解其中,利用尿素水解得到的OH−离子使溶液呈现碱性同时利用溶剂热法提供的高温环境,使Fe3+和Mn2+共沉淀生成MnFe2O4纳米结构。其可能的化学反应如式(1)所示:
Mn2+ + 2Fe3+ + 8OH−→MnFe2O4 + 4H2O (1)
2.3. 实验步骤
首先称取1.05 g的FeCl3·6H2O、0.45 g的Mn(CH3COO)2·4H2O将其分散到60 ml乙二醇溶液中,运用磁力搅拌器搅拌30 min后直至形成均匀的棕黄色溶液,加入7 g尿素后搅拌均匀使溶液呈现碱性,同时加入4 g聚乙烯吡咯烷酮(PVP)搅拌溶解后,将混合溶液转移至100 ml的不锈钢反应釜中,放入烘箱中在160℃保温6 h,冷却至室温后收集沉淀,去离子水和乙醇清洗数次并离心收集,将收集到的沉淀60℃干燥4 h,最后将干燥后的沉淀放入到管式炉中,升温速率1℃/min,在氮气氛围下500℃煅烧3 h,自然冷却到室温后即可得到黑色的铁酸锰(MnFe2O4)颗粒粉末,如图1所示 [8] 。

Figure 1. Schematic diagram of synthesis of MnFe2O4 magnetic nano-microspheres
图1. 铁酸锰磁性纳米微球合成示意图
2.4. 材料表征及性能测试
2.4.1. 微观形貌表征
通过ZEISS Sigma 300场发射电子扫描显微镜(SEM)对铁酸锰纳米微球进行形貌表征。将样品分散于无水乙醇中,超声分散后将其悬滴于铜网之上,使其留下薄薄一层,后调整加速电压为10 KV,进行电镜观察。
2.4.2. 磁性能测试
通过振动样品磁强计(VSM)测试铁酸锰的磁性,将样品安装于VSM系统样品架,使其位置稳定,设置磁场范围为−30000 Oe到30000 Oe,后进行基线校准消除仪器噪音等干扰因素,将系统调成室温,开始测试。
2.4.3. 比表面积测试
通过Quantachrome Nova 4000 E比表面积分析仪进行测试,将装有样品的试管装到脱气站抽真空去除表面吸附气体杂质,完毕后回填氦气并利用减量法称重样品质量,后将其装入分析站,在杜瓦瓶中加入液氮,设置参数,进行吸附脱附测试,根据测试的N2吸附/解吸等温线,运用Barrett-Joyner-Halenda (BET)测试其比表面积。
2.4.4. 静态吸附实验
通过该实验测试MnFe2O4纳米微球对重金属的吸附能力及效果。具体步骤为:以Pb2+、Hg2+、Cd2+和Cr3+四种重金属离子作为吸附质与去离子水混合模拟工业废水,分别在特定浓度一定量的模拟废水中投入定量MnFe2O4纳米微球吸附剂,在不调节溶液pH值和室温的条件下震荡,过滤后测试各个时间段离子剩余浓度,计算吸收率 [9] [10] 。
3. 结果分析与讨论

Figure 2. Product photos of MnFe2O4 nano-microspheres
图2. MnFe2O4纳米微球的产物照片
图2为制备的MnFe2O4纳米微球成品,其成体为黑色小颗粒。图3为MnFe2O4纳米微球的扫描电镜照片,从扫描拍摄结果来看,采用溶剂热法制备的磁性粒子颗粒完整,总体呈现球形。由高倍放大的(a)图可观察到具体的粒子形貌,直径大致在2微米,表面粗糙且呈球状凸起,表面有些许微孔结构。

Figure 3. Scanning electron microscope photos of MnFe2O4 nano-microspheres
图3. MnFe2O4纳米微球扫描电子显微镜照片
图4为对MnFe2O4纳米微球在室温下进行VSM测试的结果,该图显示了MnFe2O4纳米微球在−30000到30000 Oe的磁场范围内的磁滞回线,通过对其测试结果分析来看其符合经典的郎之万顺磁理论,忽略剩磁以及矫顽力在某种程度上来说可以认为MnFe2O4纳米微球在室温下具有超顺磁性,这表明若将其应用在重金属废水处理时可以通过外加磁场的作用使其与废水分离,轻松实现吸附材料重复利用。
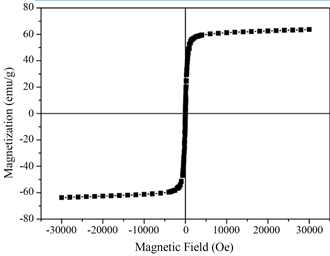
Figure 4. Room temperature magnetization curve of MnFe2O4 nano-microspheres
图4. MnFe2O4纳米微球的室温磁化曲线
图5为MnFe2O4纳米微球N2吸附/解吸等温线,根据等温线的吸附分支与解吸附分支不重合,形成一封闭的环状且通过压力不断升高其在一定范围内吸附N2的量达到一个饱和值,由此可知该等温线为IUPAC所规定的Ⅳ型,说明其表面孔结构较小为典型的介孔。通过BET理论公式计算表明由此种方法制成的MnFe2O4纳米微球比表面积约为80.13 m2/g。并且结合SEM测试结果再一次说明该类粒子表面为介孔结构。
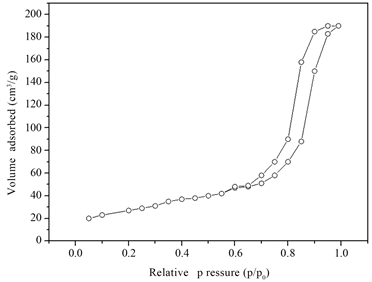
Figure 5. N2 adsorption/desorption isotherm of MnFe2O4nano-microspheres
图5. MnFe2O4纳米微球N2吸附/解吸等温线
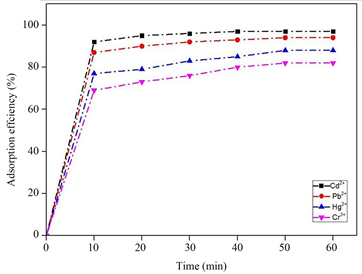
Figure 6. Simulation of industrial wastewater absorption rate by MnFe2O4nano-microspheres
图6. MnFe2O4纳米微球吸附模拟工业废水吸收率
图6显示了MnFe2O4纳米微球对重金属吸附率测试结果,可见纳米微球对Pb2+、Hg2+、Cd2+及Cr3+均有优异的吸附能力,在吸附初期其对几种重金属离子的吸附效果逐渐升高,随着时间增长,吸附效果达到最大值。磁性粒子对几种重金属离子的吸附率均可达到80%左右,吸附性能良好。
4. 工业应用探讨
目前,对于以MnFe2O4纳米微球作为吸附剂进行工业废水处理仍然处于实验理论研究阶段,工厂实际应用很少且目前自来水供水价格日趋上涨,这将促使各个企业加大对废水处理的投入,而就工业废水运营分析而言,我国大多工业仍处在成长阶段,尤其是重金属处理的运营,它的市场容量巨大,具有很好的应用前景。以本研究为例,本文采用溶剂热法进行制备MnFe2O4纳米微球的成本约为10元/g,若假设每吨水投入200 g纳米微球,每次在外界磁场作用下进行分离后脱附重复使用次数为5次,则其处理5吨水约2000元,平均一吨水400元。而采用传统活性炭进行吸附大约在500元/吨,可见其相比于传统吸附材料具有较大经济性 [11] [12] 。如若工业上采用MnFe2O4纳米微球其凭借纳米尺寸赋予的高的比表面能,可以与重金属离子快速接触并吸附可有效提高重金属离子的去除率;MnFe2O4纳米微球具有磁性,在吸附重金属后可在外加磁场作用下有效的与工业废水分离,经洗脱液洗脱后可再次进行使用;MnFe2O4纳米微球在制备过程中加入聚乙烯吡咯烷酮,在提升表面自由能的同时也可进一步保护磁性粒子,使其具有高的机械强度,进一步提升其对使用环境的适应度 [13] ;MnFe2O4纳米微球理论上可以循环使用5次以上,能进一步节约企业污水处理成本。
但由于其处于纳米尺寸,导致其具有较高的比表面能,因此会存在纳米微球MnFe2O4纳米微球团聚的缺点,导致应用性能下降。如若将其作为增强相,石墨烯作为基体将其制成具有吸附性能的复合材料,通过完善合成工艺,则其团聚问题迎刃而解 [14] 。此外经过文献报道称MnFe2O4纳米微球可能具有些许毒性,但由于其应用在处理废水领域时,每吨投放200 g导致其浓度很低,另外加之在磁场作用下可分离,所以其毒性可以忽略不记。综上所诉,MnFe2O4纳米微球应用在工业废水领域具有非常好的应用前景 [15] [16] 。
5. 结论与展望
本研究以溶剂热法为基础制备MnFe2O4纳米微球,通过尿素提供OH−使溶液呈现碱性,后与Mn2+及Fe3+相互作用生成产物,同时加入聚乙烯吡咯烷酮(PVP)进一步提高磁性粒子表面活性并保护磁性粒子,降低应用时对环境的敏感度。该方法制备的目标磁性粒子具有效率高,成本低,易于固液分离等特点,通过实验模拟其对重金属有着优异吸附性,是一种理想的吸附材料。现虽已成功制备MnFe2O4纳米微球但其载体的选择仍存在问题,是否能广泛应用于实际废水处理以及其在复杂环境下能否正常工作仍需实验,需根据实际情况不断改进制备过程。未来可从表面改性方向研究,引入活性基团等方面进一步提高其吸附性能;采用复合形式,选择合适基体制备介孔材料,其可增强纳米微球对环境适应能力的同时也解决纳米微球应用时易团聚缺点,把该类粒子带到一个新高度。
基金项目
国家级大学生创新创业训练计划项目:一种可重复使用重金属吸附剂的制备及应用(项目编号:202310076001)。
参考文献
NOTES
*通讯作者。