摘要: 本文研究不同纯度的辣根过氧化物酶(horseradish peroxidase, HRP)催化降解苯甲醛的效果。实验室制备商业级产品A (RZ > 0.8,酶活 > 80 U/mg),B (RZ > 1.5,酶活 > 150 U/mg),C (RZ > 3.0,酶活 > 300 U/mg)三种不同纯度的辣根过氧化物酶。通过改变时间、温度、pH、反应物浓度和酶量等变量探究产品B催化转化苯甲醛的最佳反应条件。利用获得的最佳反应条件,确认产品A和C催化降解苯甲醛的效果,发现产品B与A有明显差别,与C没有显著性差别。考虑到不同纯度HRP产品存在显著的价格差异,本研究认为,产品B (RZ > 1.5,酶活 > 150 U/mg)对于降解苯甲醛而言具有最佳经济适用性。
Abstract:
In this paper, the effects of horseradish peroxidase (HRP) with different purities on the catalytic degradation of benzaldehyde were evaluated. Products A (RZ > 0.8, enzyme activity > 80 U/mg), B (RZ > 1.5, enzyme activity > 150 U/mg) and C (RZ > 3.0, enzyme activity > 300 U/mg) were prepared in our lab. The parameters including time, temperature, pH, reactant concentration and enzyme amount were optimized. Using the optimal parameters, the effects of products A and C were evaluated. The results indicated that products B was significantly different from A but similar with product C. Considering the economic issue, these results indicated that Product B (RZ > 1.5, enzyme activity> 150 U/mg) might be the best choice to degrade benzaldehyde for industry.
1. 引言
辣根过氧化物酶(horseradish peroxidase,HRP)是一种来源于辣根根部的血红素蛋白酶 [1] [2],被广泛运用于生物医疗 [3] [4] [5] [6] 、日用化工 [7] [9] 、以及环境保护 [10] [11] 等领域。商品化的HRP,由于纯度不同,价格存在显著差异(以BBI公司产品为例,RZ > 1.5的HRP价格为136.8元/100 mg,RZ > 3.0的HRP价格为320.0元/100 mg)。实现HPR使用目的与成本的最优平衡,获得最佳性价比的方案是工业界的持续关切。苯甲醛作为一种简单的芳香醛广泛用于食品、香料及制药等行业 [12] [13],产生的苯甲醛污染一直以来用HRP催化过氧化氢降解来治理 [14] - [18]。然而,罕有文献报道HPR降解苯甲醛的效率与成本之间关系的研究。
本文首先根据Barnard [19] 、Mohamed [20] 等人以及Mejri [21] 等人的相关研究确定从辣根中提取纯化HRP的实验方法,根据孙海霞的超滤提取HRP法 [22] 以及Carpenter等人的冻干蛋白制剂法 [23],得到产品A (RZ > 0.8,酶活 > 80 U/mg),产品B (RZ > 1.5,酶活 > 150 U/mg),产品C (RZ > 3.0,酶活 > 300 U/mg)三种不同纯度的辣根过氧化物酶。之后,选用产品B催化氧化苯甲醛,依次从反应时间、温度、pH值、反应物浓度和酶量等方面探索最佳反应条件。最后,在最佳条件下,比较产品A、B以及C的催化降解能力。发现产品B的降解效果与产品C和BBI产品(RZ > 3.0,320.0元/100 mg)没有显著性差异,但与产品A存在明显差异。对于催化氧化苯甲醛而言,产品B具有最佳性价比。本研究可以为合理使用不同纯度HRP,降低使用成本提供思路。
2. 仪器与试剂
2.1. 仪器
BT600-2J蠕动泵,保定兰格恒流泵有限公司;752型紫外可见分光光度计,舜宇恒平有限公司;KQ-700E型超声波清洗器,昆山市超声仪器有限公司;5810R型离心机,Eppendorf仪器有限公司;pH酸度计,梅特勒–托利多仪器有限公司;玻璃层析柱,上海煊盛生化科技有限公司;BSM电子天平,上海卓精电子科技有限公司;成套超滤装置,美国Spectrum仕必纯有限公司。
2.2. 试剂
99.5%三羟基氨基甲烷,北京百灵威科技有限公司;柱蛋白纯化填料,武汉汇研生物技术股份有限公司;无水乙酸钠,上海泰坦科技股份有限公司;冰乙酸,国药集团化学试剂有限公司;盐酸,国药集团化学试剂有限公司;分析纯硫酸铵,上海泰坦科技股份有限公司;氢氧化钠,上海泰坦科技股份有限公司。30%过氧化氢,国药集团化学试剂有限公司;苯甲醛,国药集团化学试剂有限公司。HRP RZ > 1.5、HRP RZ > 3.0,BBI生命科学公司。
3. 实验方法
3.1. 辣根过氧化物酶的分离纯化
分离纯化步骤如图1。将辣根冷冻、切碎、硫酸铵萃取后用硅藻土吸附,10 kD水性微孔滤膜滤去固相,超滤浓缩液相后,通过硫酸铵分级分离,再次收集液相超滤浓缩。将浓缩液载入CM琼脂糖凝胶色谱柱,碱性洗脱,超滤浓缩,冻干后得到产品A。酸性洗脱CM琼脂糖凝胶色谱柱,超滤浓缩洗脱液并载入DEAE琼脂糖凝胶色谱柱,酸性洗脱液超滤浓缩后冻干,得到产品B。碱性洗脱DEAE琼脂糖凝胶色谱柱,超滤浓缩洗脱液后载入Phenyl琼脂糖凝胶色谱柱,酸性洗脱,超滤浓缩洗脱液,冻干后得到产品C。三种不同纯度的HRP产品分别为A (RZ > 0.8,酶活 > 80 U/mg),B (RZ > 1.5,酶活 > 150 U/mg),C (RZ > 3.0,酶活 > 300 U/mg)。根据酶活计算总收率产品A为96%,产品B为62%,产品C为39%。(U的定义:在20℃,pH值为6.0的条件下,前20秒内催化产生1毫克红棓酚的酶数量)。
3.2. 影响苯甲醛去除率的单因素实验
当用紫外分光光度法同时测定苯甲醛和苯甲酸混合液含量时,溶液在250 nm处的吸光度值与苯甲醛浓度成正比 [24] [25]。配制空白样与测试样(表1),在250 nm下用空白样调零后读取测试样的吸光度值,记为A1,反应后的吸光度值记为A2,按照下列公式计算出去除率(α),从而确定处理效果:
α = (A1 − A2)/A1 × 100%。

Table 1. Compositions of the reaction solution
表1. 反应液组成
a) 反应时间对苯甲醛降解率的影响
在反应温度40℃,磷酸缓冲液pH为7,苯甲醛溶液浓度为5 mmol/L,30%氧化氢溶液浓度为0.5 mol/L,HRP浓度为20 ug/mL的条件下,分别读取反应0、20、40、60、80、100 min时的吸光度值,求得降解率。
b) 反应温度对苯甲醛降解率的影响
在最佳反应时间下,在磷酸缓冲液pH为7,苯甲醛溶液浓度为5 mmol/L,30%氧化氢溶液浓度为0.5 mol/L,HRP浓度为20 ug/mL的条件下,分别读取反应温度为10、20、30、40、50、60℃时苯甲醛的降解率。
c) 缓冲液pH对苯甲醛降解率的影响
在最佳反应时间和最佳反应温度下,保持苯甲醛溶液浓度为5 mmol/L,30%氧化氢溶液浓度为0.5 mol/L,HRP浓度为20 ug/mL不变,考查磷酸缓冲液pH为4,5,6,7,8,9时苯甲醛的降解率,得到该反应的最适pH。
d) 探索苯甲醛起始浓度对苯甲醛降解率的影响
在最佳反应时间、最佳反应温度、最适pH下,控制30%氧化氢溶液浓度为0.5 mol/L以及HRP浓度为20 ug/mL的条件不变,改变苯甲醛起始浓度1,2,3,4,5,6,7 mmol/L时,根据苯甲醛降解率的变化探究苯甲醛起始浓度对反应的影响。
e) 探索过氧化氢浓度对苯甲醛降解率的影响
在最佳反应时间、最佳反应温度、最适pH,最适苯甲醛起始浓度下,探究过氧化氢浓度分别为0.1,0.2,0.3,0.4,0.5,0.6 mol/L时的降解率。
f) 探索辣根过氧化物酶浓度对苯甲醛降解率的影响
分别配制辣根过氧化物酶浓度为10,20,30,40,50 ug/mL的酶溶液,在最佳反应时间、最佳反应温度、最适pH,最适苯甲醛起始浓度,最适过氧化氢浓度下,测算降解率。
3.3. 不同纯度酶对苯甲醛去除率的影响实验
使用产品B (RZ > 1.5,酶活 > 150 U/mg),设计单因素实验,依次确定了最佳反应时间、最佳反应温度、最适pH,最适苯甲醛起始浓度,最适过氧化氢浓度和最适HRP浓度。之后,在最优条件下检测产品A (RZ > 0.8,酶活 > 80 U/mg)和产品C (RZ > 3.0,酶活 > 300 U/mg)对苯甲醛去除率的影响。
4. 结果与讨论
4.1. 影响苯甲醛去除率的单因素实验结果
使用产品B在考查时间变量的实验中发现,前60 min降解率随着时间延长而增加,60 min时降解率达到57.4%。之后的40 min内,降解率维持在57.4%左右并不再随时间延长而变化,说明反应在60 min到达终点(图2a)。因此,我们选用60 min作为后续研究的终点时刻。接下来我们考查了反应温度对降解率的影响情况,当反应温度在10℃至40℃时,苯甲醛的降解率随温度的升高而升高,40℃时降解率出现峰值。若反应温度大于40℃,降解率随着温度的升高反而呈下降趋势(图2b)。这一结果显示,温度较低时,酶活较低,导致降解率低,随温度升高反应加剧,降解率升高,但超过40℃后,酶蛋白变形失活,导致苯甲醛的降解率反而出现下降。相关文献也有类似的结论 [26]。固定反应时间60 min,反应温度40℃,调节缓冲液pH值,发现在pH 4~6之间,酶的降解活性随着pH值的增大而增强,当pH值到达6时,酶的活性达到峰值59.4%,略高于pH为7时的情况,说明弱酸环境更利于此反应(图2c)。对于不同浓度的苯甲醛,在酶浓度为20 ug/mL时,降解率依旧维持在59.4%左右,该结果表明,苯甲醛初始浓度对该反应的影响不大(图2d)固定反应时间60 min、温度40℃、pH值6、苯甲醛的浓度5 mmol/L,酶浓度20 ug/mL,改变过氧化氢的浓度(0.1~0.8 mol/L)后发现,苯甲醛的降解率在0.5 mol/L之前随着浓度的增大而增大,在0.5 mol/L之后维持在峰值59.4%左右,过氧化氢浓度的增加对降解率的增加没有显著提高(图2e)。使用产品B在表1所配的反应体系中,设置反应时间60 min,反应温度为40℃,磷酸缓冲溶液pH为6,苯甲醛溶液浓度为5 mmol/L,过氧化氢溶液浓度为0.5 mol/L,HRP浓度为20 ug/mL时,苯甲醛的降解率59.4%。当HRP浓度大于等于30 ug/mL时,苯甲醛的降解率可达到最大值64.7% (图2f)。
4.2. 不同纯度酶对苯甲醛去除率的影响
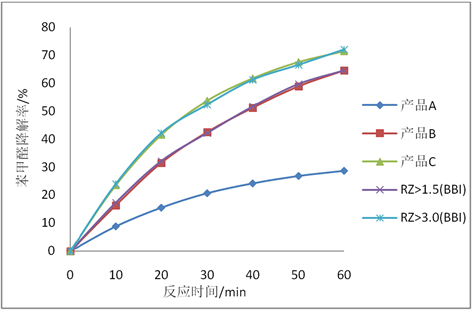
Figure 3. Relationships between HRPs with different purities and the removal rates of benzaldehyde within 60 min
图3. 不同纯度辣根过氧化物酶60 min内与苯甲醛去除率的关系
图3中五根曲线分别代表实验室制备得到的三种不同纯度的HRP产品A (RZ > 0.8,酶活 > 80 U/mg),B (RZ > 1.5,酶活 > 150 U/mg),C (RZ > 3.0,酶活 > 300 U/mg)以及BBI公司市售的HRP产品(RZ > 1.5和RZ > 3.0)五种产品,在表1所配的反应体系中,在最优反应条件下(反应温度为40℃,磷酸缓冲液pH为6,苯甲醛溶液浓度为5 mmol/L,过氧化氢溶液浓度为0.5 mol/L,HRP浓度为30 ug/mL,60 min),降解苯甲醛的曲线图。实验结果显示,产品A的最终降解率为28.7%,比同条件的产品B低36%比产品C低42.8%,产品A的降解效果与产品B和C有显著性差异,产品B与产品C相差6.8%,不存在显著性差别。产品B和C的曲线分别与BBI公司对应的产品基本一致,说明产品B和C与BBI公司相应的HRP产品对苯甲醛的降解效果相当。从经济适用性角度考虑,产品C (RZ > 3.0)对苯甲醛的降解效果仅为产品B (RZ > 1.5)的1.1倍,而价格是产品B的2.3倍(以BBI市售价格为参考),产品C的纯化流程也较产品B更为复杂,选用RZ > 1.5,酶活 > 150 U/mg的HRP产品进行苯甲醛的降解反应具有最佳性价比。
基金项目
江苏省自然科学基金(BK20190608)和江苏省博士后科研资助计划(2019K220)。