1. 引言
近年来,随着全球气候变暖和海洋污染日益加重,水母数量呈暴发性增长,导致沿海地区水母蛰伤的发病率逐年增加,水母蜇伤已成为威胁人类健康和生命安全的重要医学问题之一 [1]。我国每年有数万人遭受水母蜇伤的痛苦,水母蜇伤已是潜水作业、海洋捕捞、水上运动项目以及沿海城市旅游业的主要危险因素之一。同时,也是我军进行海上军事行动如海上军事演习、渡海作战以及和平时期岛屿防御面临的特殊医疗卫生保障课题 [2]。本文将从水母的分布和毒素特点、水母蜇伤的机理和防治措施三个方面展开综述。
2. 水母的分布和毒素特点
(一) 水母的分布特点
水母是海洋中最常见的浮游生物之一,全球各地的水域中分布着上百种水母,甚至在淡水区都有它们的活动踪影。据考证,水母已存在大约六亿五千万年之久,是地球上最古老而神秘的生物之一,有“水中活化石”的美称。然而,随着人类对海洋渔业资源的过度捕捞和气候变暖造成海水富营养化等因素,水母的天敌数量大大减少,各国沿海海域水母数量爆发性增加,水母蜇伤的病例也与日俱增。常见的致人蜇伤的水母是海月水母 [3]、越前水母 [4]、箱水母 [5] 和僧帽水母 [6]。海月水母、越前水母主要分布在亚太地区;箱水母又称海黄蜂,大多分布于澳大利亚海域和东南亚海域;僧帽水母主要分布于位于热带和亚热带的大西洋和地中海海域。我国近海暴发的大型水母主要包括海月水母、越前水母以及白色霞水母 [7]。
(二) 水母毒液的理化性质/蛋白质组学
水母毒液是一类结构复杂和特殊的蛋白质和多肽类混合物,至今我国海域常见的越前水母Nemopilema nomurai毒液(NnV)的具体组分尚不明确。Choudhary Indu等 [8] 在研究中,通过使用二维凝胶电泳和基质辅助激光解吸/电离飞行时间质谱(MALDI/TOF/MS),一共鉴定出150种蛋白质,其中包括毒素和其他在刺丝囊胚发生和神经细胞生长中很重要的蛋白质,揭示了毒液成分从PI 3-10到15-250 kDa之间的分子量,如图1所示。在这项研究中,鉴定出磷脂酶A2,磷脂酶,丝氨酸蛋白酶,Kunitz型丝氨酸蛋白酶抑制剂,整联蛋白和金属蛋白酶,溶血素,白细胞毒素,三指毒素MALT0044C以及其他毒素蛋白。Nemopilema nomurai,Cyanea nozakii,Rhopilema esculenta和Aurelia aurita等水母毒液中的多种金属蛋白酶,表现出蛋白水解活性和诱导的细胞毒性,可能是导致水母蜇伤肿胀,发炎和皮肤坏死的主要诱因。
中科院海洋研究所的于华华等人 [9] 通过venomics和毒腺转录,研究分析了来自越前水母毒液的成分,对218种毒素进行了鉴定。越前水母刺丝囊毒液表现出多种酶活性,其中金属蛋白酶活性和PLA2样活性占主导,它们的催化活性取决于不同的理化条件,例如温度,pH和二价离子等。这些毒素在其他有毒物种的毒液中具有相对较好的表征,可能会诱发溶血,炎症,蛋白水解,凝血,细胞溶解,出血活性,和I型超敏反应等。
 来源:参考文献8:Choudhary Indu, Hwang Du Hyeon, Lee Hyunkyoung, et al. Proteomic Analysis of Novel Components of Nemopilema nomurai Jellyfish Venom: Deciphering the Mode of Action [J]. Toxins, 2019, 11(3), 153.
来源:参考文献8:Choudhary Indu, Hwang Du Hyeon, Lee Hyunkyoung, et al. Proteomic Analysis of Novel Components of Nemopilema nomurai Jellyfish Venom: Deciphering the Mode of Action [J]. Toxins, 2019, 11(3), 153.
Figure 1. 2-DE of jellyfish vemons
图1. 扫描的双向凝胶电泳(2-DE)图像
3. 水母蜇伤的机理
(一) 水母触手的结构特点
水母属于肠腔动物门,水母在触手及口周组织表面广泛分布着刺细胞,刺细胞中含有储存毒液的刺丝囊。刺丝囊是一种具有高度组织弹性的丝状弹性体,当刺丝囊中的物理和化学感受器受到刺激时,激活刺丝囊内的钙离子通道并使其开放,囊腔内的瞬时渗透压能达到150倍大气压,水母毒液在高渗透压的作用下被射出刺丝囊,起到防御作用 [10] [11] [12]。
(二) 水母蜇伤的临床表现
1) 局部中毒
水母触手上的物理和化学感受器受刺激时,刺丝囊迅速射出水母毒素,毒素中具有激肽样作用的金属蛋白酶和通道蛋白酶引发Ca2+内流产生,局部血管扩张,血管壁通透性增加,导致部分皮肤充血水肿、瘙痒剧痛,出现皮疹、水肿、甩鞭样红斑等症状(如图4),严重者后期可能还会出现水疱糜烂、局部组织出血坏死等现象。
2) 全身中毒
水母毒素因其成分复杂,作用器官和细胞较多,极易引起全身中毒的症状(见表1)。当机体中进入大量的水母毒素,全身毛细血管广泛扩张和通透性急剧增加引起的有效循环血量减少,会导致严重的低血压性休克,患者出现昏迷、无尿等症状,极易出现循环系统衰竭。复杂的水母毒素还会引起平滑肌痉挛性疼痛,肾上腺素–醛固酮系统稳态失调,心脏负荷过重,心输出量下降,肺静脉回流受阻导致肺水肿。严重的甚至会出现心率失常、室颤、心搏骤停等心脏功能障碍或肺水肿引起的呼吸功能障碍和多器官衰竭 [13] [14] [15]。

Table 1. Toxin protein purified from jellyfish venom by chromatography
表1. 通过色谱法从水母毒液中纯化的毒素蛋白
aMolecular weight estimated by SDS-PAGE in kDa. bMolecular weight measured by mass spectroscopy in kDa.
(三) 水母蜇伤的机制探索
在水母毒液中观察到的生物活性与在其他有毒物种中观察到的相似。然而,标本的可用性对于生物学和结构研究可能是一个问题。由于水母毒素极不稳定且量非常少,种间差异性较大,导致其毒性成分的纯化与鉴定,以及作用机制研究相对滞后。
通常,根据目标器官损伤,研究人员将水母毒液的毒性分为心脏毒性,神经毒性,溶血性,肝毒性,肾毒性等,几乎所有的体内器官都可以被水母毒液攻击。此外,许多体外细胞实验还显示出水母毒液对心肌细胞,肝细胞,T细胞乃至各种肿瘤细胞的杀伤作用都具有非特异性的死亡作用。通过结构生物信息学蛋白质数据库,从五个水母细胞毒性蛋白质中鉴定出几个高度保守的氨基酸区域,该蛋白质与预测的跨膜跨区域一致,表明水母毒液有可能作为造孔毒素,破坏易感细胞中正常的跨膜离子浓度梯度,从而产生细胞毒性。
Wang B等人研究发现 [15],具有严重的多器官功能障碍或全身性损害的迟发性水母毒化综合征(DJES),通常在水母蜇伤后2 h出现。为了建立DJES模型并获得有关其过程的更多详细信息,他们进行了包括临床化学,病理学和免疫组织化学在内的综合方法,以同时监测Canenea capillata触手提取物对生命的影响(见图2)。进一步研究结果表明,水母毒液可能在血管平滑肌细胞膜上形成通道复合物,引起细胞外Ca2+流入血浆,最终导致系统性血管收缩。这种异常的系统性永久的血管收缩可能会导致重要器官的缺血和缺氧以及继发性代偿性反应,对心脏,肺,肝和肾这些器官产生多种毒性作用,在多器官损伤的过程中起着非常重要的作用。通过多种器官功能障碍的DJES模型研究,DJES的可能机制可能归因于水母毒液的细胞毒性、血管收缩作用和其他特定靶器官毒性的协同作用。

Figure 2. Morphological changes of the organs (liver, kidney, heart and lung) 10h after administration of TE from the jellyfish C. capillata (360 mg/kg, i.v.) in rats. In control group (the same volume of saline, i.v.), the morphology of the liver (A), glomeruli (C), renal tubules (E), heart (G) and lung (I) were normal. (B) In the liver of TE-treated group, extensive hemorrhage (arrows) and hepatic coagulation necrosis (*) were present. (D) In the glomeruli of TE-treated group, fibrin microthrombi deposited in some glomerular capillaries (arrows), hyaline casts (*) and vacuolations (:) filled Bowman’s capsule. (F) In the renal tubules of TE-treated group, diffuse peritubular capillary congestion (arrows), detached cellular debris (*) and hyaline casts (:) were seen. (H) In the heart of TE-treated group, wavy fibers (arrows), irregular myocyte diameters and interstitial edema were observed. (J) In the lung of TE-treated group, sporadic hemorrhage (arrows) was observed in some alveolar space. (n = 3, hematoxylin AND eosin staining, scale bars ¼ 100 mm, insert bars ¼ 20 mm)
图2. 水母触手处理10 h后的大鼠器官切片(图片来自参考文献15) (n = 3,苏木精和曙红染色,刻度尺¼ 100 mm,插入杆¼ 20 mm)。在对照组(相同体积的生理盐水,静脉注射)中,肝(A),肾小球(C),肾小管(E),心脏(G)和肺(I)的形态正常。(B)在TE治疗组的肝脏中,存在广泛的出血(箭头)和肝凝血坏死(*)。(D)在TE治疗组的肾小球中,纤维蛋白微血栓沉积在肾小囊中,沉积在一些肾小球毛细血管(箭头),透明管(*)和空泡(:)中。(F)在TE治疗组的肾小管中,观察到弥散性肾小管周围毛细血管充血(箭头),分离的细胞碎片(*)和透明管铸型(:)。(H)在TE治疗组的心脏中,观察到波浪状纤维(箭头),不规则的心肌细胞直径和间质水肿。(J)在TE治疗组的肺中,在某些肺泡腔中观察到零星的出血(箭头)
4. 水母蜇伤的防治措施
海军人员在担负沿海地区非战争抢险救灾行动、海训演习和作战行动期间,极易出现水母蜇伤的现象。被水母蜇伤后多剧痛奇痒,病程较长,往往错过最佳的治疗窗口,容易造成部队非战斗减员。水母蜇伤后,第一时间的急救措施和合理有效的治疗手段可以大大减轻伤者的痛苦。因此,研究水母蜇伤的防治措施显得格外重要。
(一) 常见的临床处理措施
1) 物理隔离手段
在实际运用过程中人们发现,运用专业的水母衣可以在一定程度上减少水母蜇伤的伤害。同时,应避免在常有水母出没的海域作业,与水母保持较远的距离,可以避免水母被水母刺丝囊发射的毒液伤害。
2) 临床处理
因淡水会刺激水母触手分泌毒素,故应避免用淡水冲洗伤口,需要采用海水在现场冲洗,清除粘附在皮肤或伤口表面的触手和毒液,而后采用5%醋酸或食醋或40%~70%异丙醇湿敷、1%氢化可的松处理伤口,或1%氨水、5%碳酸氢钠等弱碱性溶液或明矾水等冷敷,采用乙醇消毒,以生理盐水反复冲洗后局部外用皮质激素和抗生素,并进行全身抗变态反应、抗感染等对症处理,促使局部水肿和全身症状消退 [16]。
当患者病情危急出现休克等严重症状时,必须紧急后送至中心医院重症监护病房(ICU),立刻给予肌内注射肾上腺素、大剂量血管活性药物和抗凝药物持续泵入,并视情况进行气管插管或呼吸机治疗保持气道通畅,同时给予甲泼尼龙琥珀酸钠冲击治疗、快速输注白蛋白或血浆,应用大剂量乌司他丁等蛋白酶抑制剂对症治疗 [17]。
3) 麻醉剂的选择
目前,澳大利亚复苏委员会(ARC)建议先加醋,再加冰作为热带澳大利亚水母蜇伤的急救手段。但Pyo M J等人 [18] 在研究中评估了各种冲洗液的调节作用和人体皮肤测试。结果显示,食醋(4%CH3COOH)会立即导致刺丝囊中大量毒液的排出,不利于安全冲洗。70%的乙醇和异丙醇会急剧增加疼痛和发红,患者依从性较差。而海水和利多卡因不会引起任何刺丝排出,且有10%的受试者皮肤红斑减少,因而推荐海水和利多卡因安全地用作急救冲洗液。Mark等人 [19] 报告了在使用热水和局部利多卡因浸泡作为急救方法治疗两名被澳大利亚有毒热带水母蜇伤的人,该方法实现了快速镇痛。热疗法对于缓解水母皮炎疼痛、消除水肿有较好的效果,但在该方法中使用热水治疗应该建立在水母触手及刺丝细胞清理干净的前提上,否则刺丝细胞破裂释放的毒素可能会加剧患者的病情与疼痛。
在Laura M等人 [20] 的测试中,麻醉剂利多卡因喷洒在与水母触手接触的测试人员皮肤上时,能够立即缓解疼痛。触手悬浮液最初暴露于利多卡因后,随后暴露于乙酸乙醇氨或菠萝蛋白酶后,有效阻止了毒液的排出。初步机制研究发现,利多卡因除了在与水母触手接触的皮肤上充当麻醉剂外,还可能通过阻断神经细胞的钠或钙通道来抑制刺丝毒液的排出。
(二) 预防和治疗的新手段
1) 金属阳离子抑制剂的使用
金属阳离子可以提高刺胞周围环境中的金属阳离子浓度,减少刺胞刺丝的发射,从而阻断毒素进入体内。在专利EP 2380577 [21] 中,通过使用合适浓度的Zn2+和La3+组合物对刺胞的激发起到了较好的抑制作用;专利US 6338837 [22] 发现,通过使用抗组胺剂苯海拉明和Ca2+,K+,Mg2+等金属阳离子对刺胞的激发起到了较好的抑制作用;关于金属阳离子对刺胞激发的抑制作用,张智 [23] 曾做过较为系统的研究,最后发现当水溶液中含有500 mmol∙L−1 LaCl3、25 mmol∙L−1 MgCl2和25 mmol∙L−1 CaCl2时对发型霞水母刺胞的激发作用抑制效果最好。
2) 孔道/膜蛋白抑制剂的使用
张慧等人 [24] 研究发现,0.6 g/kg的右旋糖酐(Dextran-40)能明显缓解发型霞水母触手提取物(TE)导致大鼠出现的血压下降症状,改善TE导致大鼠的肝功能指标(ALT,AST,A/G)、心肌损伤的相关酶指标 (CK,LDH)异常情况。通过使用激光扫描共聚焦显微镜检测胞内Ca2+含量,TE组胞内Ca2+含量快速升高,Dextran-40低中高干预组的荧光强度均显著低于TE组,其中Dextran-40在5 μg/mL组抑制效果最明显(见图3)。研究人员推测,Dextran-40对致命性水母蜇伤的保护作用可能与其稳定血压或者封堵水母毒素在细胞膜上形成的Ca2+孔道有关,考虑到Dextran-40是临床上的常见用药,未来有希望成为水母蜇伤的急救用药。
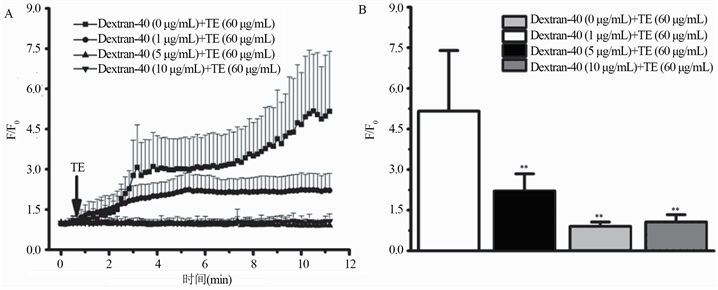
Figure 3. Antagonistic effect of Dextran-40 on the changes of intracellular Ca2+ content in cardiomyocytes induced by TE; A: Real-time changes in fluorescence intensity (F/F0) of 4 groups of cells within 10 minutes of TE treatment; B: Comparison of the fluorescence intensity (F/F0) of the 4 groups of cells after 10 minutes of TE treatment
图3. Dextran-40对TE所致心肌细胞胞内Ca2+含量变化的拮抗作用(图片来自参考文献24)。A:TE处理10 min内4组细胞在的荧光强度值(F/F0)实时变化;B:TE处理10 min后4组细胞在的荧光强度值(F/F0)比较
非特异性的MMP抑制剂,可以抑制细胞外基质的降解,进而抑制动脉损伤后的血管平滑肌细胞的增生和迁移。于华华等人经过细胞实验发现,巴马司他可有效抑制水母毒素引起的两种细胞(人角质形成细胞HaCaT和人胚胎成纤维细胞CCC-ESF-1)的死亡和炎症因子mRNA的表达量(见图4),进而可将其作为用于制备水母皮炎的药物,拓宽了巴马司他的应用范围 [25]。
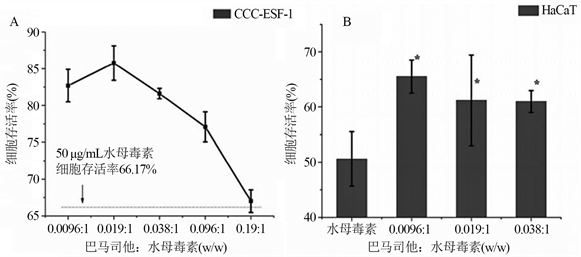

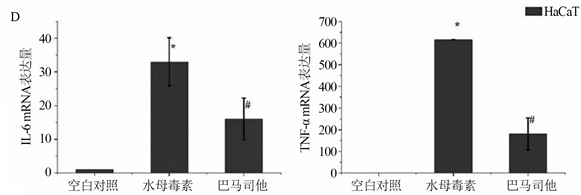
Figure 4. Effect of batimastat on the survival rate and inflammatory factor expression of HaCaT cells and CCC-ESF-1 cells. A, B: Effect of batimastat on the survival rate of HaCaT cells/CCC-ESF-1 cells; C, D: The effect of batimastat on HaCaT cells/CCC-ESF-1 cell inflammatory factors
图4. 巴马司他对HaCaT细胞和CCC-ESF-1细胞的存活率和炎性因子表达的影响。A,B:巴马司他对HaCaT细胞/CCC-ESF-1细胞存活率的影响;C,D:巴马司他对HaCaT细胞/CCC-ESF-1细胞炎性因子的影响(图片来自参考文献25)
3) 多克隆抗体的使用
Kang C等人 [26] 首先已经通过酶联免疫吸附试验(ELISA)从免疫的兔血清中确认了野村水母(NnV)多克隆抗体(pAb)的存在,产生了抗NnV的多克隆抗体。针对NnV产生的兔抗血清能够中和这种毒液的细胞毒性,溶血活性和对小鼠致死性的能力。此外他们使用了蛋白质组学,通过二维电泳和免疫印迹结合MALDI-TOF分析建立了NnV的初步蛋白质谱。在最终的免疫步骤之后,可以获得多克隆抗体(pAb)对NnV的特异性反应性(见图5)。当将多克隆抗体与NnV预孵育时,它在以浓度依赖的方式中和NnV毒性方面显示出很高的效力。与免疫前的血清相比,在免疫的前6周中抗体滴度急剧增加,此后达到平稳。该研究表明,使用特异性抗体可以对越前水母的的毒化进程进行干预,是一种潜在的治疗手段。
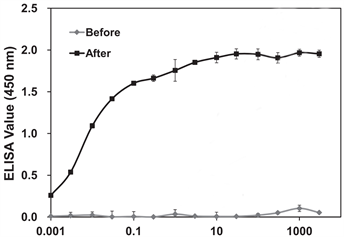
Figure 5. Specific reactivity of pAb to NnV [26]
图5. pAb对NnV的特异性反应性(来自参考文献26)
4) 潜在的靶向治疗药物
澳大利亚箱水母的毒性是急剧的,剧毒会在严重暴露后数分钟内导致局部组织坏死、极度疼痛甚至死亡。Man-Tat Lau等人 [27] 通过使用基因组规模的慢速CRISPR诱变来筛选毒液暴露诱导的细胞死亡所需的宿主成分,将ATP2B1(也称ATP质膜Ca2+转运蛋白1,PMCA1)确定为我们筛选中排名最高的命中之一和排名最高的膜蛋白(图6(a)),从而对水母毒液诱导的细胞死亡途径进行分子解剖。为了确认ATP2B1的作用,我们生成了稳定的ATP2B1 CRISPR敲除细胞系(图6(b))。重要的是,ATP2B1的消耗导致HAP1和HeLa细胞中对水母毒液的抗性增加(图6(c),图6(d)),从而证实了该基因在毒液细胞毒性中的作用,外周膜蛋白ATP2B1为毒液发挥细胞毒性所需的一种宿主因子, 靶向作用于ATP2B1可防止毒液作用并提供长期的保护。进一步研究发现,ATP2B1具有多个功能域。以ATP2B1的第一个细胞外环为靶标的Caloxin 1B3处理的细胞对水母毒液的抵抗力更强,而以Caloxin 2A1的第二个细胞外环靶向的细胞则无作用(图6(e))。在测试箱水母毒液是否通过钙依赖性方式杀死细胞时,令人惊讶的是,毒液触发了与ATP2B1无关的钙流入,外部或内部钙的消耗对毒液的细胞毒性没有影响。箱水母毒液通过ATP2B1起到毒化作用,但通过不依赖钙的机制诱导细胞死亡,进一步完善毒液成分和潜在的内毒素靶标以及内在化的机制尚待建立,但这是一个有价值的研究方向。
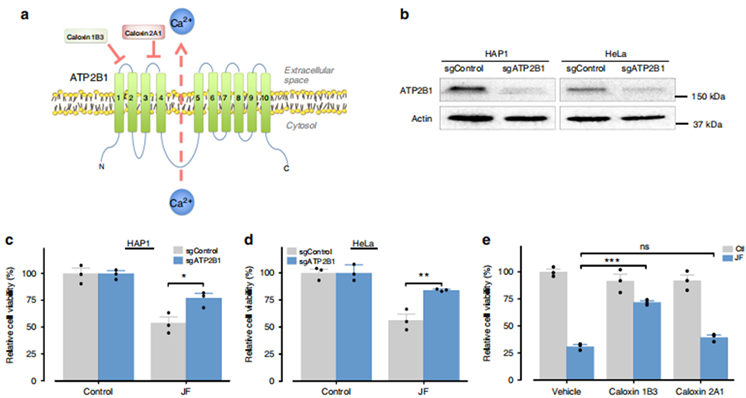 (图片来自参考文献 [27] )
(图片来自参考文献 [27] )
Figure 6. ATP2B1 is involved in jellyfish venom killing. a Schematic representation of ATP2B1. b Western blot validation of sgRNA-mediated depletion of ATP2B1 in HAP1 and HeLa cells. c, d Depletion of ATP2B1 conferring resistance to jellyfish venom in c HAP1 (0.75 µg/ml) and d HeLa cells (1 µg/ml). e Pre-treatment of caloxin 1B3 but not caloxin 2A1 reduces the jellyfish venom-induced cell death
图6. ATP2B1参与了水母毒液的毒化过程:a ATP2B1的示意图;b 在HAP1和HeLa细胞中sgRNA介导的ATP2B1耗竭的Western-blot验证;c,d 减少cHAP1(0.75 µg/mL)和dHeLa细胞(1 µg/mL)中对水母毒液的抵抗力;e 预处理caloxin 1B3而不是caloxin 2A1可以降低水母毒液诱导的细胞死亡
5. 结语
随着我国经济的快速发展和综合国力的提升,建设海洋强国已成为重要的战略部署。开发海洋战略的加速实施,部队海上训练和驻岛守礁的任务日益繁重,长远航已成为海军维护国家海洋权益、彰显维护世界和平责任的常规军事任务;如何确保海上特殊环境下作战人员及其他有生力量的身心健康,减少非战斗减员,既是现代军事航海医学面临的重要课题,也是世界军事医学界研究的热点。水母毒素的成分复杂多样,蜇伤机制尚不能完全明确,人类依然缺乏针对性的药物和规范的治疗方案。即使在科学飞速发展的今天,水母蜇伤的防治依然是人类走向海洋的一种困惑。目前,预防蜇伤和药物治疗相结合仍然是应对水母蜇伤的最有效手段。如何破解水母蜇伤的困扰仍是广大科研工作者在科学研究中面临的主要难题。
基金项目
国家科技重大专项重大新药创制(2018ZX09J18110-001-001)。
NOTES
*第一作者。
#通讯作者。