1. 引言
前篇“帕米卡®制剂抗病毒抗肿瘤作用及瞻望”综述了帕米卡概况、有效性、作用机理及前景 [1],帕米卡是在类似物皮卡(PIKA)基础上发明的升级制剂。皮卡作为佐剂与狂犬病疫苗结合制备的皮卡狂犬病疫苗在新加坡已完成2期临床研究证明安全有效,正在进行多中心3期临床研究 [2] [3]。国内外双链RNA制剂PIC、PICLC、PIC12U、PIKA与Pamica的异同如表1所示,PIC不能用于灵长类以上动物,PICLC有较严重副作用等 [4]。

Table 1. Difference of dsRNA preperations at home and abroad
表1. 国内外双链RNA制剂的区别
本篇实验内容由中国医学科学院药物研究院、辉源生物科技(上海)有限公司与本公司协作完成,通过对肿瘤抑制率、瘤体重量及肿瘤转移、小白鼠脾重、体重、存活数等指标检测本公司研制的帕米卡®制剂在肺癌、乳腺癌、黑色素瘤小白鼠模型中的有效性及安全性。在种类多多、抗原多多,变异多多、个性化情况多多的病毒和恶性肿瘤面前,阐明用具有良好安全性帕米卡这种非特异性免疫促进剂作为广谱并具有显著效果的抗病毒、抗肿瘤治疗的新思路新方法具有重大现实意义。
2. 材料和方法
2.1. 材料
2.1.1. 药物
实验药物:帕米卡(Pamica)双链RNA免疫复合物3 mg/ml,8.0 ml/瓶 批号:P-20170802,淡黄色均相液体,样品密封,避光,冷藏保存,信福(北京)医药科技有限公司制备;阳性对照药:PD1:Biocell公司,货号BE0033-2,批号:662817J3;紫杉醇注射液:批号:17041211,扬子江药业集团有限公司;顺铂:Sigma,货号:P4394-25MG,批号:MKCD 4531;小鼠活体成像底物:厂家:Promega,货号:P1043,批号:0000196128。
2.1.2. 肿瘤细胞株
LL2 (小鼠Lewis肺癌细胞株)购于美国模式菌种收集中心(ATCC, CRL-1642),由辉源生物科技(上海)有限公司保种维持传代;4T1乳腺癌细胞,中国医学科学院药物研究所传代及冻存;B16F10 (小鼠黑色素瘤细胞株)购于中国医学科学院基础医学研究所北京协和医学院细胞资源中心,由中国医学科学院药物研究院高钟镐课题组保种维持传代。
2.1.3. 小白鼠
C57BL/6小鼠,用于LL-2肺癌实验,雌性,7~8周龄,购自上海西普尔–必凯实验动物中心,生产许可证号为:SCXK (沪) 2013-0016,合格证号为2008001681505;BALB/c小鼠,用于4T1乳腺癌,6~8周龄,雌性,体重为18~20 g,购自北京维通利华实验动物技术有限公司,实验动物质量合格证:11400700254120;C57BL/6N小鼠,用于黑色素瘤,雄性,6~8周龄,体重18~20克。购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK (京) 2016-0006,质量合格证编号:NO.11400700343596。
2.2. 方法
2.2.1. LL-2肺癌实验(实验地点:辉源生物科技(上海)有限公司)
首先构建LL2肿瘤移植模型:C57BL/6小鼠经异氟烷麻醉后皮下接种LL2小鼠肺癌细胞1 × 106/0.1 ml,成瘤率为100%;然后各组小白鼠如下处理:顺铂尾静脉注射5 mg/kg,1次/周;帕米卡肌肉注射或鼻腔喷雾150、200 µg/只,1次/隔天,每周3次测量肿瘤体积,称小白鼠体重;实验终点:在给药后的第14天因肿瘤体积超过2000 mm3结束整个实验;观测指标:肿瘤体积:肿瘤体积(TV)的计算公式为:TV = 1/2 × a × b2。其中a和b分别代表肿瘤的长径和短径。瘤重:实验结束后剥取肿瘤组织,记录肿瘤重量;体重:按以下公式计算体重变化率(BWC):BWC = BWn/BW0 × 100%其中BW0为分组给药当天体重,BWn为每次测量时的体重;数据处理及统计学处理:所有数据均以平均值 ± 标准差(SEM)的形式表示,组间比较采用单因素方差分析。
2.2.2. 4T1小鼠原位乳腺癌(实验地点:中国医学科学院药物研究院)
首先构建4T1小鼠原位乳腺癌动物模型:取雌性BALB/c小鼠,选择处于对数生长期的4T1-luc乳腺癌细胞,以1 × 105/0.2ml/只的数量接种于BALB/c小鼠第四乳腺垫下;各组接种后12天分别如下处理:PBS溶液滴鼻给予100 μl/只,每两天给药一次;PD1腹腔注射PD1溶液100 μg/只,每周给药一次;紫杉醇组(PTX)静脉注射PTX溶液10 mg/kg,每周给药一次;Pamica滴鼻组滴鼻给予300 μg/只(100 μL/只),每两天给药一次;Pamica肌注组左后腿肌注给予300 μg/只,每两天给药一次;Pamica与PD1联合给药组滴鼻给予Pamica 300 μg/只,每两天给药一次 + 接种后12天腹腔注射PD1溶液100 μg/只,每周给药一次;Pamica与PTX联合给药组为滴鼻给予Pamica 300 μg/只,每两天给药一次 + 接种后12天静脉注射PTX溶液10 mg/kg,每周给药一次;以游标卡尺动态测量瘤块体积。肿瘤体积计算公式:V = 0.5 × L × D2 (其中,V为肿瘤体积,L为肿瘤长径,D为肿瘤短径)。统计学分析:实验数据均以“均值 ± 标准差”表示,数据分析采用SPSS Statistics 19 (version 4.0.100.1124; SPSS Inc., IBM Company, USA)软件。数据比较采用单因素方差分析ANOVA,组间显著性差异采用t检验,以星号如下表示:*p < 0.05;**p < 0.01;***p < 0.001。
2.2.3. B16F10黑色素瘤(实验地点:中国医学科学院药物研究院)
首先构建B16F10黑色素瘤C57BL/6N小鼠模型:取雄性C57BL/6N小鼠,选择处于对数生长期的B16F10黑色素瘤细胞,以1 × 106/0.1ml/只的数量接种于C57BL/6N小鼠右侧腋下;各组接种后6天分别如下处理:PBS溶液组滴鼻100 μL/只,每两天给药一次;PD1组为接种后6天腹腔注射PD1溶液100 μg/只,每周给药一次;PTX组静脉注射PTX溶液10 mg/kg,每周给药一次;Pamica滴鼻组滴鼻给予300 μg/只,每两天给药一次;Pamica肌注组左后腿肌注给予300 μg/只,每两天给药一次;Pamica与PD1联合给药组滴鼻给予Pamica 300 μg/只,每两天给药一次 + 接种后6天腹腔注射PD1溶液100 μg/只,每周给药一次;Pamica与PTX联合给药组滴鼻给予Pamica 300 μg/只,每两天给药一次 + 接种后6天静脉注射PTX溶液10 mg/kg,每周给药一次,实验终点:在给药后的第10天;统计学分析:实验数据均以“均值 ± 标准差”表示,数据分析采用SPSS Statistics 19 (version 4.0.100.1124; SPSS Inc., IBM Company, USA)软件。数据比较采用单因素方差分析ANOVA,组间显著性差异采用t检验,以星号如下表示:* p < 0.05;** p < 0.01;*** p < 0.001。
3. 实验结果
3.1. 帕米卡对荷LL-2肺癌小白鼠实验模型的体内抗肿瘤效果研究
3.1.1. 各组荷瘤小白鼠在实验终点的肿瘤体积及统计学分析
肿瘤接种后其中一组随即分组给药,剩余组三天后按照肿瘤体积及体重随机分组给药,以三天后分组给药当天为第1天。溶媒对照组肿瘤生长良好,在第14天肿瘤体积达到2201.09 ± 68.01 mm3结束实验。表2结果表明各实验组肿瘤体积与溶媒对照组相比都明显缩小,具有极其显著差异(p < 0.0001),此次实验帕米卡注射组效果优于滴鼻组。

Table 2. Tumor inhibition rate of mice in each treatment group at the end of the experiment
表2. 统计学分析各治疗组在实验终点的肿瘤抑制率
3.1.2. 各组荷瘤小白鼠瘤重
实验结束后,对所有存活动物进行安乐死,并且剥离肿瘤称瘤重及统计学测定,图1结果表明与溶媒对照组相比,各实验组的肿瘤重量明显减小,Pamica 150 μg/鼠,滴鼻(接种后3天给药),肿瘤重量明显减小,具有显著差异(p < 0.05),其余均具有极其显著差异(p < 0.01)。
 Note:*表示与溶媒组相比p < 0.05,**表示与溶媒组相比p < 0.01。
Note:*表示与溶媒组相比p < 0.05,**表示与溶媒组相比p < 0.01。
Figure 1. Tumor weights of lung cancer (LL2 cell) mice (C57BL/6) treated by Pamica
图1. 帕米卡对小鼠肺癌LL2细胞C57BL/6小鼠移植瘤模型瘤重的影响
3.2. 帕米卡对荷4T1-luc小鼠原位乳腺癌模型的体内抗肿瘤效果研究
3.2.1. 各组荷瘤小白鼠肿瘤体积
表3表明在实验过程中各组肿瘤体积排序:Pamica肌注组 < Pamica滴鼻组 < Pamica + PTX组 < PTX组 < PBS组。实验结束时,各组肿瘤体积抑制率分别为:Pamica肌注组51%,Pamica滴鼻组40%,Pamica + PTX组30%,PTX组27%,即Pamica肌注效果好于滴鼻,Pamica + PTX联合给药组效果与PTX组相似,不如Pamica滴鼻组,说明Pamica在此肿瘤模型上肌注组、滴鼻组都优于法定抗癌药PTX组,也说明Pamica与PTX不宜联合给药。

Table 3. t test results of tumor volume of mice bearing breast cancer in each treatment group compared with control group
表3. 各治疗组小白鼠肿瘤体积t检验结果(与溶媒组相比)
Note:误差线表示SD。空白表示无数据,*表示与溶媒组相比p < 0.05,**表示与溶媒组相比p < 0.01,***表示与溶媒组相比p < 0.001。
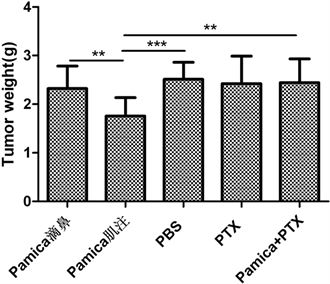
3.2.2. 各组荷瘤小白鼠瘤重
由图2表明帕米卡肌注组对肿瘤体积抑制作用与PBS对照组比较p < 0.001,也强于Pamica滴鼻组,其他组包括PTX组与溶媒组相比均无显著抑制肿瘤生长的作用,再次表明Pamica肌注组优于PTX组。
 Note:误差线表示SD。**表示p < 0.01,***表示p < 0.001。
Note:误差线表示SD。**表示p < 0.01,***表示p < 0.001。
Figure 2. Tumor weights of mice (C57BL/6) bearing 4T1 breast cancer treated by Pamica and paclitaxel (PTX)
图2. 帕米卡和紫杉醇对4T1荷瘤小鼠瘤重的影响
3.2.3. 各组荷瘤小白鼠肺脏转移数
图3可以看出,所有组均出现了白色肿瘤结节,说明所有组均发生了肺转移。其中,PTX组和Pamica肌注组的肺表面结节数与对照组相比显著减少,说明Pamica肌注和PTX阳性对照药能明显抑制4T1乳腺癌细胞的肺转移,而Pamica肌注抑制肺转移的效果好于法定PTX阳性对照药(p < 0.01),这是很重要的提示结果。
 Note:误差线表示SD。*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
Note:误差线表示SD。*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
Figure 3. Number of nodules on long surface of mice (C57BL/6) bearing 4T1 breast cancer treated by Pamica and paclitaxel (PTX)
图3. 帕米卡、紫杉醇对4T1乳腺癌小白鼠肺表面结节数的影响
3.2.4. 各组荷瘤小白鼠脾重
脾脏是机体最大的免疫器官,占全身淋巴组织总量的25%,含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心。由图4可以看出,Pamica肌注组脾重显著高于溶媒组,也显著高于PTX组,具有统计学极其显著差异(p < 0.001),说明肌注组免疫反应较强烈;PTX组的脾重与溶媒组没有差异;而Pamica + PTX组的脾重显著低于溶媒组(p < 0.05),具有统计学差异,说明两者联合用药后,机体的免疫反应受到抑制,从侧面说明了Pamica与PTX不宜联合给药的原因。
 Note:误差线表示SD。*表示p < 0.05,***表示p < 0.001。
Note:误差线表示SD。*表示p < 0.05,***表示p < 0.001。
Figure 4. Spleen weights of mice (C57BL/6) bearing 4T1 breast cancer treated by Pamica and paclitaxel (PTX)
图4. 帕米卡、紫杉醇对4T1荷瘤小鼠脾重的影响
3.2.5. 各组荷瘤小白鼠体重
试验过程中不同天数测定各组小白鼠体重,并做统计学测定。由表4可知,Pamica滴鼻组和Pamica肌注组实验过程中小鼠体重与溶媒对照组小鼠均无显著性差异。

Table 4. t test results of mice weight in each treated groups compared with the control
表4. 各治疗组小鼠与溶媒组小鼠体重t检验统计学结果
Note:误差线表示SD。空白表示无数据,*表示与溶媒组相比p < 0.05,**表示与溶媒组相比p < 0.01,***表示与溶媒组相比p < 0.001。
3.2.6. 小鼠活体成像检测结果
图5为乳腺癌PBS对照组,图6乳腺癌帕米卡治疗组小白鼠活体染色照片,从直观也表明帕米卡治疗组显著抑制了PBS对照组乳腺癌小白鼠的转移,有明显的治疗作用。

Figure 5. Photo of lived dyed PBS control mice (C57BL/6) bearing 4T1 breast cancer
图5. 乳腺癌小白鼠PBS对照组活体染色照片

Figure 6. Photo of lived dyed mice (C57BL/6) bearing 4T1 breast cancer treated by Pamica
图6. 乳腺癌小白鼠帕米卡治疗组活体染色照片
3.3. 帕米卡对荷B16F10黑色素瘤C57BL/6N小鼠模型的体内抗肿瘤效果研究
3.3.1. 肿瘤体积
实验终点时,各组肿瘤体积抑制率分别为:Pamica肌注组45.6%,Pamica + PD1组22.7%,PTX组18.8%,Pamica滴鼻组13.2%,Pamica + PTX组10.2%,PD1组3.1%。
表5可以看出,Pamica肌注组肿瘤抑制能力最强,Pamica滴鼻在此模型上的抑瘤效果与4T1模型相似,即在肿瘤早期表现出显著的抑制率,在肿瘤后期无显著抑制肿瘤生长的作用。在本实验中仍表明Pamica肌注组优于阳性对照药PTX和PD1组,Pamica肌注组无论在肿瘤小和大时都表现出显著的抑制作用而PTX和PD1只能在肿瘤较小时表现出显著的抑制作用。
联合用药问题:Pamica + PD1联合用药与Pamica + PTX联合用药均有一定的抑制肿瘤生长的作用,但效果与单独的Pamica滴鼻相比不明显。提示在此模型上,Pamica滴鼻不宜与PD1或PTX联合用药。

Table 5. t test results of tumor volume of mice bearing 4T1 breast cancer in each groups
表5. 各组乳腺癌小白鼠肿瘤体积t检验结果
Note:误差线表示SD。*表示与PBS组相比p < 0.05,**表示与PBS组相比p < 0.01,***表示与PBS组相比p < 0.001。
3.3.2. 各荷瘤小白鼠瘤重、脾重
实验终点时各组肿瘤瘤重如图7所示,各组肿瘤瘤重抑制率分别为:Pamica肌注组45.6%,Pamica + PTX组34.3%,Pamica滴鼻组19.7%,Pamica + PD1组16.4%,PTX组12.0%,PD1组1.1%。与PBS组相比,Pamica肌注p < 0.001、Pamica滴鼻p < 0.05、Pamica + PTX p < 0.01均能明显抑制肿瘤的增长。
由图8可以看出,与PBS组相比,Pamica + PTX组脾重显著性增大,其余组与PBS组相比均无显著性差异。试验表明Pamica肌注组、滴鼻组对肿瘤重量的抑制率优于法定抗肿瘤药PD1和PTX。
 Note:误差线表示SD。*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
Note:误差线表示SD。*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
Figure 7. Tumor weights of mice (C57BL/6) bearingB16F10 melanoma treated by Pamica, PD1 and paclitaxel (PTX)
图7. 帕米卡、PD1、紫杉醇对B16F10黑色素瘤小鼠瘤重的影响
 Note:误差线表示SD。**表示p < 0.001。
Note:误差线表示SD。**表示p < 0.001。
Figure 8. Spleen weights of mice (C57BL/6) bearing B16F10 breast cancer treated by Pamica, PD1 and paclitaxel (PTX)
图8. 帕米卡、PD1、紫杉醇对B16F10黑色素瘤小鼠脾重的影响
3.3.3. 肺脏表面转移情况
该荷瘤小鼠模型与4T1乳腺癌相比肺转移能力较弱。由表6结果表明紫杉醇组小白鼠2-40处转移,PD1组小白鼠肺表面2处转移,帕米卡滴鼻组及联合PD1、紫杉醇组均有转移,只有帕米卡肌注组小白鼠肺表面无可见转移灶出现,说明帕米卡肌注组抑制B16F10的肺转移能力明显强于相对于其他给药组小白鼠,包括法定抗癌药。

Table 6. Number of metastases on lung surface of mice (C57BL/6) bearing B16F10 melanoma treated by Pamica, PD1 and paclitaxel (PTX)
表6. 帕米卡、PD1和紫杉醇治疗黑色素瘤小白鼠对肺表面肿瘤转移灶数的比较
3.3.4. 荷瘤小白鼠生存情况
表7结果表明除PD1和Pamica肌注组小白鼠没有死亡外,其余5组均有少量小鼠死亡,说明PD1和Pamica肌注的安全性好。

Table 7. Survival number of mice (C57BL/6N) bearing B16F10 melanoma
表7. 荷B16F10黑色素瘤C57BL/6N小鼠生存情况
3.3.5. 各荷瘤小白鼠体重
由表8可知,与PBS组相比,各组荷瘤小鼠体重均无下降趋势,说明此实验模型对各药物耐受性良好。PD1和Pamica肌注组荷瘤小鼠在实验后期体重上升,结合表2小鼠生存情况可以看出,在此实验模型上,相比于其他给药组,PD1和Pamica肌注的毒性较小,安全性高。

Table 8. t test results of mice weight increase in each treatment groups
表8. 各组小鼠体重增加t检验统计学结果
Note:误差线表示SD。*表示与PBS组相比p < 0.05,**表示与PBS组相比p < 0.01,***表示与PBS组相比p < 0.001。
3.4. 讨论
当前治疗癌症的手术、放疗、化疗是“杀敌一千自损八百”的疗法,造成严重副作用,癌症是“内源性疾病”,很难去除或杀死全部癌细胞又会使损害的机体免疫力进一步受损,更降低对癌细胞的主动免疫。分子靶向药物针对的肿瘤细胞常常会发生变异失效,诺华的新药色瑞替尼(Ceritinib)只对3%~5%的肺癌患者有效,因为Ceritinib针对的是突变的ALK基因,而只有3%~5%的肺癌患者才有ALK基因突变,对没有ALK基因突变的肺癌患者,这个药物是完全无效的;癌细胞可以很快产生抗药性,如上Ceritinib在治疗几个月以后就丢弃了突变的ALK基因,而产生新的突变来帮助癌症生长。癌症不是单一疾病,而是几千几万种疾病的组合,“世界上没有完全相同的两片树叶,世界上也没有两个完全相同的癌症”。例如肺癌患者平均每人突变数目接近5000个,每个人突变的组合都不同,每个患者的基因组都是特异的,中国每年这近60万肺癌患者其实更像60万种不同的疾病,这些原因导致癌症至今仍然很难治疗。
帕米卡是TLR3、4等几种胞內受体的配体,通过信号通路传导使自身免疫力提高,杀灭肿瘤细胞治疗肿瘤。在上述小白鼠三种荷瘤模型实验中,帕米卡都能显著降低肿瘤体积、肿瘤重量,提升脾重特别是明显抑制肿瘤转移发生,统计学有效性测定p < 0.05~0.0001,表明帕米卡对荷瘤小白鼠治疗效果极其显著甚至优于化学抗癌药紫杉醇、生物靶向药PD1;滴鼻组效果不如肌注组,但统计学测定p < 0.05~0.0001;对荷瘤小白鼠存活数量与对照组无差别,体重反而有增加,安全性良好。其特点为:
1) 帕米卡是非特异免疫促进剂,本身不含有抗原,对治疗的瘤种没有限制,均有明显效果,具有广谱性。对肺癌、乳腺癌、黑色素瘤体积和重量的缩小均表现出极其显著的效果。在这些荷瘤小白鼠中帕米卡制剂疗效甚至优于PD1著名的抗肿瘤靶向药和传统PTX紫杉醇化疗药,特别指出的是对肿瘤扩散和转移治疗十分困难,90%的肿瘤病人死于肿瘤扩散和转移情况下,帕米卡对4T1乳腺癌小白鼠的转移率低于阳性对照组紫杉醇小白鼠,统计学测定p < 0.01,具有极其显著意义;在黑色素瘤小白鼠肺转移中PD1组2处,紫杉醇组分别发生4~40处转移,而帕米卡肌注组竟没有肺转移发生,这是有重大意义的。
2) 帕米卡是非细胞毒性药物,未发现毒性,没有抗药性,安全性良好,可以反复使用。
3) 帕米卡喷剂用处大:尽管本试验帕米卡滴鼻组小鼠效果不如肌注组,可能由于小白鼠鼻腔狭小,喷入量不足,易伤害造成炎性损伤,表现试验效果早期优于后期,治疗效果统计学测定仍p < 0.05~0.0001。需要特别指出的是小白鼠等非灵长类动物效果好是其血清中有很少的核酸酶降解双链RNA,而帕米卡人用以喷入鼻腔、阴道等粘膜免疫方式给药将具有很大优越性:依从性好、药物直接抵达患处,不经体循环,减少人血清核酸酶破坏,使双链RNA制剂效果更好,RNA药物人体应用的递送方式是成功与否的关键。
4) 关于特异性免疫:帕米卡本身不带抗原成分能否促进荷瘤小白鼠特异性免疫?在荷瘤小白鼠极其显著效果中有没有帕米卡促进特异性免疫的作用,本研究没有直接证据。这个问题留待下一篇“帕米卡作用机理研究”讨论。
与当前抗肿瘤、抗病毒的理念和方法不同,也与其它RNA制剂不同,帕米卡不仅是免疫佐剂,更是免疫促进剂,上述实验结果显现出帕米卡不仅安全性良好,更具有广谱并显著抑制荷瘤小白鼠肿瘤体积、重量和肿瘤转移等特点,效果甚至优于PD1、PTX传统抗癌药是令人吃惊的,有可能以提高机体整体免疫力疗法这一新角度开启严重威胁人体生命和社会的抗病毒抗肿瘤治疗革命大门。国际已有少量文献报道了这种有关抗癌新方法新理念 [5] [6],值得引起关注。
帕米卡在1~5小时就能促进机体产生多种细胞因子,但通常次日就检测不出 [1],这一特点一方面表明有效又不易产生过度免疫如细胞因子风暴等副作用,但另一方面需要隔日连续使用。本研究推崇帕米卡注射剂喷剂也推崇帕米卡粘膜免疫喷剂,正按照国家药监局要求开展临床前研究,通过临床实践确认其临床级别的安全性和有效性。
参考文献