1. 引言
D-二聚体是纤维蛋白的特异降解产物,其浓度增高与体内各种原因引起的血栓性疾病高度相关,同时也说明了纤溶活性增强。D-二聚体检测对于静脉血栓栓塞症(Venous thromboembolism, VTE)的诊断具有极为重要的意义 [1],但是,在许多非血栓形成疾病中,血浆D-二聚体水平也会明显升高,某些情况下诸如妊娠、充血性心力衰竭、肝脏疾病、肾病综合征及肾功能衰竭等。
血浆D-二聚体水平升高同样见于多种呼吸系统疾病,如:社区获得性肺炎(Community acquired pneumonia, CAP) [2],结核性胸腔积液 [3],慢性阻塞性肺疾病(Chronic obstructive pulmonary disease, COPD) [4] 以及肺癌 [5] 等。D-二聚体水平正常基本可排除VTE的诊断,但其升高在鉴别VTE与其他呼吸系统疾病的意义有限。但是,血浆D-二聚体水平在不同呼吸系统非血栓性疾病的表达水平并不清楚。
本研究的目的是通过比较VTE与不同非血栓性呼吸系统疾病的血浆D-二聚体水平,评价其在相应疾病与VTE相鉴别及在不同呼吸系统疾病诊断中的应用价值。
2. 研究对象和方法
2019年4月至6月研究期间共连续收治了484名肺病患者。我们排除了接受抗凝治疗或有肺外肿瘤,缺血性神经疾病、缺血性心脏病、外周动脉疾病、充血性心力衰竭、严重肝肾疾病、炎症性肠病、慢性血栓栓塞性肺动脉高压,弥漫性血管内凝血,妊娠以及急性出血的患者,同时排除诊断不清的患者。26例急性VTE患者作为阳性对照组(图1)。
 CTEPH = 慢性血栓栓塞性肺动脉高压;COPD = 慢性阻塞性肺疾病;CAP = 社区获得性肺炎;VTE = 静脉血栓栓塞症
CTEPH = 慢性血栓栓塞性肺动脉高压;COPD = 慢性阻塞性肺疾病;CAP = 社区获得性肺炎;VTE = 静脉血栓栓塞症
Figure 1. Experiment design
图1. 实验设计
本研究共包括365名患者,其中339名非VTE患者的诊断包括COPD急性加重(87例,25.7%);间质性肺疾病(Interstitial lung disease, ILD) (59例,17.4%);支气管扩张(26例,7.7%);哮喘(29例,8.6%);67例CAP (19.8%),其中伴有胸腔积液的患者13例;50例肺癌患者(14.7%),其中伴有恶性胸腔积液(Malignance pleural effusion, MPE) 12例;9例患者(6.2%)合并急性肺结核(Tuberculosis, TB),结核性胸腔积液患者12例(Tuberculous pleural effusion, TPE) (如图1所示)。26例急性VTE患者作为阳性对照组,VTE的诊断主要依据为CT肺血管造影、肺通气灌注扫描以及超声检查。患者年龄为62.2 ± 16.0岁,男女比例为1:55。
D-二聚体测定法:
常规的实验室检查在入院当天进行。血浆D-二聚体水平采用酶联免疫吸附试验(ELISA) (VIDAS®D-Dimer Exclusion™, BioMérieux SA, 法国)。D-二聚体的正常值为500 ng/ml。
3. 统计学分析
采用SPSS17.0统计学软件,结果用均数 ± 标准差(x ± s)表示,应用t检验,p < 0.05为有统计学差异。通过Wilcoxon检验对自变量进行数据分析,并且用受试者工作特征曲线(ROC)评估D-二聚体区分TPE和MPE的临界值。诊断临界值为特异性和灵敏度的最大值。
4. 结果
1) VTE组患者的血浆D-二聚体水平显著高于非血栓组患者
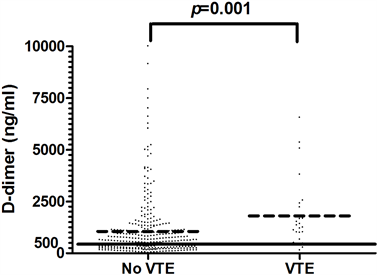
VTE组与非血栓组患者的血浆D-二聚体水平均高于正常上限,VTE组患者血浆D-二聚体水平(1800.3 ± 1686.8 ng/ml)明显高于非血栓组患者血浆D-二聚体水平(1050.3 ± 1425.4 ng/ml) (p = 0.001) (如图2所示)。男性患者(1017.9 ± 1285.0 ng/ml)与女性患者(1237.2 ± 1688.3 ng/ml)的血浆D-二聚体水平无显著性差异(如图3所示)。
2) 不同的非血栓呼吸系统疾病患者血浆D-二聚体水平比较
非血栓性呼吸系统疾病患者血浆D-二聚体水平均高于相应参考值(如表1所示)。其中肺癌,社区获得性肺炎,间质性肺病以及肺结核患者血浆D-二聚体升高水平与VTE患者无明显差异。慢性阻塞性肺疾病、支气管哮喘和支气管扩张患者血浆D-二聚体升高水平有限,与VTE患者具有显著差异(如图4所示)。
 VTE = 静脉血栓栓塞症
VTE = 静脉血栓栓塞症
Figure 2. Comparison of plasma D-dimer levels between non-VTE patients and VTE patients (Mean ± SD)
图2. 非VTE患者与VTE患者血浆D-二聚体水平对照(Mean ± SD)
 Male = 男性;Female = 女性
Male = 男性;Female = 女性
Figure 3. Plasma D-dimer levels of different genders
图3. 不同性别的血浆D-二聚体水平
 COPD = 慢性阻塞性肺疾病;Lung Cancer = 肺癌;Pneumonia = 肺炎;Interstitial Pneumonia = 间质性肺疾病;Tuberculosis = 肺结核;Asthma = 支气管哮喘;Bronchiectasis = 支气管扩张;PVT = 血栓形成
COPD = 慢性阻塞性肺疾病;Lung Cancer = 肺癌;Pneumonia = 肺炎;Interstitial Pneumonia = 间质性肺疾病;Tuberculosis = 肺结核;Asthma = 支气管哮喘;Bronchiectasis = 支气管扩张;PVT = 血栓形成
Figure 4. Plasma D-dimer levels in different lung diseases (Mean ± SD)
图4. 不同肺部疾病的血浆D-二聚体水平(Mean ± SD)


Table 1. Plasma D-dimer concentration of different lung diseases
表1. 不同肺部疾病的血浆D-二聚体浓度(Mean ± SD)
CTEPH = 慢性血栓栓塞性肺动脉高压;COPD = 慢性阻塞性肺疾病;CAP = 社区获得性肺炎;ILDs = 间质性肺病;VTE = 静脉血栓栓塞症。
3) 伴有与不伴有胸腔积液患者的血浆D-二聚体水平比较
将肺炎、肺结核和肺癌患者按照是否伴有胸腔积液分为胸腔积液组和无胸腔积液组。伴有胸腔积液的患者血浆D-二聚体水平(2085.7 ± 1707.4ng/ml)相比于无胸腔积液患者(1041.1 ± 1230.8 ng/ml),出现了显著性升高(p < 0.01) (如表2所示),其中TPE患者的血浆D-二聚体水平甚至明显高于VTE患者(如图5所示)。
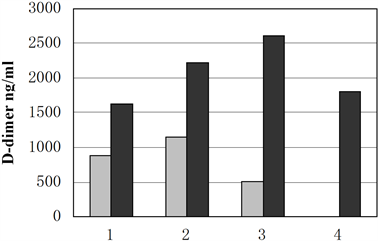 1. 肺癌 灰色:无胸腔积液 黑色:伴有胸腔积液;2. 肺炎 灰色:无胸腔积液 黑色:伴有胸腔积液;3. 结核 灰色:无胸腔积液 黑色:伴有胸腔积液;4. VTE
1. 肺癌 灰色:无胸腔积液 黑色:伴有胸腔积液;2. 肺炎 灰色:无胸腔积液 黑色:伴有胸腔积液;3. 结核 灰色:无胸腔积液 黑色:伴有胸腔积液;4. VTE
Figure 5. The effect of pleural effusion on plasma D-dimer levels in patients with pneumonia, lung cancer and tuberculosis (Mean ± SD)
图5. 胸腔积液对肺炎,肺癌以及肺结核患者血浆D-二聚体水平的影响(Mean ± SD)

Table 2. The presence or absence of pleural effusion affects the levels of plasma D-dimer in patients with pneumonia, lung cancer and tuberculosis (Mean ± SD)
表2. 胸腔积液的存在与否对肺炎,肺癌以及肺结核患者血浆D-二聚体的水平(Mean ± SD)
CAP = 社区获得性肺炎;VTE = 静脉血栓栓塞症。
4) 不同病因的胸腔积液患者的血浆D-二聚体水平比较
血浆D-二聚体的曲线下面积作为区别TPE和MPE的鉴别诊断指标。临界值为1720 ng/ml,灵敏度为69.2%,特异性为83.3%。AUC值为0.796 (95%置信区间:0.571~968) (如图6所示)。
 曲线下面积为0.769
曲线下面积为0.769
Figure 6. The area under the curve of plasma D-dimer as a differential diagnostic index to distinguish TPE from MPE
图6. 血浆D-二聚体的曲线下面积作为区别TPE和MPE的鉴别诊断指标
5. 讨论
本研究表明,肺病患者体内不论是否存在静脉栓塞,血浆D-二聚体水平均有可能升高。仅通过单一的D-二聚体浓度升高难以将VTE与其他肺病区分开,特别是肺癌,社区获得性肺炎,间质性肺病以及肺结核。伴有胸腔积液的患者血浆D-二聚体浓度明显高于无胸腔积液的患者。对于胸腔积液患者,在鉴别TPE和MPE时,血浆D-二聚体水平可作为参考,当其检测指标超过1720 ng/ml更倾向于诊断TPE。
研究发现血浆D-二聚体水平会在几种肺部疾病中升高,数值的升高反映了凝血和纤维蛋白溶解系统的激活。当前对于呼吸道疾病中D-二聚体水平的研究大多数都集中在COPD患者身上,研究发现合并肺栓塞的COPD急性加重期患者和不合并肺栓塞的COPD急性加重期患者的D-二聚体水平均升高了77% [6]。凝血通路的激活可能伴随着肺功能下降。COPD患者血清CRP与D-二聚体呈正相关,与肺功能呈反相关,该病显著表现出全身炎症反应 [7],但是缺氧对D-二聚体的升高无影响 [8]。
当凝血和纤维蛋白溶解指数开始变化(小鼠模型2周)时,在早期预防性使用低分子量肝素对缓解血栓前状态,缓解缺氧和改善COPD患者预后具有临床意义 [9]。稳定期COPD的D-二聚体值与对照组相比无差别。本研究发现D-二聚体水平不仅在COPD中升高,而且在哮喘和支气管扩张中也会升高,但其升高程度远低于VTE患者。
特发性肺纤维化(IPF)患者(主要是IPF急性加重期患者)的D-二聚体水平显著升高 [10] [11] [12]。研究认为血浆D-二聚体水平与IPF急性加重期患者的死亡率相关,所以抗凝治疗对IPF患者的生存有益 [13],但对于该结果仍存有争议。损伤后的组织修复过程中会产生炎症反应。已经证明炎症细胞因子在凝血和纤维蛋白溶解系统中起重要作用,该过程又会反过来影响炎症进程。血浆D-二聚体可作为炎症标志物,并且在ILD中具有预后价值 [12]。血浆D-二聚体水平升高与CAP和肺癌的病情严重程度和死亡率相关 [14] [15]。我们发现ILD,CAP,肺癌和VTE之间的D-二聚体水平无显著性差异。
炎症与凝血的关系对胸腔积液的病理生理发展至关重要。组织损伤后,凝血酶开始直接作用于纤维蛋白原,并产生纤维蛋白。为了维持生理平衡,抗凝血酶附着于新形成的纤维蛋白上并阻断凝血酶的活性。体内纤维蛋白的形成受纤维蛋白溶解系统控制。一旦形成纤维蛋白,就会伴随继发性纤维蛋白溶解系统的激活,并且将观察到D-二聚体水平的升高。研究发现结核性胸腔积液的D-二聚体水平比其他类型的胸腔积液水平高 [16],本研究的对照组不仅包括恶性胸腔积液和旁肺炎胸腔积液,还包括心力衰竭引起的胸腔积液,它们可能都是渗出液,所以其D-二聚体比对照组的平均水平低很多。我们的研究发现血浆D-二聚体在渗出液中显著升高,尤其是在TPE中。D-二聚体水平升高 > 1720 ng/ml可能有助于TPE的诊断,但对MPE的诊断无帮助。
我们的研究尚存不足之处。首先,本研究是观察性研究,我们没有探讨关于凝血和纤维蛋白溶解系统的其他数据。其次,我们没有进一步研究关于这些疾病是如何影响纤维蛋白溶解系统的具体机制。我们需进一步研究具体的机制来验证我们的发现。
6. 结论
总之,在这项研究中,我们发现大多数肺病住院患者的血浆D-二聚体水平升高,尤其是在CAP,肺癌,ILD和TB中。与非胸腔积液患者相比,CAP和TB患者血浆D-二聚体升高程度显著增加。血浆D-二聚体可作为TPE区别于MPE的鉴别诊断指标。