摘要: 肺癌目前仍然是全球死亡人数最多的恶性肿瘤,总体的5年生存率不到20%。非小细胞肺癌(non-small cell lung cancer, NSCLC)大约占到肺癌的85%~90%,大部分患者在病情进展到晚期时才确诊,而且非所有肺癌患者有靶向和免疫治疗的机会。本案例报道了一例晚期EGFR、ALK基因突变阴性重症肺腺癌患者先后通过化疗、免疫治疗、靶向治疗及放疗多线治疗获得至少3.4年的总生存期。
Abstract:
Lung cancer is the leading cause of cancer death currently in the world, of which the 5-year survival rate is about 20%. Non-small cell lung cancer (NSCLC) accounts for about 85%~90% of lung carcinoma, and most patients are diagnosed at advanced stages, while not all patients have opportunities for targeting therapy and immunotherapy. This case report describes a patient who had advanced severe lung adenocarcinoma with negative EGFR and ALK mutation, and he has achieved an overall survival of at least 3.4 years with multiple-line therapies including chemotherapy, immunotherapy, targeted therapy and radiotherapy.
1. 引言
肺腺癌(lung adenocarcinoma, LAC)严重威胁着人类生命健康,靶向和免疫治疗时代的到来为晚期肺腺癌患者的长生存增加了希望。靶向治疗针对常见的EGFR和ALK等基因突变的患者,常见基因突变概率约为50%~60% [1];我国多中心的、真实世界的、最大规模的研究表明程序性死亡因子(programmed death-ligand 1, PD-L1)阴性约占57% [2],换言之,在中国每年新发220.1万的肺癌患者中仍有接近几十万的患者只能选择其他治疗方案 [3]。大多数LAC患者在诊断时已经失去了手术的机会,如何有效综合治疗获得最长生存期是极为重要的。本案例报道了一例晚期EGFR、ALK基因突变阴性重症肺腺癌患者如何获得至少3.4年的总生存期案例。
2. 病例资料
患者王某,男,56岁,因“咳嗽、胸闷1月,加重伴晕厥1天”于2017-10-15入院。入院前3天外院胸部CT示:右肺占位并左肺、纵膈淋巴结转移,胸腔积液、大量心包积液,双肺炎症;考虑心包填塞,于外院行心包穿刺引流术,术后患者胸闷、憋气略有减轻,未继续诊治。入我院当天因“气短加重伴晕厥1天”就诊于我院急诊神经内科,急诊除外脑血管病变后考虑心包填塞,再行心包穿刺置管引流,患者胸闷症状缓解后转入我科。既往无基础疾病,吸烟史40年,平均20支/日,父亲因肺癌去世。入院查体:T 36.5℃,P 112次/分,R 25次/分,BP 142/83 mmHg,PS评分2~3分。神志清,精神欠佳,双侧颈部可触及肿大淋巴结,较大者有黄豆大小,无触痛,活动度差,双肺呼吸音低,可闻及散在干湿性啰音。心率112次/分,心音低钝,律齐,下肢水肿。入院后胸腔超声提示双侧胸腔积液(图1(A)、图1(B)),予以胸腔穿刺置管引流,同时行胸膜、胸水常规和病理检查,涂片内发现恶性肿瘤细胞(考虑腺癌);左侧锁骨上淋巴结活检提示:符合转移性腺癌,淋巴结病理ARMS-PCR:EGFR-,ALK-,ROS1-。
根据患者病例资料诊断右肺腺癌(cT4N3M1a,IV期),于2017-10-18至2018-05-08予以培美曲塞 +奈达铂 + 安维汀行一线化疗,病情评估为SD (图2(A))。2018-07-27患者胸部CT提示缓慢进展(图2(B)),癌胚抗原(Carcinoembryonic antigen, CEA)水平升高(图4),二次活检不成功,行血液NGS-21基因检测,结果为阴性,患者无恶性肿瘤的临床表现,继续予以安维汀 + 培美曲塞7周期化疗。2019-02-11入院病情持续进展,患者胸闷气短症状明显,胸部CT提示病灶扩大(图2(C)),颅脑磁共振及骨扫描提示出现脑转移及骨转移(图3),考虑病情进展,给予帕博利珠单抗免疫治疗联合紫杉醇作为二线治疗方案,症状明显减轻,CEA大幅下降(图4),4周期联合治疗后综合评估治疗效果为PR,随后改为单药免疫维持治疗。2019-10-09复查提示肿瘤标志物CEA升高(图4),加用血管靶向安罗替尼联合免疫作为三线治疗方案;2020-06-30患者病情再度出现进展(图2(D)),紫杉醇联合30次放疗作为四线治疗方案。后患者规律门诊随访,病情未见明显变化(图2(E)),2021-03-23患者出现胸闷气短症状进行性加重,胸部CT较前未见明显增大(图2(F)),消化系统超声提示肺癌肝转移,甲状腺淋巴结明显转移(图1(C)、图1(D)),CEA明显升高(图4),电子气管镜活检病理示中分化腺癌,基因检测结果未出。具体诊疗过程如下(图5)。

Figure 1. Ultrasound examination image (A) Left pleural effusion; (B) Right pleural effusion; (C) Neck lymph node metastasis; (D) Liver metastasis
图1. 超声检查图像(A) 左侧胸腔积液;(B) 右侧胸腔积液;(C) 颈部淋巴结转移;(D) 肝转移
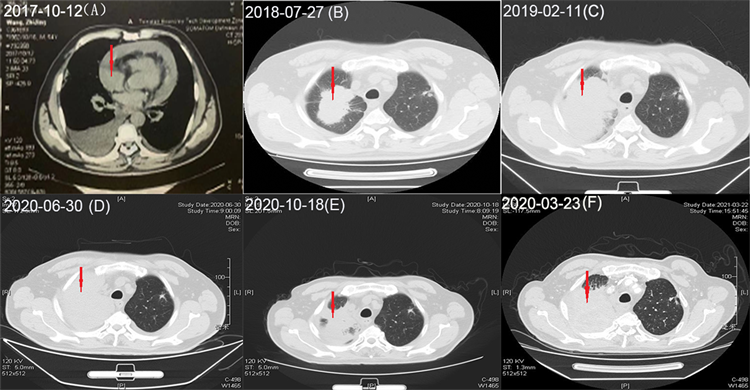
Figure 2. Chest CT (A) Left and right atrioventricular plane (mediastinal window); (B)-(F) Superior aortic arch plane (pulmonary window)
图2. 胸部CT (A) 左右房室层面(纵膈窗);(B)-(F) 主动脉弓上层面(肺窗)

Figure 3. Craniocerebral MRI and ECT (A) Upper ventricle plane of craniocerebral MRI; (B) (C) Cranial base plane of craniocerebral MRI; (D) ECT
图3. 颅脑MRI及ECT (A) 颅脑MRI脑室上部层面;(B) (C) 颅脑MRI颅底层面;(D) 全身骨显像
3. 讨论
本案例中患者一线治疗获得了16个月的无疾病进展生存期(median progression-free survival, mPFS),BEYOND研究表明在NSCLC患者中,单独接受化疗的患者中位mPFS为6.5个月,安维汀联合化疗的患者的mPFS为9.2个月,联合治疗延长了2.7个月 [4],在免疫治疗兴起的时代,安维汀与化疗的联合mPFS仍高于Keynote-189研究中的时间(9.2个月VS 8.8个月),虽然均可以作为晚期肺腺癌的一线治疗方案,但是安维汀联合化疗方案是针对我国NSCLC患者的研究结果,对于晚期基因突变阴性的肺腺癌患者,一线的治疗选择仍考虑化疗+安维汀,另外考虑到经济因素的原因,免疫治疗的费用远远高于使用安维汀治疗。虽然免疫治疗已经深入人心,但抗血管生成联合治疗模式依旧不可轻视。
免疫治疗的效果和PD-L1的表达水平是密切相关的 [5],本案例中,患者的PD-L1的表达水平未知,而考虑到化疗的起效时间是优于免疫治疗的,化疗药物可以抑制肿瘤微血管的无限增殖,改善缺氧的微环境,减少促进新生血管形成因子的释放 [6];同时诱导肿瘤细胞的免疫发生改变,程序性死亡因子1 (programmed death 1, PD-1)的表达增加 [7],协同免疫治疗效果的发挥 [8]。根据KEYNOTE-010研究,免疫疗法二线的单药治疗需要筛选PD-L1 ≥ 1%的患者,由于二次肺穿刺活检结果阴性,无法获得标本未做相关检测。另外考虑患者全身情况尚好,肿瘤负荷较大及免疫药物的延迟起效,二线选择免疫联合化疗 [9]。IMPower130研究表明一线免疫联合化疗的非鳞NSCLC的患者mPFS为7.0个月,本案例中患者获得了6.4个月的PFS,已经可以媲美晚期肺癌免疫联合化疗的一线治疗生存时间 [10]。对于EGFR及ALK基因均为野生型的非鳞NSCLC患者,二线采用免疫联合化疗应该是获益的,这一点需要大规模的多中心、开放标签的及随机临床研究来验证。
本案例患者的跨线治疗获益显著。跨线治疗,即在治疗进展后,更换上一线联合治疗中的其中一种治疗,保留让患者继续获益的药物进入下一阶段的治疗。本案例中二线采取免疫联合化疗的方案中的免疫治疗一直保留到三线的治疗中,研究表明贝伐珠单抗联合化疗治疗晚期非鳞NSCLC患者是明确获益的,血管靶向联合化疗可以进展跨线治疗,系列研究表明接受过免疫治疗的患者后续可获益 [11],这些在后线的跨线治疗是否能让患者一定获益,这值得进一步探索研究。
安罗替尼是新型多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI),能有效抑制血管内皮生长因子受体、血小板衍生生长因子受体、以及成纤维生长因子受体的激活。ALTER 0303研究表明安罗替尼用于晚期NSCLC的三线治疗,最长可获得5.37个月的mPFS,考虑该患者接受安罗替尼前有过爆发性进展,即出现骨及脑的转移,肿瘤负荷增加可能与此有关 [12]。患者三线免疫联合血管靶向安罗替尼的治疗后再进展,考虑行放疗,由于免疫治疗的“长拖尾”效应,考虑此时加用放化疗会增加肺损伤的发生率,PACIFIC III期研究显示同步放化疗联合免疫治疗的肺损伤发生率为3.6%,这一点不容忽视,因此予以化疗后再进行放疗,使患者最大获益的同时降低风险发生比率 [13]。
最后,本案例中患者本次入院后出现肿瘤病灶的增大以及CEA的升高,提示再次进展,考虑患者既往免疫治疗的获益情况,而且患者目前PS评分0~1分,基础状况良好,尝试对免疫治疗的再挑战结果如何,这应该是一个让人值得期待的结果。晚期EGFR、ALK基因突变阴性重症肺腺癌的长生存得益于准确的评估和规范的诊疗,晚期肺癌的后线治疗需要根据患者的基本情况、对治疗方案的耐受程度以及依从性综合考虑,制定个体化的诊疗方案,方可在治疗副作用最小和获益最大之间取得平衡。
NOTES
*通讯作者。