1. 引言
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是临床上常见的与代谢功能障碍相关的肝脏疾病,全球患病率高达25% [1]。有研究报道,从2016年至2030年,中国NAFLD人口预计将增长29.1%,达到3.458亿;同时,继发于NAFLD的失代偿性肝硬化和肝脏相关死亡也将增加一倍以上 [2]。此外,因NAFLD与代谢紊乱相关,且参与2型糖尿病和动脉粥样硬化的发病,是心脑血管疾病及代谢综合征相关恶性肿瘤的危险因素之一,故面对发病率的攀升和疾病危害的增加,于2020年将NAFLD重新定义并更名为代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)。
目前,MAFLD已替代病毒性肝炎,成为全球发病率最高的慢性肝病 [3],MAFLD前期肝脏脂肪积聚虽然可逆,但常因其无临床症状而被忽略。发现时多已进入肝脏炎性病变期,而脂肪性肝炎(NASH)又可进一步发展为脂肪性肝纤维化、肝硬化及肝癌,一旦进展到肝硬化,则为不可逆病变,可出现腹水、上消化道出血、肝性脑病、感染、肝肾综合征等系列并发症,严重危害生命健康。针对肝脏脂肪积聚,现代医学尚无FDA批准的有效治疗药物,仅以改变生活方式、减轻体重或控制并发症为主要手段。存在治疗个体差异大、远期疗效差、难以规范实施等问题。中医将MAFLD归属“肝癖”、“肥气”、“积聚”等范畴,中医药防治本病具有明显的优势与特色。
苓荷颗粒是已故全国名老中医康良石教授临床治疗MAFLD的有效经验方 [4],由茯苓、净山楂、荷叶、佛手、决明子、丹参、陈皮、玉米须八味药组成,临床疗效显著 [5]。但因缺少作用靶点、效应机制的深入研究,制约了其疗效的发挥和推广应用。基于此,本研究运用网络药理学和加权基因共表达网络算法,对苓荷颗粒的效应机制、药效物质基础和作用靶标进行了初步探索,以期为苓荷颗粒治疗MAFLD提供数据支撑与临床指导。
2. 材料与方法
2.1. 苓荷颗粒化学活性成分检索和筛选
以各单味药的标准中药名称或拉丁文为检索词,通过TCMSP和TCMID等数据库检索苓荷颗粒组成药物的全部化学成分,构建苓荷颗粒成分数据集。参考口服利用度(Oral bioavailability, OB)和药物相似性(drug-likeness,DL)进行筛选。选取同时满足OB ≥ 30%,DL ≥ 0.18的成分作为潜在的活性成分,构建苓荷颗粒活性成分数据库。检索数据库:TCMID (http://www.megabionet.org/tcmid/);TCMSP (https://tcmspw.com/tcmsp.php);TCM-PTD (http://tcm.zju.edu.cn/ptd/);NSTI (http://www.ncmi.cn/);SymMap (http://www.symmap.org/)。
2.2. MAFLD 疾病靶点的预测
通过数据库搜索关键词“Nonalcoholic fatty liverdisease”或“Non-alcoholic fatty liverdisease”,查找与MAFLD相关的基因,合并相关数据库,去除重复基因,获得MAFLD疾病–靶点。检索数据库:Gene Cards (https://www.genecards.org/);OMIM (http://www.omim.org/)。
2.3. 构建蛋白相互作用网络并计算网络拓扑参数
将相关基因导入STRING 在线数据库(https://string-db.org),设定Organism为“Homo sapiens”,隐藏与关键节点网络无连接的节点,得到蛋白相互作用网络(Protein-Protein Interaction, PPI)。将导出的网络节点关联数据导入Cytoscape 3.8.2软件,计算网络拓扑参数degree,closeness centrality,clustering coefficient,topological coefficient和betweenness centrality,筛选关键基因。并构建药物–靶点–疾病网络。
2.4. WGCNA分析MAFLD相关潜在靶点基因
GEO下载MAFLD相关数据GSE135251,用于加权基因共表达网络分析(Weighted correlation network analysis, WGCNA),探寻与MAFLD发生发展相关的潜在靶点基因。此数据集包括216例不同肝纤维化阶段的MAFLD患者和10例正常人的冷冻肝活检样本的高通量RNA测序数据 [6]。利用R语言的Deseq2包筛选差异基因,利用WGCNA包,构建MALFD加权共表达网络 [7]。
为了使构建的网络接近真实生物网络状态的无尺度网络,首先,使用Soft Threshold选择合适的软阈值参数β。然后根据所确定的软阈值,转变邻接矩阵成为0~1之间的连续值,再以基因间皮尔逊相关系数构建邻接矩阵,转换为拓扑矩阵,基于拓扑重叠矩阵的差异性度量识别构建模块。临床指标包括MAFLD的疾病与否(Disease/Normal)、严重程度(control = 0, early = 1, moderate = 2)、活动度积分(NAFLD activity score, NAS = 0~8),以及肝纤维化分期(Fibrosisstage: F0~F4)。以最小尺寸20为分割的基因树状图,建立平均连锁层次聚类,将上述临床信息与表达模式与其相类似的基因划分为一个模块,筛选最优模块。
2.5. 核心靶点生物功能注释分析
利用R语言clusterProfiler包进行靶点基因的功能注释及通路分析。基于Gene Ontology数据库(http://www.geneontology.org)对基因进行GO注释,基于KEGG数据库(http://www.genome.jp/keg/)对差异基因进行pathway注释。利用Fisher精确检验和卡方检验,以P < 0.05及FDR < 0.05,|fold change| > 2为标准,计算每个GO的显著性水平和误判率,筛选出目标基因富集的显著性GO。并分析目的基因参与的pathway,获得目标基因富集的显著性pathway。
2.6. 统计学分析
进行差异基因表达分析,方差齐的多样本间进行单因素方差分析(one-way ANOVA),P < 0.05为差异具有统计学意义。
3. 结果
3.1. 苓荷颗粒潜在活性成分筛选
苓荷颗粒中8味药的成分共有8137个,共筛选到潜在活性成分134个。包括茯苓15个;陈皮5个;荷叶15个;玉米须12个;佛手5个;丹参65个;决明子14个;山楂3个(表1)。


Table 1. Active ingredients of 8 herbs in Linghe granules (only 3 active ingredients are listed for each herb)
表1. 苓荷颗粒中8味药活性成分(每味药只列出3个活性成分)
3.2. 苓荷颗粒–靶点构建
基于TCMID数据库中现存所有的中药成分–靶点数据信息,输入前述134个苓荷颗粒潜在活性成分,寻找苓荷颗粒–靶点。共获得258个潜在靶点基因(图1)。
3.3. MAFLD疾病靶点的预测
OMIM共检索获得MAFLD的238个靶点基因;Genecards共检索获得MAFLD的847个靶点基因;去除重复的,共获得1029个MAFLD的靶点基因。
3.4. 苓荷颗粒作用靶点与MAFLD相互作用网络
将获得的258个苓荷颗粒作用靶点与1029个MAFLD疾病靶点共同输入STRING数据库,构建药物作用靶点–疾病靶点PPI网络。本实验中:degree = 37,closeness = 0.425256,clustering coefficient = 0.403129,topological coefficient = 0.145755 和betweenness = 0.000416。选取同时满足上述三个阈值的节点作为此网络的关键节点,共77个(表2)。
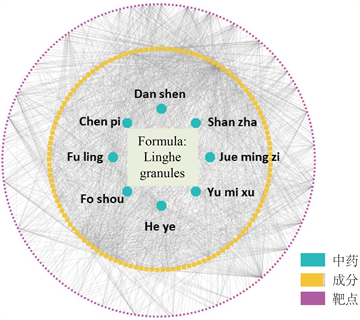
Figure 1. Composition-target network of Linghe granules (134 potential active components and 258 potential target genes)
图1. 苓荷颗粒成分–靶点网络图(134个潜在活性成分及258个潜在靶点基因)
3.5. 中药–成分–直接靶点–间接靶点-pathway网络构建
将苓荷颗粒258个潜在靶点基因与77个关键靶点基因进行交集,得到的交集中的28个基因视为直接靶点基因。其余49个基因为间接靶点基因(图2)。

Figure 2. Intersection analysis of 258 potential target genes and 77 key target genes of Linghe granules
图2. 苓荷颗粒258个潜在靶点基因与77个关键靶点基因交集分析
进一步将此中药–成分–靶点网络与2.4中苓荷颗粒作用靶点与MAFLD相互作用网络整合,获得中药–成分–直接靶点–间接靶点–pathway整体网络,包括36个潜在活性成分,28个直接靶点,49个间接靶点及部分关键基因通路(图3)。

Figure 3. Pathway network-traditional Chinese medicine composition-direct targets-indirect targets
图3. 中药–成分–直接靶点–间接靶点-pathway网络
对77个关键靶点基因进行生物功能注释,分析GO下的分子功能BP和KEGG pathway。发现77个关键靶点基因涉及TNF信号通路,MAPK信号通路,非酒精性肝病等通路(前15个term) (图4)。

Figure 4. Functional analysis of GO and KEGG pathway of 77 key target genes
图4. 77个关键靶点基因的GO和KEGG pathway功能分析
3.6. WGCNA分析MAFLD相关潜在靶点基因
运用GEO下载的MAFLD数据集进行差异基因分析,找到差异基因2796个。将上述差异基因进行WGCNA分析。为使构建的网络更符合无标度网络的特性,软阈值设置为4 (图5(a))。基于加权算法进行层次聚类分析,根据设定的软阈值和临床指标聚类结果进行分割,得到不同的基因模块(图5(b)~(d))。根据软阈值 = 4,模块内基因数n ≥ 20,模块切割高度0.25的标准化,确定14个模块。这14个模块与MAFLD的疾病与否、严重程度活动度积分及肝纤维化分期相关性见图5(c)。greenyellow,salmon,blue和brown前四个模块(图5(c)绿色框)和MAFLD的疾病发展显著相关性(P < 0.0001)。将这四个模块中的1213个基因和77个关键基因相对比,发现GGT1,E2F1,LMNA,CDKN1A和IGFBP15个重复出现的基因。因此,推测这5个基因可能参与MAFLD的发生发展,并且有可能成为苓荷颗粒治疗MAFLD的潜在靶点,从而选择它们进行下一步研究。
 (a)
(a) 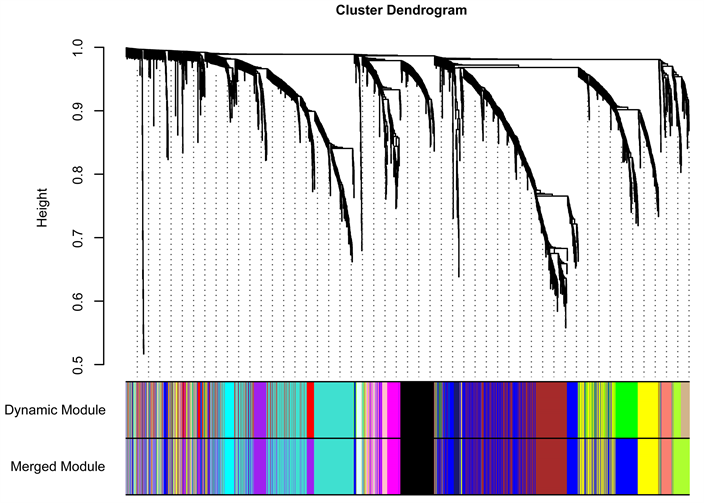 (b)
(b)  (c)
(c) 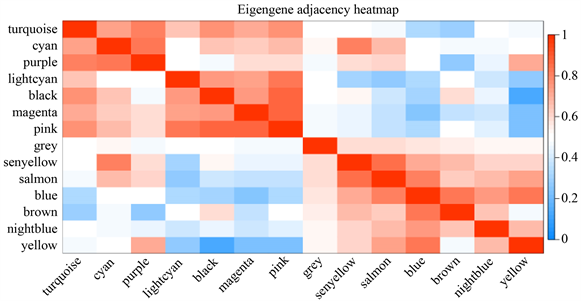 (d)
(d)
Figure 5. WGCNA analysis. (a) Scale independence and average connectivity analysis in WGCNA analysis; (b) Cluster tree diagram; (c) The correlation between 14 gene modules and clinical characteristic values was analyzed by thermogram; (d) Correlation heat map of different modules
图5. WGCNA分析。(a) WGCNA分析中的尺度独立性和平均连通性分析;(b) 聚类树状图;(c) 14个基因模块和临床特征值的相关性分析热图;(d) 不同模块间相关性热图
3.7. GGT1,E2F1,LMNA,CDKN1A和IGFBP1在数据集中的表达
对这5个基因在MAFLD患者中的表达情况进行分析,随着MAFLD的发展,GGT1,E2F1,LMNA,和CDKN1A的表达显著升高;而IGFBP1则相反,随着MAFLD的发展,其表达显著降低(图6)。

Figure 6. Expression of GGT1, E2F1, LMNA, CDKN1A and IGFBP1 in different stages of MAFLD patients
图6. GGT1,E2F1,LMNA,CDKN1A和IGFBP1在MAFLD不同阶段患者中的表达情况
4. 讨论
MAFLD系过食油腻肥甘,湿浊内生,脾胃乃伤。食而不运,脂膏留积于肝,致疏泄不利,所引发的一系列病证。如叶天士在《临证指南医案》云:“湿从内生者,必其人膏粮酒醴过度”。康老总结MAFLD病因,主要责之湿邪内盛,运化失常。病机为痰湿瘀浊壅滞,三焦气机升降失职,最终导致肝脏脂肪过多难以输出而积聚。故苓荷颗粒组方以茯苓益脾调脏、利水渗湿;荷叶泻肝行气、散瘀利水,合而为君;臣以陈皮理气健脾、宣通五脏;佛手舒肝和胃、消痞除胀;山楂行结气、消食积、开郁化滞;丹参祛瘀生新、理气活血,共助君之用;佐以玉米须利尿泻浊,决明子清肝益肾、利水通便。诸药协同,升降有度,运化有序,则可使湿邪内除,精微传输及时,气机枢纽得利,机体复常 [8] [9]。课题组前期初步临床观察证实,苓荷颗粒能显著改善MAFLD患者体重、腰围、肝脏脂肪变性定量(CAP值)等肥胖相关指标和肝脏脂肪变性。
然而,虽已有前期临床数据证实苓荷颗粒治疗MAFLD具有较好的疗效,但是对其确切的疗效机制及作用靶点仍知之甚少。传统研究中药作用机制的方法大多从研究单个或少数几个基因、通路或者中药中的单体成分入手,具有一定的盲目性、局部性,无法对疾病的发生发展机制进行全局探索,难以从整体观揭示中药治疗疾病的多成分、多靶点、多通路的特点。以整体性、系统性为特点的网络药理学,与中医药整体观念、辨证论治、方剂配伍等原则不谋而合。由网络药理学参与并主导的“多成分,多靶点”研究策略已获得多次成功 [10]。本研究采用WGCNA联合网络药理学的方法,构建无尺度网络,将差异基因分为14个模块,从中挖掘得到4个与MAFLD发生发展密切相关的基因群,进一步通过与前述网络药理学靶点分析结果进行比对,发现GGT1,E2F1,LMNA,CDKN1A和IGFBP1可能是苓荷颗粒治疗MAFLD的潜在靶点。
GGT1 (gamma-glutamyl transpeptidase,γ谷氨酰基转移酶),是一种细胞表面酶,裂解细胞外谷胱甘肽(glutathione, GSH)等,在保持细胞内谷胱甘肽水平中起着重要的作用 [11]。临床将其作为肝损伤标志之一。研究发现人类血清中GGT1水平与肥胖以及代谢综合症 [12] 相关。澳大利亚的一项队列研究 [13] 显示,一组与GGT关联的SNP同时也与心血管疾病及2型糖尿病等代谢性疾病强相关。GGT1同时也被发现是泽泻治疗糖尿病大鼠 [14] 以及黄芪和紫草提取物治疗MAFLD肝病小鼠肝脂肪变性的靶点 [15]。
在MAFLD中,胆固醇在肝脏中的蓄积是早期事件。已有研究证明E2F1通过调节蛋白通过原蛋白转化酶枯草杆菌蛋白酶/kexin 9 (PCSK9)来维持胆固醇稳态 [16]。同时,MAFLD中的脂质代谢重排有助于疾病发展,在由MAFLD发展成肝癌的过程中,代谢重排是标志。Gonzalez Romero等 [17] 的最新一项研究显示,E2F1-E2F2-Cpt2通路轴线的激活提供了肝癌发生所需的富含脂质的环境,在接受高脂饮食和二乙基亚硝胺给药的小鼠中,MAFLD相关肝癌中E2F1和E2F2的表达增加。
LMNA编码的Lamin A/C是细胞核纤层的主要组成部分,直接或间接与染色质相互作用,在维持染色质结构、DNA复制、转录和细胞凋亡等方面发挥重要作用 [18]。目前已有多个研究发现,LMNA基因的突变或多态性与多种代谢性疾病密切相关 [19] [20]。
蛋白p21由CDKN1A编码。研究表明,CDKN1A变异与疾病进展的速度有关,比如,CDKN1A变体与特发性肺纤维化的快速发展有关 [21]。CDKN1A可能在NAFLD的疾病进展中起类似作用 [21]。Aravinthan等 [22] 通过比较无纤维化和有纤维化的NAFLD患者,检验CDKN1A变异对肝纤维化的影响,研究发现CDKN1A(p21)的rs762623和纤维化密切相关。
胰岛素样生长因子结合蛋白1 (IGFBP-1)是六个IGFBP之一,它们结合并调节胰岛素样生长因子1 (IGF-1)的生物利用度 [23] [24]。我们的结果显示IGFBP1的表达和其他4个基因不同,随着MAFLD的发展,其表达逐步降低(图6),本结果和文献报道一致 [25]。Stanley等 [26] 的研究显示,具有较高脂肪变性和NAS活性评分的个体肝脏中的IGF1 mRNA显著降低。磷酸化的IGFBP-1可作为MAFLD中肝脂肪的非侵入性预测生物标志物 [27]。
综上,本研究发现,苓荷颗粒作用相关的关键基因涉及TNF信号通路,MAPK信号通路,非酒精性肝病等通路。进一步结合WGCNA分析发现的GGT1,E2F1,LMNA,CDKN1A和IGFBP1和MAFLD的发生发展密切相关,为苓荷颗粒治疗MAFLD的潜在靶点。本研究结果可为未来进一步研究苓荷颗粒作用于MAFLD的实验研究及临床运用提供理论依据和实验依据。
基金项目
上海市“科技创新行动计划”自然科学基金项目(20ZR1453700);国家自然基金青年项目(81503478);厦门市中医院项目(202101)。
NOTES
*通讯作者。