1. 引言
黑色素瘤是一种由皮肤黑色素细胞发展而来的恶性肿瘤,发病率近年来持续增长 [1] [2] 。黑色素瘤在皮肤癌症中占比不高,但它是皮肤癌症中致死性最高的癌症,转移性黑色素瘤的5年生存率仅为27%,全球每年有55,500人致死 [3] 。黑色素瘤的常用疗法包括免疫检查点抑制剂治疗、靶向治疗、白介素治疗、溶瘤治疗等多种治疗方式 [4] ,由于黑色素瘤的高致死率与普遍存在的耐药问题,探索黑色素瘤的治疗与寻找新的靶点非常重要 [4] [5] 。千金藤素是临床上已经使用了40多年的白细胞增生药物,用于肿瘤治疗引起的白细胞减少症,被发现在治疗新冠病毒上具备卓越表现,26项的比较性临床研究中,千金藤素被认证为细胞水平抗新冠病毒最有效的药物 [6] [7] 。千金藤素在黑色素瘤中的应用尚不明确,本研究旨在细胞水平探究千金藤素对黑色素瘤的作用,探究千金藤素对黑色素瘤细胞系A375干性的影响及机制。
2. 材料与方法
2.1. 材料
人黑色素瘤细胞系A375细胞系购买自上海中乔新舟生物科技有限公司;二甲基亚砜,千金藤素购买自美国赛莱克生物公司;青链双抗,CCK8试剂购买自武汉赛维尔生物公司;BCA试剂盒,EdU检测试剂购买自上海碧云天生物公司;细胞培养基和胎牛血清购买自赛默飞生物公司;SOX2,CD133,CD44,JAK2,STAT3,p-JAK2,p-STAT3抗体购买自埃博抗生物公司。
2.2. 方法
2.2.1. A375细胞培养
人黑色素瘤细胞系A375细胞系使用DMEM高糖培养基,含10%胎牛血清,1%青链霉素双抗在37℃,5%二氧化碳及饱和湿度的培养箱中培养,使用超净台进行无菌操作。每2天时间在细胞密度80%左右时进行传代,传代比例1:3。
2.2.2. CCK8检测药物千金藤素时间剂量效应
剂量梯度:细胞计数后,使用96孔板,以每孔5000个细胞进行铺板,在12小时后更换含不同浓度(参见数据)千金藤素,孵育24小时。
时间梯度:细胞计数后,使用96孔板,以每孔5000个细胞进行铺板,在12小时后更换IC50浓度的千金藤素,按照不同时间梯度处理(参见数据)。
以无血清DMEM高糖培养基比CCK8原液9比1的比例配置混合液,每孔加入100微升,在37℃,5%二氧化碳及饱和湿度的培养箱中孵育1小时。在450 nm波长下检测OD值,进行数据分析。
2.2.3. EdU实验检测细胞增殖
采用EdU成像试剂盒检测细胞的增殖情况,96孔板以每孔1 × 104个细胞的密度铺片,按照实验方案进行药物处理。EdU按推荐浓度2 µM孵育2小时,Hoechst 33342标记细胞核并拍照计数。
2.2.4. 克隆形成实验
将细胞以每孔500个细胞的密度置于6孔板中,在37℃、5% CO2的湿化气氛中孵育14天。去除培养基,用预热的PBS洗涤两次,然后用4%多聚甲醛固定15分钟。去除多聚甲醛后,用PBS再次洗涤培养基,用结晶紫染料溶液孵育15 min。去除结晶紫染料后进行数据收集,显微镜下计数含有≥20个细胞。
2.2.5. 蛋白免疫印记实验
提取总蛋白/核质分离蛋白,BCA测定蛋白浓度后定容至标准。洗干净预制胶,拔出胶板,上样后电泳条件170 V,恒压45分钟。PVDF膜依次浸入甲醇、1×膜平衡液各3分钟进行活化后转膜。膜浸入快速封闭液摇床上封闭10分钟,浸泡在一抗中4℃过夜。条带室温复温1小时后TBST在摇床上以60转的速度清洗3次,每次5分钟。浸入二抗,室温孵育1小时,同样条件TBST清洗后显影。
2.2.6. 肿瘤干细胞球形成实验
细胞在低吸附6孔板(美国康宁公司)中以每孔5000个细胞的密度培养,在特定培养基中培养,该培养基由DMEM/F12培养基中添加1倍B27补充剂,0.4%牛血清白蛋白,20 ng/ml表皮生长因子和10 ng/ml碱性成纤维细胞生长因子组成。细胞在37℃、5% CO2的环境中孵育,一周后收集数据。
2.2.7. 数据分析
实验组与对照组间各独立样本的统计学意义采用非配对双侧t检验。使用GraphPad Prism 7.0 (GraphPad Software Inc, San Diego, CA)进行数据分析,定量数据以均数 ± 标准差表示。
3. 结果
3.1. CCK8实验检测千金藤素对A375细胞的作用
如图1所示,每组设置3个副孔,千金藤素按照的0,2.5,5,10,15,20 μM的梯度给药,处理24小时,根据测得OD值计算存活率,千金藤素对A375细胞的IC50约为10 μM (见图1(a))。
按照IC50剂量给药,设置时间梯度为24,36,48,60,72 h,根据测得OD值计算存活率。结果可见,千金藤素抑制A375细胞增殖,效果与时间剂量成正比(见见图1(b))。
3.2. 千金藤素抑制A375细胞的增殖能力
如图所示,克隆形成实验和EdU实验表明千金藤素抑制了A375细胞的克隆形成能力和增殖能力(见图2),该分子化合物具备抗肿瘤潜能。

Figure 1. CCK8 experiment. (a) Cell viability after 24 hours of CEP gradient treatment; (b) Cell viability after CEP time gradient treatment
图1. CCK8实验。(a) CEP梯度处理24小时后细胞活性;(b) CEP时间梯度处理后细胞活性

Figure 2. Cepharanthine inhibited the proliferation of A375 cells. (a) (b) Colony formation experiment and quantification, (c) (d) EdU experiment and quantification
图2. 千金藤素抑制A375细胞的增殖能力。(a) (b) 克隆形成实验及量化;(c) (d) EdU实验及量化
3.3. 千金藤素抑制A375细胞的干性
如图,成球实验千金藤素处理组肿瘤球较小,且蛋白印迹显示干性指标均下降(见图3)。
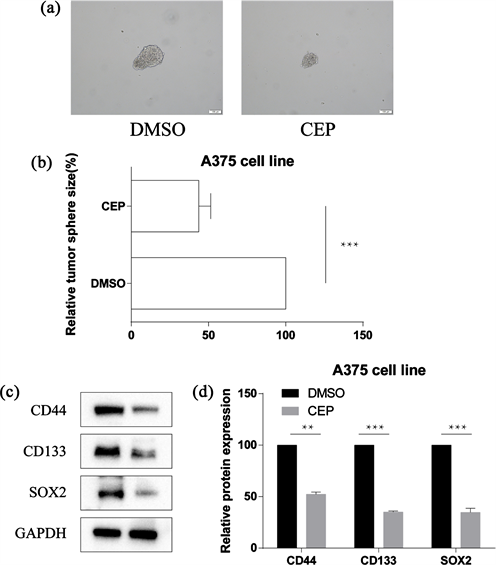
Figure 3. The cell stemness of A375 cells was decreased after cepharanthine treatment. (a) (b) Experiment and quantification of tumor ball formation; (c) (d) Detection of stemness index CD44, CD133, SOX2 and quantification
图3. 千金藤素处理后A375细胞的干性减弱。(a) (b) 瘤球形成实验及量化;(c) (d) 检测干性指标CD44,CD133,SOX2及量化
3.4. 千金藤素抑制JAK2/STAT3发挥作用
如图,千金藤素处理后JAK2/STAT3的磷酸化减弱,JAK2/STAT3被抑制(见图4)。
4. 讨论
黑色素瘤在皮肤癌中发病率仅此于基底细胞癌和鳞状细胞癌,是第三大常见的皮肤恶性肿瘤 [8] [9] 。尽管其占皮肤癌总数仅5%,但黑色素瘤占皮肤癌总相关死亡率的65% [10] 。黑色素瘤的治疗在过去十年中一直在变化,早期黑色素瘤的治疗以手术为主,能够获得很好的治疗效果。而转移性黑色素瘤的预后
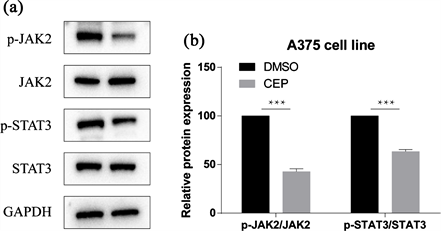
Figure 4. Expression of JAK2/STAT3 after cepharanthine treatment. (a) (b) WB detects JAK2/STAT3 and its phosphorylation, (b) shows quantification
图4. 千金藤素处理后JAK2/STAT3的表达。(a) (b) WB检测JAK2/STAT3及其磷酸化,(b) 图为量化
不佳,虽然免疫检查点抑制剂的应用极大改善了这一境况,但许多时候仍然见效极差 [11] [12] 。目前在临床上,至少已有4种免疫疗法和3种靶向疗法可以提高黑色素瘤患者的总生存率,抗CTLA-4抗体药物ipilimumab,nivolumab和PD-1以及PD-L1单抗的应用有效提升了晚期黑色素瘤患者的患癌率。此外,黑色素瘤是突变负荷最高的实体瘤之一,基因突变和表达谱分析在黑色素瘤治疗中逐渐成为常规,分子机制的探索对黑色素瘤的治疗方式具备深远的意义 [13] 。
目前我国传统药物的抗肿瘤作用越来越受到重视,从传统药物中提取的抗肿瘤活性成分表现出良好的疗效和最小的不良反应。千金藤素是从防己科植物千金藤中提取的生物碱,最早在1933年被日本科学家提取,是一种低毒有效的升白细胞药物,应用于临床至今已经40多年。它可单独或与其他治疗药物联合调节多条信号通路,抑制肿瘤细胞增殖、诱导凋亡、调节自噬、抑制血管生成,从而抑制肿瘤进展,如调控Nrf2/Keap1诱导胃癌细胞氧化应激,诱导乳腺癌细胞自噬与凋亡,也通过Wnt/Hedgehog通路发挥作用 [14] [15] [16] [17] 。
在本研究中,我们首先使用不同剂量的千金藤素对黑色素瘤细胞系A375进行处理,筛选出IC50剂量,用IC50剂量测试千金藤素的时间杀伤效应,数据表明,千金藤素能够有效抑制黑色素瘤细胞系A375的增殖。紧接着,我们通过EdU实验和克隆形成实验检测了千金藤素对黑色素瘤细胞系A375的增殖与克隆形成能力,实验结果验证了千金藤素的抑瘤作用。紧接着,我们通过肿瘤球形成实验和检测干性相关蛋白表达来探究千金藤素对黑色素瘤细胞系A375干性的作用,结果表明千金藤素能够明显抑制黑色素瘤细胞系A375的干性。最后,千金藤素有效抑制了JAK2/STAT3信号,表明千金藤素可能通过调节JAK2/STAT3信号抑制干性,从而发挥抑制肿瘤的效应。
综上所述,我们的研究证明了千金藤素可能通过靶向JAK2/STAT3信号轴抑制干性,在人皮肤黑色素瘤中发挥抗癌作用。我们仅研究了千金藤素在黑色素瘤细胞系A375中的作用,具备一定的局限性,尚需要更广泛系统的研究。
NOTES
*通讯作者。