1. 引言
众所周知,分级结构的纳米材料具有孔隙率高、比表面积大、透光性良好和抗聚团能力强等特点,广泛应用于吸附、太阳能电池和光催化等领域。目前,越来越多的科学研究工作人员致力于生产和合成具有分级结构的微/纳米材料,Wu [1] 等人研究制备了Bi2WO6分级结构纳米材料;Li [2] 等人研究制备了自组装SnO2分级结构纳米材料等。分级结构的微/纳米有着广阔的研究前景。
ZnOHF是一种重要的含锌纳米材料,同时也是一种非金属氧化物半导体。其带隙能为3.74 ev,且具有化学性质稳定和无毒等特点,在光催化、光致发光和光电子 [3] [4] 等领域有广泛的应用。目前,越来越多的研究人员致力于通过多种方法合成ZnOHF,例如,水热法、电沉积法、溶解法和微波辅助法等,合成了各种形态的ZnOHF微/纳米材料,例如扇形、花状、带状、网状、棒状、线状、饼状、球形等 [5] [6] 。
氨基酸有着丰富的官能团(如−NH2、−COOH、−SH、−OH)和与金属离子配位的能力,所以经常应用于合成纳米材料。Wang [7] 等人利用氨基酸作为辅助剂合成了花状的ZnOHF纳米材料;Li [8] 等人已经对氨基酸的辅助合成形貌不同的纳米材料有了一定的研究;Zou [9] 等人用氨基酸辅助合成了特殊形貌的ZnO纳米材料。综上所述,当氨基酸作为辅助剂和结构导向剂,对产品的形貌有重要的影响。因此,本论文采用L-异亮氨酸作为辅助剂,采用简单的水热法,通过调节反应时间合成由纳米管组成的微球状ZnOHF,并深入研究ZnOHF对于亚甲基蓝(MB)的吸附性能。
2. 实验部分
2.1. 仪器与试剂
紫外-可见分光光度计(Shimadzu UV-3600),X-射线粉末衍射仪(Bruker D8-Advance),扫描电子显微镜(Hitachi S-4800),透射电镜(JEOL-2100F)。
Zn(OAc)2∙2H2O、亚甲基蓝(MB)购自西陇科学有限公司;(NH4)2SiF6购自阿拉丁工业公司;L-异亮氨酸(L-Ile)购自中国化学有限公司,以上药品均为分析纯化学试剂。
2.2. 样品表征
常温常压下,在Bruker D8-advance X-粉末射线衍射仪(Cu Kα radiation λ= 0.15418 nm)上表征产物的结晶相。通过扫描电镜(SEM, Hitachi S-4800)和透射电子显微镜(TEM, JEOL-2100F)研究样品的形态和微观结构。在室温下,用Shimadzu UV-3600光谱仪记录UV-Vis漫反射光谱(DRS)。
2.3. ZnOHF纳米材料的制备
准确称量1.0 mmol L-异亮氨酸和3.0 mmol Zn (OAc)2∙2H2O溶解于25 mL蒸馏水中,在磁力搅拌20 min,直至完全溶解。再向其中加入1.0 mmol (NH4)2SiF6,继续搅拌10 min后,再将均相溶液转移到30 mL聚四氟乙烯衬里的不锈钢制成的反应釜中。在150℃下加热12 h后,等高压反应釜自然冷却至室温后,取出内胆将下层沉淀转移到15 mL的离心管中,高速离心后得到一种白色的沉淀,然后再使用蒸馏水和乙醇分别洗涤两次。将产物转移至电热恒温鼓风干燥箱中,在70℃下干燥3 h,最终得到一种白色的粉末。控制其他条件不变,改变反应时间进行一系列研究。
2.4. 有机染料的吸附性研究
通过监测亚甲基蓝水溶液的分解速率来测试样品的吸附性。在装有50 mL的亚甲基蓝溶液的烧杯中,加入25 mg样品,放置在磁力搅拌器上暗室搅拌,取约3.5 mL记作0 min。开始时每隔5 min取出约3.5 mL的悬浮液,10 min之后每隔10 min从烧杯取出溶液,依次装入不同塑料离心试管中,并做好标号。最后,离心悬浮液,使得取出的样品中的ZnOHF粉末沉淀下来,用紫外可见分光光度计记录最高处吸收峰强度的变化,从而测定其浓度的变化。
3. 结果与讨论
3.1. 纳米管组成ZnOHF微球的晶相、形貌和尺寸
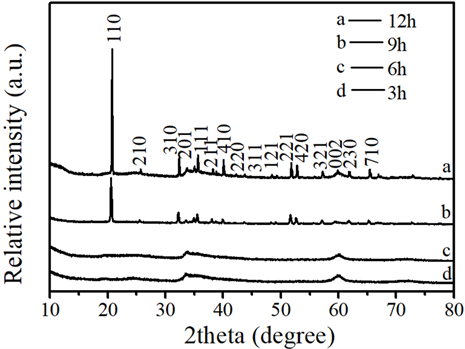
Figure 1. The XRD pattern of the product at different time
图1. 不同时间制得ZnOHF的XRD
为了研究时间对晶相的影响,我们对不同反应时间的样品进行测试并对比。如图1 a曲线所示为加热12 h所制得的样品的晶相,所有的衍射峰均可以索引到正交晶相的ZnOHF,与JCPDS (74-1816)一致,未观察到杂质峰说明产物的纯度很高且无杂质,强而窄的衍射峰表明产物具有高结晶度。c和d曲线所对应的6 h和3 h下制备出的ZnOHF结晶度较差,比较发现12 h下获得的样品的衍射峰强度比9 h下的强,这说明产物的结晶度随着反应时间的延长而增大。

Figure 2. The SEM images of the products obtained at different reaction time: (a), (b) 12 h; (c) 9 h; (d) 6 h; (e) 3 h
图2. 在不同反应时间获得产物的SEM图:(a), (b) 12 h;(c) 9 h;(d) 6 h;(e) 3 h
图2为不同时间所制备产物的SEM图。如图可知,当反应12 h时(图2(a)),观察由直径约为17 nm的纳米管组成的ZnOHF微球,进一步放大微球表面,如图2(b)所示,可以清楚地看出微球表面是大量的纳米管,其直径在20 nm左右。为了研究纳米管组装的微球的形成过程,缩短反应时间观察形貌。当反应时间为9 h (图2(c)),纳米片的边缘呈卷曲状,其厚度为6~7 nm;当反应6 h时(图2(d)),可以明显观察到由纳米片组成的花状微球;反应3 h时(图2(e)),得到了许多表面呈片状条纹的三维微球。由此可知,反应时间对ZnOHF的形貌有较大的影响,随着反应时间的延长,有利于ZnOHF由纳米片组装的微球演化到纳米管组装的微球。
3.2. 产物对有机染料的吸附性质研究
在暗室的条件吸附亚甲基蓝溶液,研究其去除率,来分析不同形貌ZnOHF的吸附活性。图3(a)、(b)显示由不同形貌ZnOHF在不同时间下吸附MB溶液(20 mg/L)的紫外吸收光谱。由图所示,随着暗室吸附时间的延长,吸收强度迅速下降,说明两种形貌的ZnOHF微球在暗室下都对MB染料有着很强的吸附性。如图3(c),当反应进行到5 min时纳米管组成的ZnOHF微球比纳米片组成的ZnOHF微球对MB的去除效率高,随后在20 min时两者的效率又趋于相同,由此可知纳米管组成的微球状ZnOHF对MB的去除效果比由纳米片组成的微球状ZnOHF好。由此可知,吸附剂材料的形貌是影响吸附性能的重要因素。由纳米管组成具有分级结构ZnOHF微球具有较大的比表面积和空隙,所以使得ZnOHF表面拥有更多的活性中心,从而增强ZnOHF表面正电荷和MB染料之间的静电引力。
为了研究吸附剂对染料的吸附速率和吸附剂的平衡吸附能力,通常用吸附动力学方程和吸附等温曲线来预测吸附规律。用拟二级动力学方程(方程1)和Langmuir模型(方程2)对吸附过程进行拟合:
(1)
(2)
由表1和图3(d)可知,拟二级线性相关系数都大于0.999,说明ZnOHF微球对MB染料的吸附过程符合拟二级动力学的模型。曲线拟合二阶模型显示出良好的线性,计算的qe值基于二阶模型非常符合实验数据。又由图3(e)可知,Langmuir线性相关系数为0.991,由此可知ZnOHF微球对MB的吸附符合Langmuir等温吸附模型,由此说明该吸附过程为单分子层吸附,所制备的ZnOHF吸附亚甲基蓝的过程的吸附等温线符合Langmuir二级动力学模型。
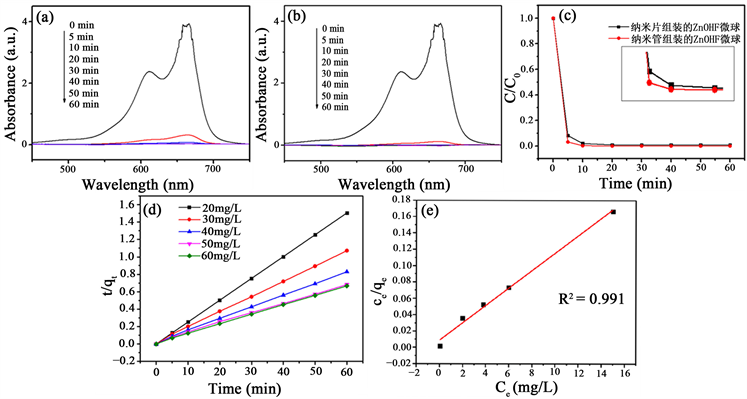
Figure 3. (a) Ultraviolet visible absorption spectra of ZnOHF microspheres assembled on nanosheets adsorbing 20 mg/L MB; (b) Ultraviolet visible absorption spectra of Nanotube assembled ZnOHF microspheres adsorbing 20 mg/L MB; (c) Different morphologies of 25 mg ZnOHF adsorb 20 mg/L of MB; (d) Quasi second order dynamics; (e) Langmuir adsorption isotherm
图3. (a) 纳米片组装ZnOHF微球吸附20 mg/L MB的紫外可见吸收光谱;(b) 纳米管组装ZnOHF微球吸附20 mg/L MB的紫外可见吸收光谱;(c) 25 mg不同形貌的ZnOHF吸附20 mg/L的MB;(d) 拟二阶动力学;(e) Langmuir吸附等温线

Table 1. Kinetic parameters of adsorption of MB onto ZnOHF microspheres
表1. ZnOHF微球对MB的吸附动力学参数
4. 结论
在本论文中,采用(NH4)2SiF6作为反应物,以L-异亮氨酸(L-Ile)作为辅助剂,利用水热法合成了由纳米管组成的微球状ZnOHF。通过大量的实验研究进行对比,发现反应时间对于合成ZnOHF的形貌有重要的影响。随着反应时间的延长,产物的形貌经历了由片层球到纳米管组成的微球。研究发现所制得的纳米管组成微球状ZnOHF对MB染料有着优异的吸附性能,且该吸附过程符合Langmuir二级动力学模型。本文通过简便方法合成的具有分级结构的ZnOHF纳米材料显示出较好的吸附活性,使它们有着广泛的应用。
NOTES
*通讯作者。