1. 引言
骨肉瘤是一种自发恶性程度较高具有间充质恶性的较为罕见的骨肿瘤,来源于骨叶间细胞。其在年龄上存在着双峰分布,在青少年晚期和成年初期达到第一次高峰,在年老期即60岁左右出现第二次高峰,且致残致死率极高 [1] [2] [3] 。有关骨肉瘤的治疗通常采用药物治疗,例如,特异性药物甲氨蝶呤的细胞周期性调节治疗,环氧化酶2的特异性靶向治疗等 [4] [5] [6] ;但机体对药物治疗会产生耐药性等副作用使其药效降低。随后,单靶向治疗掀起了一股热潮,但由于其靶向抗体单一,而骨肿瘤细胞表面存在着多种抗原,因而根据抗原抗体的特异性结合特性,其抗体少于抗原,从而使其治疗效果较差。近年来,骨肉瘤治疗的研究聚焦于对致病机制通路的多靶向治疗 [7] [8] 。在骨肉瘤致病因子以及靶向治疗方面,大量的研究发现,其致病因素主要在于骨组织内通路发生了一系列的位置转移或局部缺失,如P53通路的5个突变,眼视网膜母细胞基因(RBI)的突变等导致疾病 [8] 。目前的靶向治疗趋向于多分子的生物靶向,达到准确的靶向而特异性抑制肿瘤,减少患者的病痛。本研究将应用基因芯片法对骨组织样本芯片进行分析(14个骨肉瘤芯片,6个正常骨组织芯片),深入探讨其肿瘤形成机制和相关信号通路,达到多靶向治疗的目的,为临床多靶向治疗骨肉瘤提供更多的切入点。
2. 实验方法
2.1. 骨肉瘤的相关基因表达谱
基因表达数据GSE16088来源于美国癌症研究所遗传分支学实验室上传于基因表达综合数据库,本研究共检测了20例样本,基因数据样本来源于美国斯隆凯瑟琳纪念医院外科和流行病生物信息科1982年7月~2012年5月收治的骨外骨肉瘤患者,纳入的20例样本中,女性12例,男性8例;其中14例为下肢股骨肿瘤病变,6例正常样本分别取软骨,肝脏,肾脏各2例作为阴性对照;年龄10~88岁,平均年龄64岁;该研究通过成都大学伦理委员会审批。
2.2. 表达数据预处理
下载保存Affy的表达式原始数据,格式为.CEL。
2.3. 基因差异表达分析
利用GCBI学院中的差异基因分析程序,进行骨肉瘤和正常骨组织间的差异表达分析。通过方案设计、参数设置、结果分析,测序了d Score,Fold Chang,Gene Feature等数据筛选得到的基因被认为是具有高置信度的差异表达基因。利用这些差异表达的基因,根据Q < 0.05,P < 0.002,Flod Change > 1.2,|logFC| > 1的阈值,识别骨肉瘤与正常对照样本之间的异常基因。
2.4. 构建互动网络
通过严格的检测方法,对差异表达的基因进行高置信度的筛选,利用检索相互作用基因(STRING)的搜索工具对差异表达的基因产物的交互对象进行搜索,构建蛋白质交互网络。
2.5. 分析网络模块
对得到的差异分析数据进行Pathway分析和Go分析,使得整个数据得到分解和功能注释。根据此结果,预测出诱导骨肉瘤的相关信号通路并进行分析。
3. 结果
3.1. 数据预处理结果
将所选样本进行分组后得到其样本几乎都在同一水平线上(图1(A))。如图,蓝色方框是肿瘤组织,
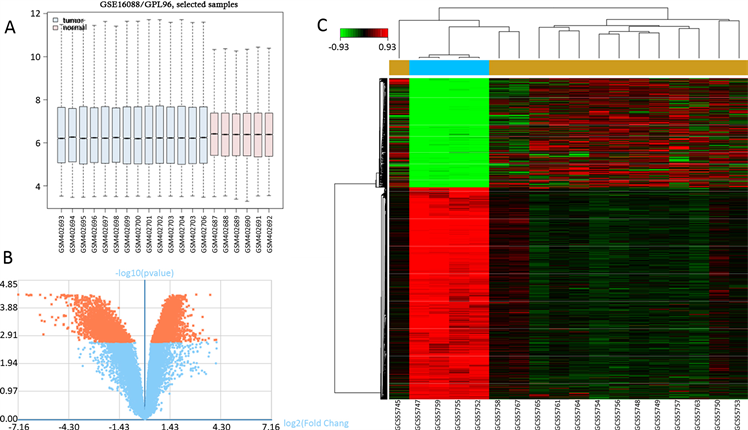
Figure 1. (A) Sample Analysis Chart: the blue frame in the picture is the osteosarcoma sample chip, the pink is the normal bone tissue chip, and the bisection of each rectangle is on a straight line (red line in the figure) to illustrate the feasibility of the sample. Its feasibility is high. (B) Differential volcanic map, horizontal coordinates represent log2 (Fold Change), vertical coordinates-log10 (P value), each point represents one gene, red points represent differentially expressed genes, blue spots represent no differentially expressed genes, The graph can show the distribution of different genes in. (C) Cluster diagram, the horizontal coordinates represent sample clustering, and the vertical coordinates represent gene clustering. Class. Color level represents gene expression abundance, red and green represent up-regulation and down-regulation respectively
图1. (A) 样本分析图:图片中蓝色框为骨肉瘤样本芯片,粉红色为正常骨组织芯片,每个矩形的平分线均在一条直线(图中红线)上说明样本可行,其可行性高。(B) 差异火山图,横坐标代表log2 (Fold Change),纵坐标表示-log10(P值),每个点代表一个基因,图中红色点代表差异表达基因,蓝色点代表没有差异基因,其图可以显示其差异基因的分布情况。(C) 聚类图,横坐标代表样本聚类,纵坐标代表基因聚类。色阶代表基因表达丰度,红色,绿色分别代表上调和下调
粉色方框为正常组织,其分组后样本在一条直线上,说明样本的可行性大。
3.2. 差异表达基因分析
选取Q < 0.05,P < 0.002,Flod Change > 1.2,|logFC| > 1范围进行分析,获得火山图和聚类图,都可以看到P值与logFC之间的联系都较为显著(图1(B)),根据差异表达数据值的大小可以筛选出表达差异大的基因,即为差异表达基因(图1(C)),表达差异最大的三个基因分别是COL1A2,COL5A2,COL11A1,其表达系数均位于前列,在骨肉瘤发病相关基因中其表达差异倍数高于10倍以上,足以说明此类基因引起发病的系数大(表1)。

Table 1. Differentially expressed genes
表1. 差异表达基因
3.3. 交互网络构建结果
选择差异表达倍数大的基因COL1A2,COL5A2,COL11A1等通过STRING系统进行构建基因交互网络,将其差异表达的基因之间的联系放大倍数后,便可观察到其网络中与其差异基因联系紧密的其他基因(图2(A)),这些基因便可预测其在骨肉瘤中的发病机制,研究其与COL系胶原之间的联系,进行药物靶向治疗。
3.4. 网络模块分析结果
通过GO (Gene Ontoligy)分析和Pathway分析得到富集性(图2(B))和显著性分析图表(图2(C))。GO分析对实验结果有提示作用,通过GO差异分析,可以找到有关于富集差异基因信息的GO分析条列,进而分析其差异基因与相关基因在集体内的功能;Pathway分析可以将具有差异的基因聚集在pathway项目下,从而更快捷清晰地寻找差异基因与相应基因通路的关系。通过分析网络交互情况,即可找出其与COL系基因有关的其他作用基因。通过此方法,本研究发现COL-MMPs-RhoA-JNK通路为引发骨肉瘤疾病的一条重要通路。
4. 讨论
本研究通过比较正常骨和骨肉瘤组织的表达数据,确定了最显著上调表达基因为COL系,其中COL1A2、COL5A2、COL11A1基因差异表达系数最大。用COL1A2,COL5A2构建网络,分析与骨肉瘤相关基因之间的相互作用,发现COL-MMPs-RhoA-JNK通路可能为引发骨肉瘤疾病的一条重要通路。
胶原蛋白是高分子物质,主要存在于动物的结缔组织内,分布范围广,占蛋白质总质量的25%~30%,

Figure 2. (A) Gene interaction network diagram: it is constructed by selecting genes with large differentially expressed multiple to observe the significant analysis of gene. (B) Associated with differentially expressed genes: horizontal coordinate representation-log10 (P-value), Vertical coordinates represent Pathway, through genes aggregated under its pathway project to quickly and clearly search for the relationship between differential genes and the corresponding gene pathway. (C) Enrichment analysis chart: horizontal coordinates represent Enrichment, coordinates represent Go-term, through the pictures, we can get the relevant GO analysis columns, and use them to enrich the information
图2. (A) 基因交互网络图:其通过选择差异表达倍数大的基因进行网络构建,观察其与差异表达基因相关联的基因。(B) 显著分析图:横坐标表示-log10 (P-value),纵坐标表示Pathway,通过其pathway项目下聚集的基因,快捷清晰地寻找差异基因与相应基因通路的关系。(C) 富集分析图:横坐标表示Enrichment,纵坐标表示Go-term,通过图片可以得到有关GO分析条列,利用其富集信息分析其差异基因与相关基因在集体内的功能
某些生物体内甚至高达80%以上,骨的有机质组成中,胶原的成分占到90% [9] [10] ,同时胶原蛋白也是重要的蛋白质矩阵,因此不同的COL系胶原降解都会不同程度地引起骨类疾病;在本研究网络图中分析得到,其COL系基因如COL5A2等与基质金属蛋白酶类(Matrix metalloproteinase, MMPs)存在着相互联系,MMP是侵袭性癌症的标志之一,其种类约20种 [11] [12] [13] ,其大部分亚类都主要作用于细胞外基质,降解胶原纤维引起一系列骨肉瘤疾病,如MMP-9,该亚类为明胶酶,其可水解细胞外基质的明胶和胶原,从而破坏细胞基底膜屏障作用,引起骨肉瘤的发生和转移 [9] [11] ,同时,MMPs中的MMP-14与膜结合后导致其基质中COL胶原纤维减少形成侵袭屏障 [8] ,因此可知MMPs对骨肉瘤的诱导起重要作用,同时其发生与COL系胶原存在着直接关系 [14] [15] [16] ,因此,利用COL系胶原的重塑及使用药物抑制MMPs的诱导作用可减少对机体产生的侵袭性和转移性的骨肉瘤疾病;有研究表明,MMPs作用通路受RhoA-JNK通路的调控,当抑制其RhoA-JNK的作用机制便可抑制其MMPs产生的作用 [14] [16] [17] ,综上我们将其影响机制之间的联系整合得到相关通路COL-MMPs-RhoA-JNK。Fromigué O等人通过小鼠体内外,转染实验等研究发现,他汀类药物诱导的hMG-coA还原酶通过抑制jnk-c-jun-MMP 2通路减少了骨肉瘤细胞的迁移和侵袭 [18] ,他汀类药物对肿瘤细胞迁移的抑制作用主要是由于基质金属蛋白酶(MMPs)活性降低所致 [19] ,故我们发现在COL-MMPs-RhoA-JNK中,通过他汀类药物抑制MMPs的作用及MMPs与COL,RhoA,JNK之间的相互作用,使得COL系胶原受损降低,同时其中的HMG-CoA的信号越高会大量激活RhoA-JNK通路发生作用,降低骨肉瘤的恶性侵袭和转移 [19] [20] [21] [22] 。因此,通过他汀类药物及COL系细胞外基质的重塑作用于COL-MMPs-RhoA-JNK通路,可能在骨肉瘤的靶向通路治疗中有重要作用,COL-MMPs-RhoA-JNK通路可能为一条重要的骨肉瘤机制通路。
5. 总结
通过基因芯片分析构建基因交互网络得到骨肉瘤发病机制通路图,发现以COL系基因表达差异最强,且MMPs与其相关性大,通过对COL,MMPs等基因的作用机制及相关基因进行分析发现它们之间的相关性,并构建COL-MMPs-RhoA-JNK通路。通过细胞外基质重塑和他汀类药物的双向作用于COL-MMPs- RhoA-JNK,可能实现多靶向治疗达到较好的治疗预后。本研究可以为临床骨肉瘤的治疗提供新的切入点。然而骨肉瘤的发病机制至今仍未研究透彻,因此以后的研究重点应聚焦骨肉瘤致病基因,以期对骨肉瘤的发生实现可预防。
基金项目
本文由四川省科技厅项目(2018JY0348),国家自然科学基金项目(51402027),国家级大学生创新创业训练计划项目(201811079019)和成都大学大学生创新创业训练计划项目(CDU_CX_2019392, CDU_CX_2019393, CDU_CX_2019394, CDU_CX_2019395, CDU_CX_2019396)资助。