1. 引言
人工心脏的研究和发展已经持续了50多年,现在在解决了很多技术性问题后,无论旋转泵还是隔膜泵均可以辅助病人的血液循环达数年之久。在旋转式心脏泵中,基本技术问题一直是可植入性,生物相容性,搏动性,耐用性,双心室辅助,自动检测,仿生控制和血栓的形成。
本文总结了作者对解决这些问题的贡献,并与读者分享了一些中国旋转型心脏泵的创新之处。
2. 可植入性
2.1. 问题
人工心脏的第一例动物实验是在1957年,第一次临床试验在1982年,且都是在美国。直到20世纪90年代,人工心脏泵被深入地应用在抢救急性心衰竭,或作为心脏移植的过渡手段,甚至永久使用。用心脏泵的患者生活质量较差,因为那时的旋转泵有几千克重,而隔膜泵甚至更重(图1,图2)。
因此,心脏泵的小型化成为当时最重要的研究重点。
2.2. 方法
作者通过两个步骤减少了心脏泵系统的体积和重量:1) 增加泵的旋转速度;2) 减小定子铁心和转子磁钢。

Figure 1. Centrifugal pump weighing 2 Kg used in clinic in 1980s
图1. 20世纪80年代大型的离心泵应用于临床

Figure 2. Diaphragm pump implanted in a boy in 2003 in Shanghai, his mother carried its driving device weighing 30 Kg
图2. 2003年隔膜泵被用于一个男孩,他的母亲推着心脏泵的驱动装置
根据流体机械的知识,泵流量和扬程分别与转速的平方和三次方成正比。若流量和扬程保持不变,增加转速后泵的重量和体积可以显著减少。
作者通过实验发现电机设计的现行方法在缩小定子线圈铁心和转子磁钢的尺寸上有很大改进空间,换言之,若保证泵的输出特性不变,电机的体积和重量可以大大地减小[1] 。
2.3. 结果
图3显示了作者研制的离心泵(150克)和轴流泵(27~40克),它们是可完全植入在胸腔,甚至在患者的心脏里。
3. 生物相容性
3.1. 问题
旋转泵在转速几千转每分甚至更高时是否会对血液造成破坏,这一直以来是最被关心的问题。实验和理论研究表明剪应力是溶血的主要原因,而血流中的湍流会造成很大的剪应力[2] 。
这个问题已变成如何消除或减少在旋转心脏泵中的湍流?
3.2. 方法
作者通过解偏微分方程推导出叶轮的流场,然后根据流场设计了叶轮叶片和轮盘。这样叶轮的流动模式将是层状的,而不是湍流[3] 。
在柱坐标系下(图4),r、θ、z分别是径向、周向和轴向向量。连续性方程,运动方程和能量方程的公式为:
 (1)
(1)
 (2)
(2)
 (3)
(3)
其中w是相对流动速度,ω是角速度,r为半径,P为出口压力,P0为进口压力,u为圆周速度(u = ωr)。
同时,相对速度w与流面的关系为

Figure 3. Chinese centrifugal heart pump (left/upper, 150 g) [4] and axial heart pump (right/upper and lower, 27 - 40 g) [9]
图3. 中国产离心式心脏泵(150克)(左上)[4] 和轴流式心脏泵(27~40克)[9]

Figure 4. Coordinates for deducing impeller vane and shroud [3]
图4. 柱坐标系。r、θ、z分别是径向、周向和轴向向量[3]
 (4)
(4)
其中, 和
和 代表了流面的梯度。
代表了流面的梯度。
经过计算,在混流式叶轮的流场可以简化为:
 (5)
(5)
也就是说,叶轮叶片为对数螺旋型而轮盘是抛物线型。
3.3. 结果
利用这个流线型设计,叶轮叶片和轮盘处处与叶轮流线一致,这已被CFD所证明(图5)。作为比较,美国的Bio-pump采用了直叶片和轮盘,CFD显示在叶片和轮盘的流道中有紊流。
PIV技术的图片(图6)表明流线型叶轮叶片在设计点没有紊流,在美国Bio-pump里或流线型叶轮的非设计点处有明显的紊流。
用猪的新鲜血液进行的溶血试验结果表明,作者的泵对红细胞的破坏比美国bio-pump的减少一半(图7)。

Figure 5. CFD of streamlined vane (right, upper) and shroud (left, lower), and straight vane (left, upper) and shroud (right, lower) [11]
图5. 对数螺旋叶片(右上)与直线叶片(左上)的CFD流线图;抛物线轮盘(左下)和直线型轮盘(右下)的CFD流线图[11]




Figure 6. PIV pictures of streamlined vane at design point (lower, left) and other point (lower, right), and of American Bio-pump (upper) [11]
图6. 直线型叶片(上)和对数螺旋叶片(下)的PIV流线。左边的图片显示的是在设计点的泵流量,右边的是非设计点的泵流量[11]
4. 搏动流
4.1. 问题
显而易见的是,搏动流对血液循环非常重要,因为搏动可减少周边血管阻力。但是,要用叶轮泵产生搏动流是很困难的,因为产生搏动流会对血液造成破坏。进一步研究显示,对血液破坏的主要因素是湍流剪切力,它会破坏红细胞的细胞膜,使血红蛋白释放到血浆中,最终导致溶血。因此,设计具有低溶血搏动流的心脏泵问题变成了如何开发一个无湍流的搏动叶轮泵?
4.2. 方法
作者通过周期性地改变叶轮转速使其产生搏动流;湍流是通过设计一个扭曲叶片的叶轮来减少(图8),随着转速的周期性变化,血流将会改变方向而不是大小(图9)。
 (6)
(6)
4.3. 结果
离心式搏动泵已经用于动物实验(图10)。该泵辅助小牛的血液循环长达几个月,而没有损害实验动物的血液成分和器官功能[4] 。实验表明,搏动式叶轮泵是辅助心脏康复最有效的泵,因为它既可以产生像隔膜泵那样的博动流,又可以像非搏动泵那样不间断地泵血;前者降低了循环阻力而后者增加了主动脉舒张压力,从而增加自然心脏冠状动脉的灌注。

Figure 7. Hemolysis index of streamlined impeller (1) and straight impeller (2) [11]
图7. 流线型叶轮(1)和直线型叶轮(2)的离心泵溶血指数[11]


Figure 8. Twisted impeller of pulsatile centrifugal pump [3]
图8. 扭曲叶轮的搏动离心泵[3]

Figure 9. Velosity components of twisted (left) and untwisted (impeller) [3]
图9. 扭曲(左)和非扭曲(右)叶片的速度分量[3]
5. 耐久性
5.1. 问题
随着利用心脏泵辅助的患者生存时间的延长,泵轴承的机械磨损成为一个严重的问题。其他研究者一般使用电磁悬浮轴承,由于需要转子位置检测和反馈控制而增加了系统的复杂性,而且增大了系统的体积和重量以及功耗。
根据Earnshaw定理(1839年),永磁一直被传统观念认为是不稳定的,虽然与电磁悬浮和超导磁悬浮相比它有很多优点,例如简单性和可靠性[5] 。作者发现,Earnshaw从理论上证明了静态永磁悬浮是不稳定的,但没有人回答动态的永磁悬浮会出现什么情况;此外,作者发现,如果其旋转的速度足够高,通过所谓的陀螺效应一个永磁悬浮转子可以达到稳定的平衡,其中永磁转子稳定的最小转速会随着转子转动惯量和(或)轴承力的增大而降低。
5.2. 方法
作者将永磁悬浮轴承应用在心脏泵中,如图11所示,它有两个永磁环,内外径大小不同但厚度相同;小环位于大环旁边且与大环保持同心,都是轴向磁化且方向相同。与现有的被动磁轴承相比,这种新颖的轴承需要的轴向空间较小,具有较大的轴向力,并具有较好的稳定性[6] 。
5.3. 结果
永磁磁悬浮离心式泵及其示意图如图12所示。两个被动磁轴承用于支持转子径向和轴向的悬浮。当流量大于1 L/min时,如果转速高于3250 rpm,转子最大偏心距(图12下)会小于转子和定子的间距。这意味着,在这些条件下转子实现了悬浮[7] 。

Figure 10. Physiological data of LVAD with pulsatile impeller pump on dogs [4] . Upper: at the beginning of the experiment; lower: several hours later
图10. 采用搏动式左心室辅助叶轮泵的动物实验生理测量数据[4] 。上:实验开始时;下:几小时后

Figure 11. The author’s permanent magnetic bearing used in rotary heart pumps [6]
图11. 作者的用于旋转式心脏泵的永磁轴承[6]



Figure 12. Permanent maglev centrifugal pump (upper, right) and its schematic drawing (upper, left), and its rotor’s maximal eccentric distance (lower) [6]
图12. 永磁悬浮离心泵(右)和结构示意图(左)以及其转子的最大偏心距(下)[6]
6. 双心室辅助
6.1. 问题
在临床应用中,心脏泵主要用作左心室或右心室辅助泵,有时候患者也需要双心室辅助。隔膜泵早就有单心室或双心室辅助装置,后者还有另一个名字:全人工心脏。如何开发旋转式双心室辅助泵或旋转型全人工心脏?
6.2. 方法
其他研究者使用两个旋转泵进行双心室辅助,在这样两个驱动器,两个控制器和两个电池组的情况下就会产生一些新问题。作者使用一个电机来驱动两个泵,其血流动力学性能甚至比双心室辅助隔膜泵更好。
6.3. 结果
图13展示叶轮式全人工心脏(左)及其在动物实验中的原型。与隔膜式全人工心脏相比,叶轮全人工心脏具有以下优势:1) 当电机转速周期性改变时,两个泵会同时泵出血液;2) 两个泵流量的平衡可以不需要控制的情况下自动获得[12] 。
7. 自动检测
7.1. 问题
在进行心室辅助时泵的流量和扬程的测量很重要,但很困难。一方面,泵的流量和压力是泵的性能和受体(实验动物或病人)生理机能的指示器,同时提供用于泵本身控制的基础。另一方面,直接测量泵的流量和压力会使受体连接一个流量计和压力计,也会导致血液问题,增加了感染的危险。
7.2. 方法
叶轮泵首先在转速3000 rpm到4000 rpm的范围内选定五个不同值进行实验。对于每一个转速n下的电机功率P、泵流量Q和扬程H进行了测定。电机功率由电压和电流的乘积决定,用自制的直流电源测量,其可以显示电压和电流的数值[13] 。
在图14所示的曲线表明了在几个离散的转速下Q和P之间以及H和P之间的关系。为了获得在其它任意转速值下的这些关系,可以使用人工神经网络。在图15中有一个3层BP(反向传播)神经网络。

Figure 13. Impeller total heart [12]
图13. 双心室辅助叶轮泵(叶轮式全人工心脏)[12]


Figure 14. Q-P curves (left) and H-P curves (right) [13] by measuring
图14. 在实验中直接测量的几条Q-P的曲线(左)和H-P曲线(右)[13]

Figure 15. Three layer counter propagation neural web translates Q-P and H-P relations into Functions of Q = f(P,n) and H = g(P,n) [13]
图15. 3层的反向传播(BP)神经网络可以将Q-P和H-P的关系转化为函数Q = f(P,n)和H = g(P,n)[13]
从实验中测量的P和n值加载到输入层,Q和H值加载到输出层,经过该BP网络训练,Q-P和H-P的关系就可以转化成Q = f(p,n)和H = g(P,n)功能。这意味着,每一个任意的P和N值,一旦加载到上述图15所示的BP网络的输入层,相应的Q和H值就可从该BP网络的输出层得到。
函数Q = f(P,n)和H = g(P,n)被存储在计算机中,建立一个数据库来作为实验中泵的档案。
在动物实验或临床试验时,泵的转速和电机功率被自动记录并载入到神经网络。然后泵的流量和扬程就会以数字的方式显示出来。开始时实验室进行了一系列的实验验证其可行性。作者的叶轮泵以两个不同于示范实验中使用的转速进行实验。P,Q和H值用和示范实验中相同的方法测定。测量的Q和H值与利用神经网络计算出的值进行比较。
7.3. 结果
图16显示了验证实验的结果和根据此方法得到的计算结果。与直接测量方法相比,该计算方法得到的泵的扬程值误差不到2%,而对泵的流量的误差不到5%,因此准确性比大多数非侵入性测量方法更好。
8. 仿生控制
8.1. 问题
旋转式心脏泵通常的控制,无论是恒定电压还是恒定转速都无法满足实验动物或患者的生理需求。这些控制方法的灵敏度约为10 mmHg的压力变化造成1 L/min的流量变化(图17),而自然心室却是大约1 mmHg对应1 L/min。为了左心室辅助泵的受体的舒适性,提高泵流量随扬程变化的灵敏度是必要的。
8.2. 方法
设计了一种新的控制系统的控制策略,如图18所示。当心脏泵扬程(H)降低时,流量(Q)会因泵的自动调节功能而增加,此时输入电压(U)将人为地增加,而不是保持电压恒定,那么心脏泵流量(Q)将多倍增加;当心脏泵的扬程(H)增加时,其流量(Q)会自动减小,此时人为降低心脏泵的输入电压(U),那么心脏泵的流量将多倍减小,以改善心脏泵流量随扬程变化的灵敏度。
8.3. 结果
改进后的控制系统首先用于示范性实验,以测量2 mmHg模式下心脏泵的扬程和流量的关系,即扬程每降低2 mmHg流量增大1 L/min。然后与16 V的恒定电压和3500 r/min恒定转速(图19)下测得的曲线进行比较。显然,流量随扬程变化的灵敏度明显提高。

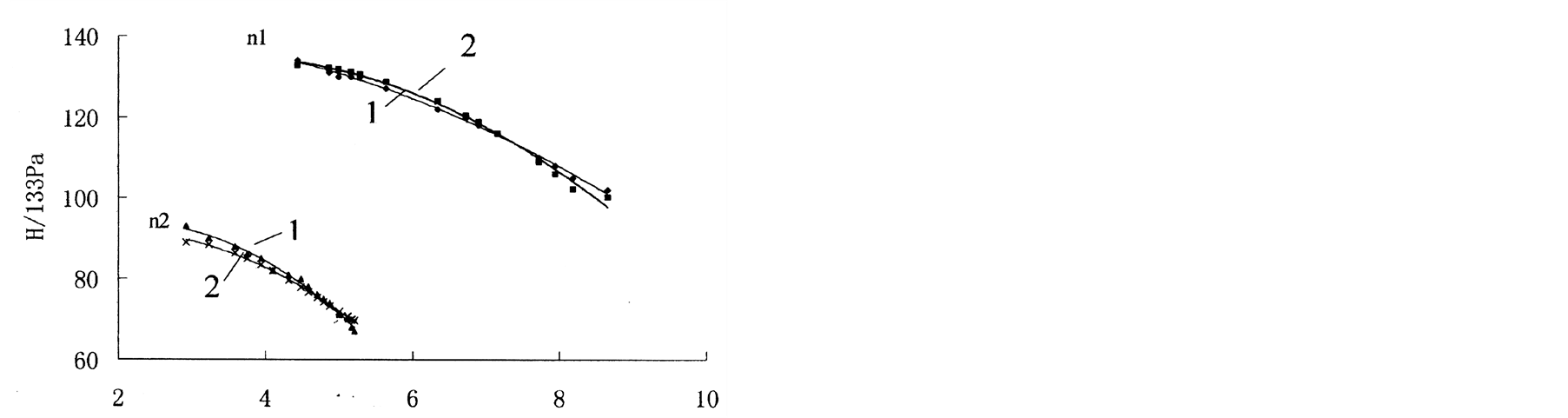
Figure 16. Compared with the measuring value, the results of this method have an error of 5% by Q-P (left) and 2% by H-P (right) [13]
图16. 与在验证实验中直接测量的Q-P曲线(左)和H-P曲线(右)相比,按这种新方法计算的结果的误差分别低于5%和2%。1-测量值;2-计算值[13]


Figure 17. H-Q value by constant speed control (upper) and by constant voltage control (lower) [13]
图17. 在几个离散的转速下进行的示范试验中直接测量的H-Q曲线,上图为恒定转速控制,下图为恒定电压控制[13]

Figure 18. Strategy of bionic control system [13]
图18. 仿生控制系统的策略图[13]
9. 血栓形成
9.1. 问题
所有现有的左心室辅助装置(LVADs)需要进口和出口连接导管,辅助血流流经从左心室到主动脉的血流旁路(图20)。这将导致一些最有可能形成血栓的地方,并引发对自然循环的生理干扰,以及需要额外的胸部解剖空间。
9.2. 方法
笔者开发了一个贯穿的和跨瓣膜的心室内轴流泵和主动脉瓣膜泵来解决这些问题[8] [9] 。这两个新的心脏泵直接将血液从心室输送到主动脉,而不需要进口和出口管,也不需要循环旁路,这意味着在辅助系统中排除了最有可能形成血栓的位置(图21)。

Figure 19. Q-H values under bionic control and constant voltage or constant rpm controls [13]
图19. 2 mmHg模式下的曲线与恒定电压和恒定转速下的曲线比较[13]


Figure 20. Both diaphragm (left) and rotary (right) pumps need connecting tube and by-pass circle, where are most likely theombosis sites [14]
图20. 隔膜泵(左)和旋转泵(右)均需要连接导管和循环旁路,这是被认为最有可能产生血栓的位置[14]


Figure 21. Transventricle pump (left) and valvopump (right) need no connecting tube and bypass circle [8] [9]
图21. 心室内心脏泵(左)和瓣膜泵(右)既不需要连接导管,也不需要循环旁路[8] [9]

Figure 22. Unsolved problem: energy transmission
图22. 利用穿过皮肤的导线(右)或者使用经皮感应系统(中)进行电源供应是旋转心脏泵的一个没有解决的最困难的问题
9.3. 结果
心室内心脏泵重53克,长115毫米,最大外径是13毫米。电机是60毫米长,泵长55毫米。在电机两侧,专门设计的滚针轴承及净化系统能保证马达轴承工作在盐水中。该装置贯穿式地插入心室,然后经主动脉瓣进入主动脉。它用于康复治疗或作为心脏移植的过渡手段。无轴承瓣膜泵针对不同体重的病人设计了21毫米,23毫米和25毫米的外径。装置的重量分别为27克,31克和40克。作为最终治疗手段,它可以很容易地缝合在主动脉瓣环上,将血液从心室直接输送到主动脉。
这两个新颖的微型LVADs可减少临床应用中血栓的形成。
10. 讨论
旋转式心脏泵的一个最困难的未解决的问题是能量供应。目前的方法无论是利用穿过皮肤的导线还是使用经皮感应系统都存在一定问题(图22),因为他们既不方便也不可靠。这个问题会在将来困扰心脏泵的研究者[10] 。