1. 引言
根据中国肿瘤登记中心的最新统计结果显示 [1] [2] ,我国男性胰腺癌发病率在肿瘤中位于第8位,死亡率为第6位,且目前胰腺癌的发病率和死亡率处于上升态势。胰腺癌早期疗效好,切除率达90%以上,术后病人5年生存率为70%~100% [3] ,对于中、晚期胰腺癌,目前尚无有效的临床治疗方案,其5年生存率不足5% [4] 。如若能通过临床方法提高胰腺癌早期检出率,将会使胰腺癌患者受益匪浅,但是由于胰腺癌发病部位相对比较隐匿,缺乏典型早期临床表现,胰腺癌相关肿瘤标志物诊断价值不高,使得胰腺癌早期发现困难,因此如何提升胰腺癌的二级预防能力是当前热点。随着医学的快速发展和检验技术的深入研究,肿瘤相关标志物在临床用于诊断的研究也取得了较大的进展,涌现了一大批相关标志物和应用策略 [5] 。但单项检测的实际效果并不理想,临床上为了提高诊断真实性常常采用两种及以上的肿瘤标志物联合检测的策略,CA199,CA242,CA50是近年来受关注的胰腺癌相关标记物,在尹莉莉 [6] 研究中发现CA199,CA50联合检测可以提高早期胰腺癌的诊断价值,魏善和 [7] 在研究中指出CA199和CA242对胰腺癌患者的术前诊断、动态监控及判断预后等方面价值较高,而标记物CA50在对预期疗效方面临床意义较大。联合检测较单一检测对胰腺癌的临床诊断和疗效观察价值更高。大多数胰腺癌患者血清中CA199的浓度会升高,但是仍有部分患者血清中只显示CA50水平升高而CA199正常或轻度波动;CA242在胰腺癌的异常增殖细胞中含量升高。目前已有采用单项CA199或联合检测CA199,CA242,CA50进行胰腺癌早期筛查与诊断的报道。本研究将收集国内外常用数据库中公开发表的关于胰腺癌诊断中单独检测CA199和联合检测CA199,CA242,CA50的文献,进行meta分析,评价单独与联合检测诊断价值及临床实用性,为胰腺癌的早期诊断提供证据。
2. 资料与方法
2.1. 检索策略
以中文检索词“CA199”、“CA242”、“CA50”、“胰腺癌”检索中国期刊全文数据库(CNKI)、维普中文科技期刊全文数据库(VIP)和万方数据知识服务平台(WanFang Data)。以英文检索词“pancreatic carcinoma”、“pancreatic cancer”、“CA199”、“CA242”、“CA50”检索PubMed、CBM、The Cochrane Library。以PubMed数据库的检测策略为例,检索策略见图1。本次研究文献收集检索日期截至2017年12月。
2.2. 纳入和排除标准
纳入标准:① 纳入研究中,以病理学活检和(或)手术探查为胰腺癌金标准;② 对象为胰腺癌患者和易误诊为胰腺癌的健康人和良性疾病者,均不限定民族、年龄、性别;③ 对照组为健康人和(或)胰腺良性病组,健康组抽取自医院体检人群,良性疾病包括各种胰腺炎症,胰腺囊肿等;④ 能直接获得或者通过统计学方法获得单独检测肿瘤标志物CA199及CA199、CA242、CA50三者联合检测试验的真阳性值(TP)、真阴性值(TN)、假阳性值(FP)、假阴性值(FN)等相应初始数据;⑤ 中英文文献。
排除标准:① 文摘、讲座、会议类文献;② 病例组患者未经金标准证实或金标准不明以及不能通过相关渠道获知该试验中金标准的;③ 文献经QUADAS评价 [8] 得分较低(<7分)的研究报道;④ 不能能直接获得或者通过统计学方法获取完整数据资料的文献;⑤ 经过临床治疗后的肿瘤标志物探讨的文献;⑥ 重复文献。
2.3. 文献筛选与质量评价
由两名评价员分别根据上述的纳入标准和排除标准独立对数据库文献进行筛选,如意见不统一时由

Figure 1. The Search strategy of Pubmed
图1. PubMed检索策略
两名评价员协商解决或经由第三方决定。经研究组共同认定符合纳入标准的研究统一用QUADAS工具进行质量评价。评价结果显示本次纳入的6篇文献质量较好。
2.4. 统计分析
采用诊断性试验的Meta分析方法进行评估 [9] 。本研究使用的统计软件包括:Review Manager 5.3 [10] 、stata14、Meta-Disc 1.4 [11] 。本次研究纳入的6篇文献,先做异质性检验,采用平面图和Spearman相关系数来研究统计学上的阈值效应,若Spearman系数P值小于0.05,和(或)ROC曲线呈现为“肩臂状”,则提示本次研究中的数据存在阈值效应。若存在阈值效应,则只作SROC曲线平面图和计算Q指数。如果异质性是由非阈值效应引起且I2 < 50%,则进行Meta回归分析,探讨数据异质性的来源,若由非阈值效应引起的统计学异质性较大(I2 > 50%),那么观察是否存在同质的亚组,进行亚组内合并分析。再根据异质性检验结果选择固定效应模型或随机效应模型进行合并分析,计算各研究的合并值,包括:灵敏度(SEN),特异性(SPE),诊断优势比(DOR),受试者特征曲线(SROC)面积(AUC)和Q指数的诊断。最后通过stata14软件绘制漏斗图,分析计算潜在的发表偏倚。本次实验中认为P < 0.05有统计学意义。
3. 结果
3.1. 筛选结果
根据研究规划的检索策略,在各个中英文数据库初步检索到共215篇文献。在阅读文献题目和摘要后,删除明显与本次研究无关或与上述纳入标准不相符的文献,剩余160篇文献。再由2名系统评价员据规定的纳入和排除标准分别阅读全文进行筛选,删除与胰腺癌无关、非诊断性试验、经治疗干预后的肿瘤标志物探讨的文献及文摘、讲座、会议类文献,剩余文献103篇。然后对剩余文献进行初步资料提取时,删除没有金标准,资料不完整或有错误的文献,剩余文献37篇,接着删除无法直接或计算获得TP、FP、FN、TN或其他评价数据的文献,剩余9篇,最后排除重复文献,最终纳入符合纳入标准和排除标准的文献6篇 [12] - [17] 。文献筛选流程及结果见图2。
3.2. 纳入文献的特征
本次研究纳入的文章均为中文文献,文献发表时间在2001~2016年之间。6篇文献中,研究对象中病例组均为胰腺癌患者,共444例;对照组为胰腺良性病变患者和(或)来院体检的正常人群,共486例。纳入文献均提供胰腺癌诊断中单独检测CA199与CA199、CA242、CA50三项指标联合检测的灵敏度和特异度,三项指标的检测方法及其截断值。
3.3. 资料提取
资料提取:对纳入的6篇文献提取研究所需的信息包括:第一作者、检测方法、对照组人群分类、肿瘤标志物CA199、CA242、CA50的各项检测结果,记录于同一数据采集表(见表1)。
3.4. 质量评价
3.4.1. QUADAS评分
利用目前已经受到公认的QUADAS评分标准对纳入本次研究的6篇文献分别进行质量评价,该标准包含14项项目(见表2)包括疾病谱组成、纳入标准、金标准、疾病进展偏倚等。每条项目都有各自相应的评分细则,根据评分细则2名系统评价员各自评价纳入文献的质量,如遇评价不一致时通过协商达成一致或交由第三方评价,14个项目各自按“是”“不清楚”“否”进行评价。若达到项目细则规定要求
则评为“是”,以“√”表示,计1分;若不满足则评为“否”,以“×”表示,计−1分;若文献信息不全的则评为“不清”,以“?”表示,计0分。评价结果见表3。
3.4.2. 评估方法学质量
纳入研究采用Cochrane网软件RevMan 5.3中的诊断性试验评价工具QUADAS进行方法学质量评价(结果见图3和图4)。
3.5. Meta分析结果
3.5.1. 异质性检验
1) 单独检测CA199
阈值效应分析:对6篇纳入研究的文献数据的精确估量用Meta-Disc软件分析显示,ROC平面曲线
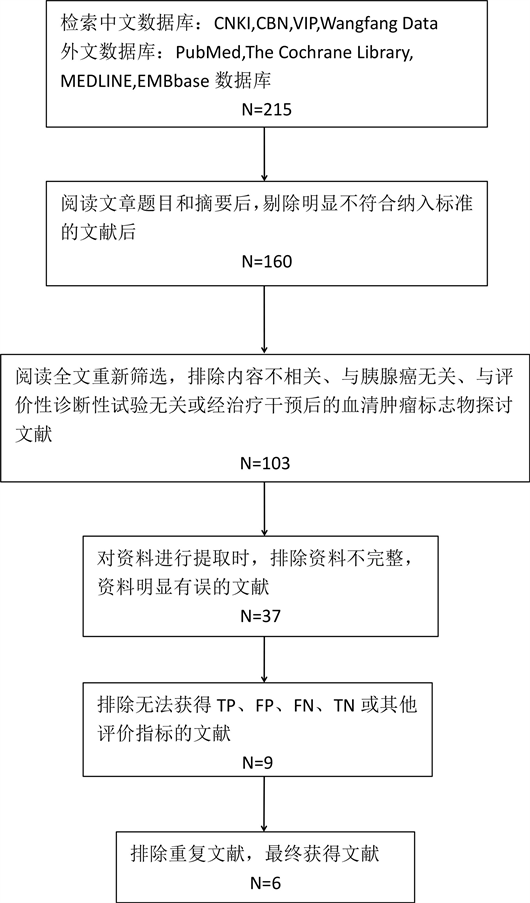
Figure 2. Studies flow diagram and result
图2. 文献筛选流程及结果

Table 1. Basic information of studies
表1. 文献基本资料

Table 2. Assessment for diagnostic accuracy studies (QUADAS)
表2. QUADAS文献质量评价

Table 3. The result of quality assessment
表3. 质量评价结果

Figure 3. Methodological quality summary
图3. 质量评价结果总结图

Figure 4. Methodological quality graph
图4. 质量评价结果条例图
不呈“肩臂状”,Spearman相关系数为−0.928,P = 0.008,说明数据之间存在阈值效应,故采用SROC曲线,AUC和Q指数分析。绘制Deek’s漏斗图,回归线显示双侧对称,P = 0.36,提示纳入的研究其发表偏倚不明显(见图5)。
2) 联合检测CA199、CA242、CA50
阈值效应分析:对6篇纳入研究的文献数据的精确估量用Meta-Disc软件分析显示ROC平面不呈“肩臂状”,Spearman相关系数为−0.600,P = 0.208,提示不存在阈值效应引起的异质性。非阈值效应分析:分析合并的DOR与各个研究的DOR是否沿同一直线分布,绘制DOR森林图(图8),显示数据排列不沿同一直线,并计算Cochran-Q为30.62,P = 0.0000,提示本研究可能存在由于非阈值效应引起的异质性。用meta回归方法,探讨非阈值效应的影响程度,将数据按检测方法、对照组类型等进行评估,根据P值的大小,逐个剔除,发现上述效应量与异质性在统计学上均无意义(P均 > 0.05),提示数据之间不存在因非阈值效应引起的异质性。绘制Deek’s漏斗图,回归线显示双侧对称,P = 0.25,显示纳入研究的发表偏倚不明显(见图6)。
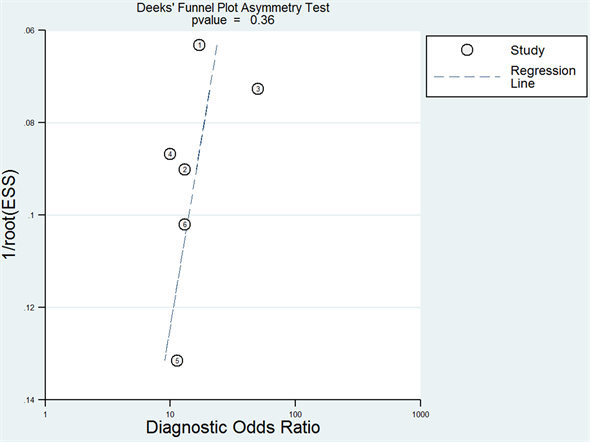
Figure 5. The Deek funnel plot of CA199 alone detection
图5. 单独检测CA199 Deek’s漏斗图

Figure 6. The Deek funnel plot of combination detection of CA199, CA242 and CA50
图6. 联合检测CA199,CA242,CA50 Deek’s漏斗图
3.5.2. 合并分析
单独检测CA199,拟合并绘制SROC曲线(如图7),同时得到AUC = 0.8889,Q指数 = 0.8196。联合检测血清肿瘤标志物CA199、CA242、CA50,拟合并绘制SROC曲线(如图8),同时得到AUC = 0.9832,Q指数 = 0.9434。
3.5.3. DOR值的计算
单独检测CA199,计算DOR Cochran-Q = 8.29 (P = 0.1408),I2 = 39.7%,因此该数据选用固定效应模型DOR合并 = 16.19 [95%CI = (10.26, 25.5)] (如图9)。联合检测血清肿瘤标志物CA199、CA242、CA50,

Figure 7. The curve SROC of independently detection of CA199
图7. 单独检测CA199的SROC曲线

Figure 8. The curve SROC of combined detection of CA199, CA242 and CA50
图8. 联合检测CA199,CA242,CA50的SROC曲线
计算DOR Cochran-Q = 34.55 (P = 0.000),I2 = 85.5%,因此该数据选用随机效应模型DOR合并 = 96.69 [95%CI = (22.98, 406.84)] (如图10)。
3.5.4. 联合检测CA199、CA242、CA50,计算敏感度及特异度
Sen Chi-squared = 10.12 (P = 0.0720),I2 = 50.6`%,因此该数据选用随机效应模型。Sen合并 = 0.94 [95%CI (0.91, 0.96)] (图11所示);Spe Chi-squared = 71.55 (P = 0.000),I2 = 93.0%,因此使用随机效应模型Spe合并 = 0.84 [95%CI (0.80, 0.87)] (图12所示)

Figure 9. The DOR forest plot of independently detection of CA199
图9. 单独检测CA199的DOR森林图

Figure 10. The DOR forest plot of combination detection of CA199, CA242 and CA50
图10. 联合检测CA199,CA242,CA50的DOR森林图

Figure 11. The Sensitivity forest plot of combination detection of CA199, CA242 and CA50
图11. 联合检测CA199,CA242,CA50敏感度森林图
3.5.5. 联合检测CA199、CA242、CA50,合并阳性似然比和阴性似然比
+LR Chi-squared = 62.65 (P = 0.000),I2 = 92.0%,因此使用随机效应模型+LR合并 = 6.46 [95%CI (2.79, 14.98)] (图13所示);−LR Chi-squared = 15.79 (P = 0.0075),I2 = 68.3%,因此使用随机效应模型-LR合并 = 0.08 [95%CI (0.04, 0.16)] (图14所示)。
3.6. 两种检测方法结果的比较
对比单独检测CA199,联合检测CA199、CA242、CA50的SROC曲线下的面积AUC上升了0.0943,

Figure 12. The specificity forest plot of combination detection of CA199, CA242 and CA50
图12. 联合检测CA199,CA242,CA50特异度森林图

Figure 13. The +LR forest plot of combination detection of CA199, CA242 and CA50
图13. 联合检测CA199,CA242,CA50阳性似然比森林图

Figure 14. The sensitivity forest plot of combination detection of CA199, CA242 and CA50
图14. 联合检测CA199,CA242,CA50敏感度森林图
DOR值上升了80.5和Q指数上升了0.1238,结果提示CA199、CA242、CA50的联合检测策略临床价值较高,更具有实用性。
4. 讨论
胰腺癌是目前临床比较常见的恶性度高的消化系统肿瘤,其早期发现困难,中晚期预后差,而提高早期胰腺癌患者检出率是改善患者生存率的重要手段。
CA199 [18] 是以单涎酸神经节甙脂为存在模式的血清中IgG的单克隆抗体,是一种高分子的糖蛋白混合物,其在血清中主要是以粘蛋白的模式存在。CA199是目前首选胰腺癌肿瘤标志物,其敏感性和特异性分别为81.8%和80.7%。有研究资料表明 [19] - [25] ,CA199阳性表达多见于进展期胰腺癌,对于早期胰腺癌和癌前病变的敏感性很低。CA50是一种只存在于正常人胰腺中的特殊的糖蛋白。大多数胰腺癌患者血清中CA199的浓度会升高,但是仍有部分患者血清中只显示CA50水平升高而CA199正常或轻度波动;CA242在胰腺癌的异常增殖细胞中含量升高,相比于CA199,CA242的诊断灵敏度略低,但其临床诊断正确率较CA199更优,有力弥补CA199在临床辅助检查上的缺陷和不足。此外 [26] [27] [28] ,常见的用于胰腺癌研究的肿瘤标志物还有CEA,但其对多种消化道恶性肿瘤均有升高,特异性不强;而PC-594和miR-492则目前研究较少,争议较大。
相关研究显示 [12] - [17] ,临床上联合检测CA199、CA242、CA50的检测策略中三种肿瘤标志物的相互补充和完善会明显提高早期胰腺癌确诊率。本研究的Meta分析表明,联合检测CA199、CA242、CA50对胰腺癌的诊断Sen合并为0.939 [95%CI (0.913, 0.960)],Spe合并为0.838 [95%CI (0.799, 0.872)],差异具有统计学意义,说明三种肿瘤标志物联合检测能增强癌症早期的诊出率。同时联合检测对于胰腺癌的临床诊断的DOR = 96.689、AUC = 0.9832和Q = 0.9434,较高的敏感度、特异度、AUC值说明了联合检测在提高胰腺癌的诊断效能和准确率之外,还具有较好的特异性,因此联合检测在临床中可以作为在诊断时选择的合适的检测策略。本研究得出了+LR合并为6.465,说明联合检测筛查胰腺癌正确判断阳性的概率是错误判断阳性概率的6.465倍,−LR合并为0.080,提示筛检错误判断阴性的概率小,因此临床上我们可将联合检测应用于胰腺癌的二级预防中,早发现,早诊断。本次实验中发现单独检测肿瘤标志物CA199有较大的阈值效应,而当前统计学领域普遍支持相比加权总计敏感度和特异度,采用统计学指标SROC和AUC,对于明显异质性的研究是更为可取的研究方法。上述Meta分析结果表明,联合检测CA199、CA242、CA50的DOR是单独检测CA199的5.97倍(96.69/16.19),AUC提高了0.0943,Q指数提高了0.1238,说明联合检测的检测策略在研究中的准确性较高,有更大的使用价值。
为了降低对研究的可信度和有效性的影响,本次研究收集的相关文献做到了最大程度的全面细致具体,制定相应标准细致完善。但可能仍存在着不足:① 没有涉及胰腺癌的目前全球公认的TMN分期分级。② 未做相应的灰色文献的检索,而且只检索了中英文文献。③ 文献异质性的研究有所局限。④ 没有纳入无法直接获得或无法通过统计学方法获得完整信息的文献,但这不影响结果的可靠性。⑤ 纳入的文献数量较少。
综上所述,我们可认为联合检测CA199、CA242、CA50在筛查和诊断胰腺癌上具有重要的临床应用价值。
基金项目
浙江省自然科学基金(LY14H270015)。
参考文献
NOTES
*通讯作者