1. 引言
白粉病是一种常见病害,其病原菌的宿主包括小麦这种主粮作物,也包括橡胶、油菜、葡萄、黄瓜、花卉等重要的经济作物,每年给农业生产造成巨大损失 [1] 。白粉菌是一种强制性的活体营养型病原,只侵染活体植物的表皮细胞,从寄主细胞汲取营养,抑制寄主细胞抗病途径的激活,从而完成自己的生长周期 [2] 。
MLO (MILDEW LOCUS O)基因编码,一类高度保守的蛋白,定位于细胞质膜上,可能参与抗白粉病早期反应。大麦MLO基因对大麦白粉病的抗性具有广谱性,这种抗性可能与植物体内囊泡运输过程有关 [3] 。小麦MLO蛋白在抗白粉病中的机理与大麦极为相似 [4] 。程鸿克隆了甜瓜同源基因CmMlo2,并发现该基因的表达受到白粉病侵染影响,而转Mlo2的转基因甜瓜则具有抗白粉病表型 [5] 。此外,使用一些诱导剂处理作物,可诱导抗病性的生理生化机制,从而达到抗病高产的目的。如使用低聚糖素可以提高橡胶树对白粉病的抗性 [6] ;而大黄酚和矽处理都可以激活黄瓜对白粉病的抗性 [7] [8] 。
Col-0对白粉菌(G. cichoracearum)的侵染十分敏感 [9] 。白粉菌是一类强制性活体营养型病原菌,植物体内的水杨酸途径介导了对这一类白粉菌的抗性 [10] 。然而水杨酸途径的激活,通常伴随各种生长缺陷、细胞死亡、产量降低等表型,在很多情况下不适合作为植物抗病育种的首选策略。植物对病原菌的抗性是一个复杂的过程,不依赖于水杨酸的白粉菌抗性研究仍然很少。前期各国研究人员对拟南芥突变体进行筛选,获得了一系列抗病突变体。一类是以edr (enhanced disease resistance)系列突变体为代表,白粉菌的侵染激活水杨酸途径,从而产生抗性 [11] 。另一类以pmr (powdery mildew resistance)系列突变体为代表,其抗性不依赖与水杨酸途径。这一类突变体由加州大学伯克利分校的Shauna Somerville实验室获得。通过对Col-0进行EMS诱变,获得了一系列不依赖于水杨酸途径的抗白粉病的突变体 [12] 。其中一个突变体为pmr5,其对白粉病对抗性不仅不依赖于水杨酸途径,同时也不依赖于另一传统的抗病途径茉莉酸/乙烯途径。因此,pmr5介导了一个新的抗病途径 [13] 。为了解析这个途径,前期Shauna Somerville教授实验室对pmr5进行了二次EMS诱变,获得了一系列回复突变体,称为ps (pmr5 suppressor)突变体,这些回复突变体回复了野生型Col-0对白粉病的敏感表型,且同时具有两个突变,一个是pmr5突变,另一个是未知的ps突变。这些ps突变可能是影响pmr5抗性的关键。克隆这些ps突变,可能找到调控pmr5中对白粉病抗性起关键作用的基因,从而解析这一抗病新途径。
ps突变体ps8,发现一个阿罗酸脱水酶ADT2 (Arogenate Dehydratase 2)的突变,使得pmr5; ps8呈现对白粉病的感病表型,说明一个正常功能的ADT2是pmr5突变体呈现抗病表型的必要条件,因此ADT2是调控植物抗白粉病途径的一个关键的正调控因子。之前有报道发现作为苯丙氨酸合成途径的关键基因 [14] 及花青素合成的重要因子 [15] ,ADT2也参与了植物对盐胁迫的响应,一个adt2-D显性突变造成了植物对盐胁迫的抗性 [16] 。有趣的是,ps8单突变体以及pmr5; ps8双突变体都对盐胁迫敏感,而这里ps8包含一个adt2的隐性突变,其结果与前人报道可以互相印证。综上所述,ADT2作为一个抗白粉病途径的正调控因子,同时也是抗盐途径的正调控因子,可以作为多抗作物育种的候选基因。
2. 材料与方法
2.1. 实验材料
本实验所用拟南芥野生型有突变体的野生型Col-0和做图位克隆的Ler。突变体有pmr5,pmr5; ps8,pad4-1 (CS3806)和adt2 (CS853046)。所有拟南芥均生长于21℃,16小时光照8小时黑暗的环境。健康的4周大植株浇灌250 mM NaCl水溶液用于盐处理。白粉菌为Golovinomyces cichoracearum,在生长条件相同但隔离的生长箱培养,在4周大的Col-0或pad4-1叶片上生长,每周继代一次。
2.2. 白粉菌侵染
白粉菌在4周大小健康的Col-0或者pad4-1植株上生长7~10天左右,作为菌源接种需要检测的4周大健康植株。若仅是观察感、抗病表型,可以直接取带有菌源的叶片摩擦待接种的叶片,7~10天后观察感、抗病表型。若需要定量分析,则将待接种的植株放在高约1.2米的接种箱底部,用吹风机将菌源植物叶片的孢子吹到箱体内,静置30分钟即可。
2.3. 利用基因组测序的图位克隆Mapping by sequencing (MBS)
运用混合分组分析(BSA, bulk segregant analysis)的原理,对混合的168株图位克隆群体样品提取总基因组DNA,进行全基因组测序(X),测序结果与原Col-0基因组对比,根据孟德尔遗传定律,进行BSA分析,找到与性状紧密连锁的突变区域,并对整个区域所有的突变点在原pmr5中测序,找到仅存在于pmr5; ps8但不存在于pmr5中的突变点,作为候选突变。候选突变中在基因编码区且造成氨基酸突变、可变剪切等突变的基因作为首选的候选基因,用于后续验证。
2.4. 台盼蓝染色
取接种白粉菌5天后的叶片,加入台盼蓝染液,沸水煮2分钟,室温静置30分钟后倒掉染色液,再用清水漂洗2~3次。倒干水分,加入水合氯醛脱色液,室温脱色12小时,使用清水漂洗3次,加入50%甘油浸没过叶片,可用于白粉菌的镜检及定量分析。
取染色后的叶片,腹面向上压片,显微镜下观察,统计12个以上分生孢子梗所产生的孢子。每个样品进行至少3个生物学重复。
3. 结果与讨论
3.1. pmr5的回复突变体pmr5; ps8
pmr5具有对白粉病极强的抗性,且有生长缺陷表型,表现为植株矮小 [13] 。加州大学伯克利分校的Shauna Somerville教授课题组对pmr5突变体进行了EMS二次诱变,找到一系列回复突变体,其中一个隐性回复突变体pmr5; ps8不仅仅回复了对白粉病的敏感,且同时回复了pmr5突变体的生长缺陷表型,其生长形态更接近Col-0野生型(图1)。后来我们分离了ps8单突变体,并对其一并进行表型检测。由于许多抗病相关突变体同时参与了抗非生物胁迫,因此我们测试了干旱胁迫和盐胁迫。干旱胁迫处理未发现明显表型(数据未显示)。我们分别用150 mM、200 mM和250 mM氯化钠处理植株,发现ps8和pmr5; ps8突变体都呈现敏感表型,以250 mM氯化钠处理表型最为明显。使用250 mM的氯化钠处理植株,4天后即可观察到ps8单突变体和pmr5; ps8都对盐的胁迫非常敏感,ps8单突变体叶片开始变黄,而pmr5; ps8已经接近死亡。同时我们发现pmr5对盐胁迫不敏感,其表型与野生型一致,因此该盐敏感表型可能来自于ps8基因突变(图2)。

Figure 1. Growth morphology of the mutants
图1. 各种突变体的生长表型
3.2. 图位克隆的群体构建
取纯合的pmr5; ps8突变体(Col-0背景),将其与Ler杂交,F2后代提取DNA,鉴定为pmr5纯合子的植株90株,自交后获得F3代植株,选取其中生长表型接近野生型的植株共168株,并做白粉菌抗性检测,发现全部对白粉菌敏感,因此这168棵植株即为pmr5; pm8双突变体,可用于图位克隆。
3.3. 传统图位克隆结合全基因组测序辅助的图位克隆
利用这168株图位克隆群体,我们对pmr5; ps8突变体进行了传统的图位克隆。BSA (bulk segregant analysis)分析表明该突变点位于三号染色体长臂。在此区域选取不同的多态性标记进行基因型检测,将ps8突变点粗略定位于GAPC和nga126之间(图3)。
运用混合分组分析(BSA, bulk segregant analysis)的原理,随机选取150株图位克隆群体样品提取总基因组DNA,进行全基因组测序(平均测序深度30X),测序结果与原Col-0基因组对比,根据孟德尔遗传定律,进行BSA分析,找到与性状紧密连锁的突变区域,与传统图位克隆所得区域完全一致(图3),且全基因组测序给出了该区域所有可能的突变位点。
3.4. 候选基因检测
由于pmr5突变体也来源于EMS诱变,其本身可能含有大量的无关突变点,这些无关突变点,也同样存在于pmr5; ps8双突变体中。在pmr5单突变体内对候选区域所有的突变点进行测序检测,找到只存在于pmr5; ps8突变体而不存在于pmr5单突变体内的突变点。候选突变点中在基因编码区且造成氨基酸突变、可变剪切等突变的基因作为首选的候选基因,用于后续验证。其中有一个符合要求的突变点位于
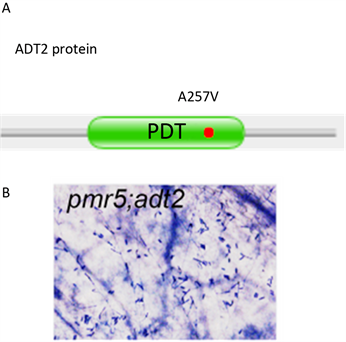
Figure 4. Complementation test
图4. 互补实验验证候选基因ADT2即为PS8
ADT2基因编码区,将257位氨基酸由丙氨酸突变为缬氨酸(图4A)。将ADT2蛋白序列放到pfam软件分析,蛋白结构示意图见图4A。pfam预测ADT2蛋白有一个PDT (Prephenate dehydratase)结构域(图4A绿色部分),红点标注ps8中的突变位点,位于该结构域中,可能破坏了该结构域的正常功能,造成功能缺失。已经发表的该基因的研究表明,adt2-D突变体(一个功能增强型突变体)能抗盐胁迫,与ps8突变体(一个功能缺失型突变体)表型相反。因此将ADT2列为ps8候选基因。由于正常的ps8基因功能应该是pmr5突变体呈现抗病表型的关键,因此pmr5; ps8双突变体呈现感病表型。如果ADT2就是ps8,那么pmr5; adt2双突变体也应该呈现感病表型。我们在ABRC (Arabidopsis Biological Resource Center)购买了adt2突变体,与pmr5杂交,获得pmr5; adt2纯合双突变体,白粉菌侵染7天后,对其进行台盼蓝染色,结果显示在图4B中。图中可见大量孢子生长,pmr5; adt2纯合双突变体呈感病表型(图4B)。因此证实ADT2即为ps8。
综上所述,我们克隆了一个pmr5的回复突变体ps8,编码ADT2的基因在此突变体中发生突变,将pmr5的抗病表型回复为同野生型类似的感病表型。ADT2是一个阿罗酸脱水酶,本研究为第一个证实该基因参与抗病的报道。
ADT2参与原生代谢(苯丙氨酸的合成),表明其对植物正常生长发育的重要性。ADT2同时参与次生代谢(花青素合成),而花青素作为一种抗氧化剂,在植物应答各种胁迫中起重要作用。相应的,该基因的功能获得型突变体adt2-D呈现抗盐表型,而功能缺失型突变体则呈现盐敏感表型,说明该基因参与了植物的盐胁迫响应。本研究则首次证实ADT2是植物不依赖于水杨酸的抗白粉病途径的一个关键基因。因此,ADT2可以作为候选基因,筛选抗病、抗盐的多抗作物。
致谢
感谢美国加州大学伯克利分校Shauna Somerville教授提供的pmr5和pmr5; ps8突变体种子。感谢中国科学院遗传与发育生物学研究所唐定中研究员课题组赠送的白粉菌种(Golovinomyces cichoracearum)。
基金项目
国家自然科学基金面上项目拟南芥中抗白粉病新途径相关基因的克隆与功能鉴定(项目编号3127039)和广东省应用植物学重点实验室开放课题(AB2018028)。
参考文献
NOTES
*通讯作者