1. 引言
阿特拉津是一种高效的除草剂,对杂草的生长具有良好的抑制作用。它的使用大大减轻了农民的耕作强度,提升了庄稼的产量,提高了劳动效率,在农业上被广泛使用。但是阿特拉津经常会残留在土壤中,并经过雨水冲刷进入河流、湖泊以及通过渗透而进入地下水中,给环境带来危害。兼之其在环境中比较稳定地存在,不易降解,因此会比较持久地给环境造成以下影响:一,阿特拉津会严重破坏水生态系统的平衡。因为阿特拉津对水中生物毒性极大,阿特拉津在0.5 ug∙L−1~2 mg∙L−1的情况下,至少可以把下列水底节肢动物的数量减少一半:松藻虫、蜉蝣蝻、牛虻、摇蚊、尖音库蚊、毛翅目的幼虫及寡目纲(环节动物)等 [1] [2] [3] 。二,人可以通过直接饮用含有阿特拉津的水及食物链导致阿特拉津在人体富集,从而有致癌风险。因阿特拉津是有机物,脂溶性特别好,与人体脂肪相溶,不易被人体新陈代谢排除。因此,作为一种典型、广泛使用的除草剂,阿特拉津对环境的持久危害值得重视,应设法加以消除。
目前,治理阿特拉津的方法很多,除了生物降解法之外,主要有光催化法、还原法和氧化法。光催化法主要有微波辅助ZrOx-ZnO/γ-Al2O3光催化动态降解阿特拉津 [4] [5] 、Fe(III)改性金红石TiO2可见光催化H2O2降解阿特拉津 [6] [7] 等。其中微波辅助ZrOx-ZnO/γ-Al2O3光催化动态降解阿特拉津对于3升体积的阿特拉津质量浓度10 mg/L的溶液而言,在进水流量109 L∙h−1,微波功率400 W,紫外光波长254 nm,辐射出度3 × 9.79 mW∙(cm2) −1,催化剂量150 g的条件下,辐照60 min后去除率可达94%。
还原法主要有纳米零价铁作为还原剂 [8] [9] [10] [11] [12] 。在纳米零价铁还原体系中,阿特拉津的去除效率受pH值影响强烈。pH值相对越低,去除率越高,说明H+的存在有利于阿特拉津的去除。随反应时间延长,阿特拉津的降解率增大,到一定时间后达到平衡。对于初始阿特拉津还原法主要有:纳米零价铁质量浓度为15.0 mg∙L−1时去除率可达80%以上。
氧化法主要有双氧水氧化催化 [13] [14] [15] 、过硫酸盐(PDS)氧化催化法 [16] [17] [18] [19] 。其中过硫酸盐氧化催化在介质初始pH = 6.5、1 mL PDS (初始浓度为2.0 mmol∙L−1)、Fe粉加入量为28 mg的条件下,反应60 min后,Fe0/PDS体系对100 mL 浓度为0.10 mmol∙L−1阿特拉津的降解率达到99.0%,远高于Fe0、PDS、Fe2+/PDS和Fe3+/PDS四种体系对阿特拉津的降解率。铁量相同的不同体系对阿特拉津的降解能力为:Fe0/PDS > Fe2+/PDS > Fe3+/PDS。研究认为,在该降解反应体系中生成了两种活性自由基中间体
∙和∙OH,它们是有效降解阿特拉津的活性成分。
比较以上光催化法、氧化法、还原法对阿特拉津的降解效果,以及实际水土环境中的氧化性介质环境,有必要对催化氧化法降解农药的方法进一步开展试验研究和过程机理探索,以更好地用于农田土壤体系中残留农药分子的降解无害化治理与修复,因此本研究拟对铁粉催化过硫酸盐去除阿特拉津的试验开展系统深入的研究。
2. 材料与方法
2.1. 实验原料及仪器
本试验研究所用原料有:正己烷(A.P.)购自阿拉丁公司,过硫酸钠(A.P.)购自阿拉丁公司,800目细度的铁粉购自莱芜钢厂,去离子水(试验室自制),阿特拉津粉末(A.P.)购自阿拉丁公司,盐酸(A.P.)和氢氧化钠(A.P.)均采用分析纯试剂配制溶液。主要分析仪器为气相色谱仪(SP-3420A,北京北分天普仪器技术有限公司),实验室pH计(仪器型号为PHSJ-3F产于上海精科科技有限公司),电子天平(型号为AUY220产于日本岛津公司)、移液枪(大龙科技有限公司产)。
2.2. 实验操作及分析检测方法
1) 降解实验及萃取取样方法
称取0.01 g的阿特拉津粉末用少量乙醇溶解后,倒入1 L容量瓶中加入去离子水配制10 mg∙L−1的阿特拉津溶液;称取1 L浓度为10 mg∙L−1的阿特拉津原液于烧杯中,分别向其中依次加入过硫酸钠、铁粉,开动机械搅拌器搅拌,反应一段时间后取样,将反应后的溶液pH回调至6附近,采用正己烷萃取富集分离水溶液中的阿特拉津,萃取余液再用少许正己烷萃取2次以上,将以上萃取有机相合并、定容后送气相色谱检测分析阿特拉津浓度。
将阿特拉津溶液用盐酸和氢氧化钠溶液分别调溶液pH为12、5、4、3、2、1后,再用正己烷1次萃取后的检测结果如下:
从图1中可见,pH值越低,正己烷对阿特拉津的萃取效果越差。pH值在5~6之间时,对萃取效果影响不大,但是当pH值小于5时,萃取效果大大降低。因此需将反应后溶液pH值回调至6再用正己烷萃取为宜。
2) 检测方法
用移液枪取3 ml的正己烷溶液与3 ml的生成物溶液放入试管中充分震荡5分钟后,提取上层负载阿特拉津的正己烷,将萃取后的溶液取1.5 ml用气相色谱仪进行检测。气相色谱参数设置:柱箱起始温度100℃,进样器温度250℃,柱箱保持温度300℃,检测液以10℃/min的速率升温,结束温度250℃,保温时间3分钟。
本研究工作的实验中将分别讨论初始pH值(7.61、6、5、4、1.88)、温度(20℃、25℃、30℃、35℃、40℃)、铁粉含量(0.625 g、1.25 g、2.5 g、3.75 g)、过硫酸钠含量(2.5 g、5 g、7.5 g、10 g、12.5 g、15 g)、时间(30 min、60 min、90 min、120 min、180 min)对阿特拉津去除率的影响。
2.3. 降解效果的评价公式
降解反应前后的溶液中阿特拉津浓度检测之后,可以按照下式来计算评估降解的效果。
 调节溶液pH的操作条件:取80 ml的阿特拉津溶液,用盐酸和氢氧化钠溶液调节其pH,然后萃取、测试,萃取时间5 min,萃取温度25℃。
调节溶液pH的操作条件:取80 ml的阿特拉津溶液,用盐酸和氢氧化钠溶液调节其pH,然后萃取、测试,萃取时间5 min,萃取温度25℃。
Figure 1. Effect of pH on extraction rate of n-hexane extraction atrazine solution
图1. pH值对正己烷萃取阿特拉津溶液萃取率的影响
R—阿特拉津的去除率,%;C0—初始阿特拉津浓度,mg/L;C—反应后阿特拉津浓度,mg/L。
3. 结果与讨论
3.1. 初始pH值的影响
图2中可见,阿特拉津的去除率随初始pH值的增加而缓慢增加。当初始pH值到达6以后,阿特拉津的去除率也趋于一个最高值。从图中可以发现,似乎溶液pH值对降解效果有着很大的影响。在我们的试验过程中监测发现,以上不同初始pH的溶液体系,一旦铁粉和过硫酸钠添加后,其pH值会立即快速下降到接近2~3左右,且随着铁粉量、过硫酸钠量的增加而降低到更加酸性。因此,铁粉和过硫酸盐的同时存在很容易导致溶液体系变成较强的酸性状态,因此,这也可以理解图2中不同的初始pH情况下阿特拉津的降解效率却较为相同的原因,因为实际的反应体系中溶液pH值几乎都在2~3左右,即使初始溶液pH值不同。因此,从实际应用过程而言,需要考虑到应用环境对如此高的酸性的耐受性问题,避免引起二次危害。
3.2. 铁粉用量的影响
从图3中可以看出,铁粉用量适量少时,可以大大提高降解率,量多时反而显著降低降解率。造成这一现象的原因可能是铁粉除了活化过硫酸钠产生活性硫酸根,还会和过硫酸钠氧化反应造成过余消耗,导致阿特拉津的降解率降低。不加铁粉,单靠过硫酸盐降解,其效果也较低,但是略为添加一点儿铁粉,却可以显著提高氧化降解效果,可见铁粉作为催化剂的良好效果。铁粉用量只需要一点点,这给实际应用过程带来了成本上的极大便利。
3.3. 过硫酸钠用量的影响
图4显示,随着过硫酸钠量的增加,对阿特拉津的去除率也显著提升,而到了一定程度之后即达到了最高效率,并保持不变。过硫酸钠的量,经过换算之后可见其使用量是非常可观的,这会显著增加使
 反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、过硫酸钠加入量7.5 g、铁粉加入量5 g、反应时间1 h、反应温度25℃,控制不同初始pH。
反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、过硫酸钠加入量7.5 g、铁粉加入量5 g、反应时间1 h、反应温度25℃,控制不同初始pH。
Figure 2. Effect of initial pH on the degradation rate of atrazine
图2. 初始pH值对阿特拉津降解率的影响
 反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、过硫酸钠加入量10 g、初始pH = 6、反应时间24 h、反应温度25℃,控制不同铁粉加入量。
反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、过硫酸钠加入量10 g、初始pH = 6、反应时间24 h、反应温度25℃,控制不同铁粉加入量。
Figure 3. Effect of iron powder addition on atrazine degradation rate
图3. 铁粉的加入量对阿特拉津降解率的影响
用的成本,以及可能会造成水溶液或土壤环境的硫酸盐、钠离子的盐度显著上升。这样的用量,显然不利于避免对环境造成二次危害问题。
3.4. 温度的影响
图5显示,温度对阿特拉津的去除率没有太大影响。由此可以推测,由于铁粉与过硫酸钠的催化氧化反应非常剧烈,极易发生,因此对温度并没有苛刻的要求,这是非常有利于该技术的普遍推广实施的。
 反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、铁粉加入量1.25 g、初始pH = 6、反应时间24 h、反应温度25℃,控制不同过硫酸钠加入量。
反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、铁粉加入量1.25 g、初始pH = 6、反应时间24 h、反应温度25℃,控制不同过硫酸钠加入量。
Figure 4. Effect of sodium persulfate addition on degradation rate of atrazine
图4. 过硫酸钠的加入量对阿特拉津降解率的影响
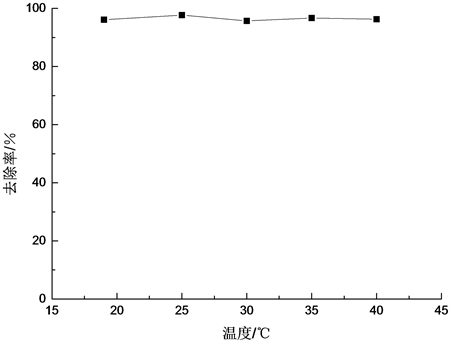 反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量1.25 g、过硫酸钠加入量10 g、反应时间2 h,控制不同反应温度。
反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量1.25 g、过硫酸钠加入量10 g、反应时间2 h,控制不同反应温度。
Figure 5. Effect of temperature on atrazine degradation rate
图5. 温度对阿特拉津降解率的影响
3.5. 反应时间及终点pH的影响
从图6可以看出当反应时间到达30 min后,化学反应已经反应完全,这是极有利于实际降解过程高效率实施的一个反应特征。结合图6和图7可以看出,在30 min前反应pH值剧烈变化,而30 min后pH值缓慢增加正好对应30 min后阿特拉津的去除率基本不变的规律,也就是说当反应终点pH值不再变化时,化学反应已经基本反应完全。其中在30 min前pH值急剧下降是因为过硫酸钠与铁粉和水反应生成
 反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量0.625 g、过硫酸钠加入量10 g、反应温度25℃,控制不同反应时间。
反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量0.625 g、过硫酸钠加入量10 g、反应温度25℃,控制不同反应时间。
Figure 6. Effect of time on degradation rate of atrazine
图6. 时间对阿特拉津降解率的影响
 反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量0.625 g、过硫酸钠加入量10 g、反应温度25℃,控制不同反应时间,记录每个时间对应的pH值。
反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量0.625 g、过硫酸钠加入量10 g、反应温度25℃,控制不同反应时间,记录每个时间对应的pH值。
Figure 7. Relationship between time and endpoint pH
图7. 时间与终点pH的关系
了硫酸,而30 min后pH值缓慢上升可能是因为Fe粉与H+反应生成了H2消耗了部分H+造成的。使用该方法的环境体系中,溶液pH值会显著降低,即迅速提升体系的酸度,显然这很可能会引起环境的酸化,比如水体酸化、土壤酸化,显然这是不利于该技术推广使用的一个限制性特点。
3.6. 扫描电镜图(SEM)
从图8中可以看出,作为反应物原料铁粉表面光滑,而经过催化降解形成的产物粉末颗粒表面则粗糙多孔,可能是因为催化降解过程中的Fe粉颗粒变成了Fe3+,使铁粉表面腐蚀形成了坑洞状的粗糙形貌。

 (a) 铁粉原料 (b) 催化氧化生成物反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量1.25 g、过硫酸钠加入量12.5 g、反应时间24 h、反应温度25℃,过滤生成物后洗涤3次,收集生成物沉淀。
(a) 铁粉原料 (b) 催化氧化生成物反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量1.25 g、过硫酸钠加入量12.5 g、反应时间24 h、反应温度25℃,过滤生成物后洗涤3次,收集生成物沉淀。
Figure 8. SEM image of iron powder raw materials and reaction products in the degradation of atrazine
图8. 降解阿特拉津反应中铁粉原料及反应产的SEM图
3.7. 能谱分析(EDS)
从图9中可以看出反应物铁粉中没有其他杂质。经过催化降解之后的生成物中则有Fe和O,可能是生成了氢氧化铁沉淀,而反应产物中的Na和S则来自过硫酸钠。
3.8. X射衍射分析(XRD)
图10可见,作为反应物原料的铁粉只有铁金属相,而经过催化降解后的生成物的XRD图谱则部分与Fe(OH)3、Fe的PDF卡片吻合,这也和能谱分析数据相一致,因此可以推断经过催化氧化后的生成产物应为Fe(OH)3和未反应完的Fe粉。
3.9. 催化降解机理探讨
根据诸多公开的文献报道,对于本反应体系的催化降解机理,很可能遵循的反应过程为:过硫酸钠和铁粉反应产生了活性硫酸根
∙,从而氧化去除水溶液中的阿特拉津。因为在铁粉过多时不利于阿特拉津的降解,而降低铁粉量会增加阿特拉津的去除率,继而可以推测出起主导作用并不是以下的反应,即:
而真正起主导作用的,应该是铁粉催化过硫酸盐自身分解产生活性硫酸根:
虽然过硫酸钠可以加热活化自我分解,但是铁粉与过硫酸钠反应可以催化过硫酸钠分解产生更多的活性硫酸根,和阿特拉津反应,从而去除阿特拉津。前人工作普遍认为,活性硫酸根与阿特拉津反应的机理大致认为有三种,有取代氢基、添加氢基和电子转移 [20] 。在本研究工作的反应体系而言,更可能发生的反应是电子转移,阿特拉津与活性过硫酸根反应使碳氮环变成活性碳氮环自由基,活性碳氮环自由基再和水反应,使自由基上的氯被羟基取代,从而达到使阿特拉津无毒化的目的,其降解反应式如图11所示。
4. 结论
一、铁粉和过硫酸钠组合使用,可以迅速、高效率地降解水中的阿特拉津分子。影响以上降解效果
 (a) 铁粉原料
(a) 铁粉原料 (b) 催化氧化生成物反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量1.25 g、过硫酸钠加入量12.5 g、反应时间24 h、反应温度25℃,过滤生成物后洗涤3次,收集生成物沉淀。
(b) 催化氧化生成物反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量1.25 g、过硫酸钠加入量12.5 g、反应时间24 h、反应温度25℃,过滤生成物后洗涤3次,收集生成物沉淀。
Figure 9. EDS diagram of reactants and products in the degradation of atrazine
图9. 降解阿特拉津反应中反应物与生成物的EDS图
 反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量1.25 g、过硫酸钠加入量12.5 g、反应时间24 h、反应温度25℃,过滤生成物后洗涤3次,收集生成物沉淀。
反应条件:10 mg∙L−1初始浓度的阿特拉津原液1 L、初始pH = 6、铁粉加入量1.25 g、过硫酸钠加入量12.5 g、反应时间24 h、反应温度25℃,过滤生成物后洗涤3次,收集生成物沉淀。
Figure 10. XRD patterns of iron powders and products in the degradation of atrazine
图10. 降解阿特拉津反应中反应物铁粉与生成物的XRD图

Figure 11. Schematic diagram of the atrazine molecule degraded by iron powder catalyzed by sodium persulfate
图11. 铁粉催化过硫酸钠氧化降解阿特拉津分子示意图
的主要反应因素是铁粉、过硫酸钠用量。二、试剂的加入会迅速导致溶液pH下降至2~3左右,因此初始溶液pH值对降解反应效果的影响并不大。铁粉的作用在于催化过硫酸钠,产生活性硫酸根,氧化降解阿特拉津分子。过多的铁粉,会显著导致降解效果降低,原因在于造成过硫酸钠的氧化消耗。
致谢
本项目得到了北京科委基金的资助(项目名:生物质纳米零价铁的制备及其在农田残留农药降解的应用),特此感谢。
NOTES
*通讯作者。