1. 引言
钩端螺旋体(简称钩体)是钩端螺旋体病(简称钩体病)的病原体。钩体病是一种自然疫源性传染性疾病,属和猪类是两大主要传染源。主要通过接触疫水、疫土而发生感染。其流行几乎遍及全世界,在东南沿地区尤为严重。我国大多数省、市自治区都有本病存在和流行。临床特点为起病急,早期有高热,全身酸痛,软弱无力,结膜充血,腓肠肌压痛,表浅淋巴结肿大等钩体毒血症。后可伴肺出血、肝出血等全身出血倾向。肺弥漫性出血、心肌炎、溶血性贫血等与肝、肾衰竭为常见致死原因。目前预防和控制钩体病的主要方法是疫苗的接种。钩体疫苗主要有死疫苗,基因工程疫苗等,但现有的钩体疫苗只对同血清型钩体的感染有保护作用,对不同血清型的钩体缺乏交叉保护作用。研制有交叉保护作用的钩体疫苗具有重要的意义。研究表明钩体外膜蛋白Loa22是一种比较理想的疫苗候选分子,具有高度保守性 [1] [2] 。前期研究已发现钩体外膜蛋白Loa22有良好的免疫原性,对同血清型钩体的感染具有保护作用 [3] 。体外实验也证实钩体外膜蛋白Loa22免疫血清可以阻断钩体黏附Raw264.7细胞,对细胞起到保护作用 [4] 。而且钩体外膜蛋白Loa22免疫血清与不同血清型钩体具有良好的交叉免疫反应性 [5] 。本实验在豚鼠体内对钩体外膜蛋白Loa22免疫血清与我国主要流行的不同血清型钩体的交叉免疫保护作用进行进一步探讨和研究,为钩体疫苗分子的筛选提供理论依据。
2. 实验材料与方法
2.1. 实验材料
菌株和重组质粒,问号犬群犬56,603株、致热群致热型56,605株、澳洲群澳洲型56,607株、波摩那群波摩那型56,608株、流感伤寒群临海型56,609株、七日群七日热型56,610株和明尼群明尼型56,655株。PQE31-Loa22本实验室保存。
2.2. 实验动物
健康豚鼠,体重50 g,50只。
2.3. 实验主要试剂
蛋白分子预染marker、Ni-NTA、IPTG、抗体和EMJH培养基等主要试剂。
2.4. 实验方法
1) 重组蛋白Loa22的表达,将重组质粒PQE31-Loa22转化于大肠杆菌M15,取菌落于培养液中37℃诱导过夜培养。37℃、IPTG 9 h后,13,000 rpm、10分钟离心收集菌体。重组蛋白经Ni-NTA亲和层析柱纯化,取纯化蛋白进行SDS-PAGE分析。
2) 重组蛋白Loa22的Western-blot鉴定,对纯化蛋白Loa22用鼠抗His为一抗,羊抗鼠为二抗,进行Western-blot鉴定。
3) 豚鼠交叉免疫保护试验,健康豚鼠30只,分成3组:第一组为Loa22蛋白免疫组,第二组为LipL32阳性对照组。第三组为PBS阴性对照组。第一次免疫:蛋白Loa22、LipL32阳性对照和PBS阴性对照各50 ug加等量的佐剂从豚鼠的腋下、腹股沟及背部进行免疫。相同的方法进行第二次和第三次免疫,每次间隔2周。最后一次免疫后2周进行不同血清型钩体攻击豚鼠,采用活的问号犬群犬56,603株、致热群致热型56,605株、澳洲群澳洲型56,607株、波摩那群波摩那型56,608株、流感伤寒群临海型56,609株、七日群七日热型56,610株和明尼群明尼型56,655株进行攻击豚鼠。不同血清型的钩体株分别经传代,EMJH培养基28℃培养,培养3天后,用培养基调整钩体株浓度达2 × 109/ml,1 ml的不同血清型钩体株经腹腔注射攻击豚鼠。连续攻击15天,观察各组豚鼠的发病情况,并对各组豚鼠的肝、肺、肾进行病理切片观察病理变化。对外膜蛋白Loa22的交叉免疫保护作用进行评价。
3. 实验结果
3.1. 重组蛋白Loa22的表达的SDS-PAGE、Western-Blot鉴定
PQE31-Loa22重组质粒在大肠杆菌M15表达9小时,37℃诱导在上清表达,不带质粒的空菌和带载体质粒的大肠杆菌不表达,无条带(图1),经SDS-PAGEA鉴定分子量为Loa22蛋白的大小。
 1: Protein Marker, 2: induced E.coilM15, 3: induced bacterial with PQE31/Loa22, 4: induced bacterial with PQE31
1: Protein Marker, 2: induced E.coilM15, 3: induced bacterial with PQE31/Loa22, 4: induced bacterial with PQE31
Figure 1. SDS-PAGE analysis of recombinant protein Loa22
图1. 重组蛋白Loa22的SDS-PAGE分析
3.2. Western-Blot鉴定
Loa22蛋白诱导产物进行Western-blot鉴定,结果显示在目的位置出现单一特异性条带,而对照组未出现条带(图2)。
 1: indu2ed bacterial with PQE31/Loa22, 2: induced E.coilM15, 3: induced bacterial with PQE31
1: indu2ed bacterial with PQE31/Loa22, 2: induced E.coilM15, 3: induced bacterial with PQE31
Figure 2. Withern-blot identification of recombinant protein Loa22
图2. 重组蛋白Loa22的Weatern-blot鉴定
3.3. Loa22蛋白的纯化
蛋白Loa22过Ni-NTA柱亲和层析纯化,SDS-PAGE分析分子量为22kDa的单一条带,见图3。
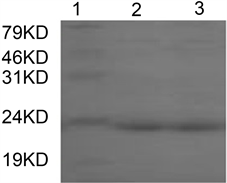 1: Protein Marker, 2-3: purified Loa22 protein
1: Protein Marker, 2-3: purified Loa22 protein
Figure 3. Loa22 protein purification SDS-PAGE results
图3. Loa22蛋白纯化SDS-PAGE结果
3.4. 豚鼠交叉免疫保护性结果
3.4.1. 不同血清型钩体感染各免疫组豚鼠的发病情况及保护情况观察
蛋白Loa22免疫组的豚鼠在受不同血清型钩体的攻击过程中,未出现厌食,活动等反应正常,于第9天死亡1只豚鼠。PBS免疫组的豚鼠在攻击中,均出现厌食,懒动等表现。于第3天死亡豚鼠2只,第6天死亡4只,第7天死亡4只。Lip32蛋白免疫组豚鼠受钩体攻击也未出现厌食,懒动等表现,于第10天死亡2只。各组的交叉保护率见表1。

Table 1. Protection of guinea pigs in different immunized groups after infection with different serotypes
表1. 不同血清型钩体感染后各免疫组豚鼠的保护情况
3.4.2. 免疫组豚鼠的肺、肝、肾的病理切片结果(见图4)
肺:PBS免疫组的豚鼠肺病理切片显示肺泡腔内有出血;Loa22蛋白及LipL32蛋白免疫组肺脏未见明显改变。肝:PBS免疫组的豚鼠肝病理切片显示肝细胞肿胀,排列无序。肝中央静脉充血;Loa22蛋白及LipL32蛋白免疫组肝脏未见明显改变。肾:PBS免疫组的豚鼠肾病理切片显示肾小球囊腔内有出血;Loa22蛋白及LipL32蛋白免疫组肾小球未见明显改变。
4. 结论
钩端螺旋体病分布很广,几乎全世界各地都有此病的存在或流行。在我国已发现25个省、区有钩端螺旋体病人或带菌动物。目前全世界已发现钩体有20个血清群,200多个血清型,我国至少发现了18个血清群,70多个血清型。迄今我国大陆地区流行的问号钩体血清群和血清型中,以黄疸出血群赖型流行最广,其次是流感伤寒、秋季群秋季型、波摩那群波摩那型、七日热群七日热型和澳洲群澳洲型等 [6] 。疫苗是目前控制钩体病最有效的措施,作为钩体疫苗抗原分子,必须分布广且序列保守,如此才能对不同血清型钩体产生广泛的免疫保护作用 [7] 。研究证实,非致病的腐生性钩体三宝垄群Patoc型Patoc1株未检出Loa22基因,我国大陆地区流行的6个血清群型问号钩体株中均扩增出Loa22基因,L. borgpetersenii基因种爪哇群爪哇型M10株和L. weilii基因种曼耗群清水型L105株中也能扩增出Loa22基因,提示该基因广泛存在于我国致病性钩体中。测序及序列分析结果显示,上述loa22基因片段核苷酸和氨基酸序列相似性高达85.5%~99.8%和93.9%~99.5%。因此,Loa22基因表达产物可作为我国钩体疫苗分子。
研究已证实问号状钩端螺旋体外膜蛋白Loa22的免疫血清对同血清型钩体具有免疫保护作用。与问号犬群犬56,603株、致热群致热型56,605株、澳洲群澳洲型56,607株、波摩那群波摩那型56,608株、流感伤寒群临海型56,609株、七日群七日热型56,610株和明尼群明尼型56,655株在体外也具有良好的免疫反应性。本实验用纯化的钩体外膜蛋白Loa22免疫豚鼠,使豚鼠产生Loa22蛋白的特异性抗体,并测定抗体效价。同时用上述的不同血清型的6株钩体对豚鼠进行攻击。观察攻击后的豚鼠的表现,对Loa22蛋白的免疫保护作用进行研究。研究发现Loa22免疫蛋白能抵抗不同血清型钩体对豚鼠的攻击,对豚鼠能起到一定的保护作用。钩体外膜蛋白Loa22对不同血清型钩体能起到交叉免疫保护作用。钩体外膜蛋白Loa22是一良好的疫苗候选分子。但钩体血清型众多,本实验只研究了外膜蛋白Loa22对以上6株钩体的免疫保护作用,其他血清型钩体的免疫保护作用有待进一步研究。
基金项目
本研究由遵义市科技局资助项目(遵市科合社字(2014)05号)支持。