1. 引言
随着经济、社会的不断发展,富含氮磷等营养物质的工业、生活污水大量排入水体,导致水体恶化。如何利用生物方法经济有效地去除水体中的氮磷,成为目前国内外水污染控制研究的一个热点 [1] 。近年来,很多研究表明菌藻共生系统在污水处理方面潜力巨大,利用菌藻修复污染水体,可以有效降低污水中有机物和氮磷的含量,出水可达到景观环境用水的水质标准 [2] [3] [4] [5] 。
现有的研究主要考察了菌藻共生系统内参数改变对于污染物去除效果的影响。严清等发现,对菌藻进行固定化处理可提高对氮磷的去除效果 [2] 。毛书端等报道了菌藻共生系统的最佳氮磷比与碳氮比分别为5:1和35:1 [6] 。Lee et al.研究指出,将系统光暗比调为60 h:12 h时可提高污染物去除效果 [4] 。
然而,研究者更多关注污水处理效果的获得,对于整个污水处理过程中菌藻关系的变化却少有深入研究。菌藻数量变化与生物群落组成类似,是一个生态系统结构的组成部分。菌藻数量的变化与代谢功能的关系,是评价菌藻生态功能状况的一个重要的参数。此外,大多数研究中的细菌取自污水处理厂中活性污泥 [4] [7] 或者污水中的菌群 [6] [8] ;而不同污水处理厂生长的菌群不同,使得研究缺少普适性。
因此,本文从单菌单藻共生系统着手,选取研究中常用的普通小球藻和广泛应用于污水处理领域的枯草芽孢杆菌作为模式生物构建菌藻系统,探究在菌藻的投加比、投加量、投加次序、固定化等条件相应改变时,菌藻关系的变化及其对污水处理的影响,以期利用菌藻关系对污水处理效果进行调控。
2. 材料与方法
2.1. 试验材料
普通小球藻(Chlorella vulgaris)购于中国科学院武汉水生生物研究所,用BG11培养基无菌接种,在25℃ ± 1℃,光强2000 lux,光暗比12 h:12 h的条件下培养。每天定时摇动两次,培养至稳定期用于试验。
枯草芽孢杆菌(Bacillus subtilis)购于中国工业微生物菌种保藏管理中心(CICC),用营养肉汁培养基无菌接种,在37℃下培养至稳定期用于试验。
为消除实际污水中可能存在的化合物对测定结果的干扰,本试验采用自配污水,在无菌去离子水中加入C6H12O6、NH4Cl、KH2PO4、MgSO4·7H2O、NaCl、FeSO4、ZnSO4及A5溶液,其水质COD = 400 mg/L、
= 40 mg/L、TP = 8 mg/L。
2.2. 试验方法
2.2.1. 干重测定
试验菌藻按照干重投加。取20 mL菌/藻液加入已预先烘干和称重的50 mL离心管,3500 r/min条件下离心10 min,弃除上清液后在105℃烘箱中烘干4 h,测定干重(式1)。每个样品做两个重复,计算其平均值。
菌/藻干重(g/L)
(1)
式中,W1为离心前离心管重(g);W2为烘干后重(g);V为所取水样体积(L)。
2.2.2. 菌藻固定化小球制备方法
菌/藻液在室温,3500 r/min条件下离心10 min,弃除上清液,用去离子水冲洗、离心两次,除去细胞表面残留的无机盐。通过计算取一定体积的藻类细胞浓缩液,与预先灭菌的4% (W/V)的海藻酸钠溶液均匀混合,形成约2% (W/V)的混合液;用带12号针头的针管滴入到2% (W/V)的CaCl2的溶液中,连续搅拌2 h,取出后用去离子水浸泡1 h脱盐,制成直径约为4 mm固定化小球。
2.2.3. 菌藻关系研究试验
本试验初始菌藻投加量设置两个浓度,分别为0.125、0.5 g/L (菌)和0.03、0.125 g/L (藻)。同批试验设置单菌或单藻作为空白对照。
按照菌藻配比混合置于200 mL自配污水中,在25℃ ± 1℃,光强为2000 lux,光暗比为12 h:12 h的光照培养箱中静态培养,每日早晚各摇一次,试验周期7天,每日定时监测水质指标及菌藻数量变化。
在考察投加次序对菌藻生长情况影响时,试验初期先加入菌(藻),间隔1天后再加入藻(菌)。测定菌藻固定化小球的生长等生理特性测定时需先脱固定化,取一定数量的小球放入1.5%的柠檬酸钠化解液的加盖离心管中,摇动直至胶球完全溶解成悬浮状,测定菌藻数量。
2.3. 测定方法
本文中氨氮采用纳氏试剂分光光度法 [9] 测定,总磷采用钼酸铵分光光度法 [9] 测定,COD采用重铬酸钾消解后比色法测定(哈希,DR200/890)。细菌计数采用平板计数法,藻类计数采用血球计数板法 [10] 。
3. 结果与讨论
3.1. 藻菌对共生系统中菌藻各自生长情况的影响
藻菌的添加对菌藻数量变化的影响如图1所示。从图1(a)可以看出,在接种初始普通小球藻量相同的情况下,藻细胞的数量在培养的0~2天期间呈上升趋势;单藻在培养2 d后进入稳定期,枯草芽孢杆菌的添加使得达到稳定期的时间延长为3 d。而当藻生长进入稳定期后,单藻的藻细胞生长出现衰亡现象,藻细胞数量开始降低;而添加枯草芽孢杆菌的藻菌共生系统中,藻细胞数量较稳定维持在3 × 108个/mL水平,高于单藻的藻细胞数量(2.5 × 108个/mL)。该结果表明,枯草芽孢杆菌的加入使得藻的生长更稳定。添加细菌越多,达到稳定期的时间越长,稳定期的藻数量值越高。这提示了枯草芽孢杆菌的添加对藻的生长有一定的促进作用。
图1(b)为枯草芽孢杆菌数量变化情况。单纯的枯草芽孢杆菌在培养1 d以后菌数量激增,进入稳定期后(6.1 × 107 CFU/mL)随即开始衰亡,培养后期降至3.0 × 107 CFU/mL。当向枯草芽孢杆菌中添加普通小球藻时(藻0.03 g/L),细菌数量在整个培养期内基本维持在接种数量水平,未表现出明显增殖现象。再继续增加初始添加藻浓度为0.5 g/L时,细菌生长迟滞期延长为2 d,后进入对数增长期,于培养第5 d达到最大值,约为7.5 × 107 CFU/mL,约为单菌同时期数量的2倍。
该结果表明菌藻共生系统中藻的投加对细菌生长有影响,在藻投加量低时会持续抑制细菌生长,而投加量高时会促进细菌的后期生长及稳定。这可能是因为,初期少量藻的添加并不能建立藻菌互利的共生系统,普通小球藻此时对枯草芽孢杆菌来说表现为营养物质的竞争者。当添加的藻增加时,藻菌达到氧气、二氧化碳及营养物质利用的平衡,表现出较好的生长趋势。
有研究表明,在取自污水厂的菌群中添加小球藻,会不同程度促进细菌数量增长,且随着投加藻量的增加效果逐渐降低 [11] 。该结论与本研究结果不一致,分析原因可能是由于不同种细菌与普通小球藻达到共生关系的数量比不同;混合菌群中细菌种类众多,从而整体上呈现促进效果。当枯草芽孢杆菌作为系统中唯一菌种时,小球藻对其呈现高浓度促进,低浓度抑制其生长的现象。这提示了在单菌单藻体系中深入研究菌藻关系的必要性。

Figure 1. Influence of algae and bacteria on the number of symbiotic bacteria and algae
图1. 藻菌对共生菌藻数量变化的影响
3.2. 不同接种量对菌藻生长情况影响
菌藻共生系统中菌藻比例影响其共生关系。藻类的光合成反应,就是在阳光能量下的细胞增殖与放氧反应,Stumm提出,藻类的分子式近似为C106H263O110N16P,则藻类的光合成反应式如式1所示。类似的,枯草芽孢杆菌的分子式近似为C5H7O2N,其合成反应式如式2所示 [12] 。菌藻共生系统中O2的传递是重要的环节,假定藻类产生的O2可完全被细菌所利用,即式1中的产氧量与式2中的耗氧量相等。此时可得系统理论菌藻比为3.53:1。有研究显示地衣芽孢杆菌与普通小球藻在数量比3:1时,对于COD、氨氮、总磷去除率最优 [13] ,与计算结果相近。考虑O2传递效率等因素影响,本文采用菌藻比4:1进行试验。
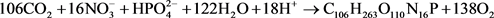 (2)
(2)
(3)
在此菌藻比例下,不同投加量对菌藻数量变化的影响如图2所示。当菌藻高浓度接种时(菌 = 0.5 g/L藻 = 0.125 g/L),菌藻数量均呈增长趋势,稳定期可达3.0 × 107个藻细胞/mL;而枯草芽孢杆菌在试验期内尚处在对数增长期,培养第6 d时细菌浓度达到9.0 × 107 CFU/mL。而当菌藻浓度降低四倍接种时(菌 = 0.125 g/L藻 = 0.03 g/L),菌藻数量在整个培养期内基本维持在初始投加水平,未表现明显的增长现象。据此可以认为,藻菌投加量对于藻菌数量变化影响较大。藻菌初始投加浓度只有达到一定阈值以上,才可能达到菌藻共同生长的状态。

Figure 2. Influence of different initial inoculation quantity on the number of bacteria and algae in symbiotic system
图2. 不同初始投加量对共生系统中菌藻数量的影响
3.3. 投加次序对菌藻生长情况的影响
在普通小球藻或枯草芽孢杆菌单独培养1 d后再投加菌或藻,考察投加次序对菌藻生长情况的影响。投加次序对普通小球藻数量影响如图3(a)所示。在普通小球藻培养1 d后,分别投加两组不同浓度的枯草芽孢杆菌(菌浓度为0.5 g/L和0.03 g/L)。培养过程中发现,藻数量在前2~3天均呈上升趋势,后分别稳定在2.0 × 108个/mL和1.8 × 108个/mL。而当藻菌同时投加时,其最终藻数量均稳定在2.8 × 108个/mL左右。结果表明,枯草芽孢杆菌的投加时机对普通小球藻生长稳定期的最大值有影响。延迟细菌的投加,会阻碍菌藻共生效果的最大化;同步投加菌藻,可使藻类生长得到一定程度的促进作用,且这个影响是持续性的,会影响藻类最终数量。
投加次序对枯草芽孢杆菌数量影响如图3(b)所示。枯草芽孢杆菌培养1 d后投加0.5 g/L的普通小球藻,细菌数量在0~5天呈上升趋势,数量由1.4 × 105 CFU/mL增长至7.0 × 107 CFU/mL。类似的,细菌培养1 d后投加低浓度普通小球藻(0.03 g/L),细菌数量在0~2天呈上升趋势,后保持稳定,数量由1.4 × 105 CFU/mL增长至4 × 105 CFU/mL,增长不明显。相比于同时投加菌藻,延迟投加藻种时,细菌在对数增长期的增长速度更快,但稳定期所达的最大值仍低于同时投加菌藻组。
综合以上结果可以看出,改变投加次序会影响系统菌藻数量变化,虽然先投加的微生物初期生长速度较快,但其最终数量会低于同时投加组,这与菌藻共生机理有关。首先,细菌可以提供足够的CO2,这有助于藻类在初期适应污水水质和快速生长。其次,细菌参与了污染物降解过程并将复杂的底物转化为小分子使有机酸分子和氨等可以很容易被藻类吸收。最后,细菌也会吸收藻类释放的O2、维生素、溶解性有机碳等生长因子,促进自身生长 [14] [15] 。因此,只有同时将菌藻投加,才能使菌藻共生系统达到最优效果。

Figure 3. Influence of inoculation sequence on the number of bacteria and algae
图3. 投加次序对菌藻数量的影响
3.4. 污染物去除效果
在确定了最优投加量及投加次序基础上,考察了固定与悬浮态菌藻共生系统对污水中污染物去除效果,结果如图4所示。固定态菌藻共生系统对于COD、氨氮和总磷去除率分别为99.2%、92.2%和73.1%;而相同投加量下悬浮组COD、氨氮和总磷去除率为66%、44%和10%。
这表明固定化菌藻系统展现了良好的协同作用,与悬浮态相比,大幅提高了系统对于COD以及氮磷的去除效果。研究认为固定化载体可以富集周围环境中的营养物,提高了菌藻细胞的合成代谢活性 [8] 。
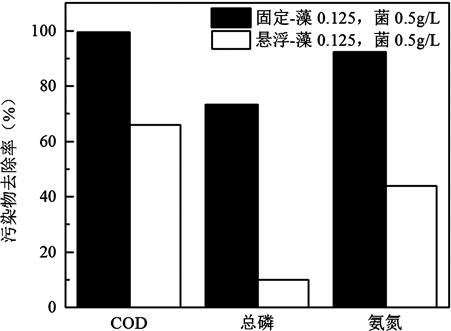
Figure 4. Comparative effect of suspension and immobilized bacteria-algae system on pollutant removal
图4. 悬浮态与固定化菌藻系统对污染物去除效果对比
4. 结论
本文讨论单菌单藻共生系统的投加量、投加次序对于菌藻数量变化的影响,并对比了优化条件下固定化与悬浮状态下菌藻共生系统对于污染物的去除效果,得到结论如下:
1) 枯草芽孢杆菌和普通小球藻的添加可以影响对方的生长规律。枯草芽孢杆菌初始浓度为0.125 g/L时,藻类的添加对枯草芽孢杆菌数量变化呈低浓度抑制、高浓度促进的效果。
2) 菌藻初始投加浓度存在一定的阈值,使得菌藻共生系统产生协同作用。
3) 通过海藻酸钠固定后,在菌藻比4:1,投加菌量和藻量为0.5 g/L和0.125 g/L时,菌藻达到共生的最优生长状态;此时对于自配污水的COD、氨氮和总磷去除效果最好。
基金项目
国家自然科学基金资助项目(NO.51738005)。
NOTES
*通讯作者。