1. 引言
肿瘤细胞与正常细胞在葡萄糖代谢方式上差异很大,正常细胞主要是通过氧化磷酸化代谢葡萄糖,为机体提供能量,只有在缺氧的情况下才会启用糖酵解途径。而肿瘤细胞即使在有氧的条件下也会启用糖酵解途径,将大量的葡萄糖转化为乳酸,快速提供ATP供肿瘤细胞增殖 [1] ,同时为核苷酸脂肪、等大分子物质的合成提供原料组建新的肿瘤细胞 [2] [3] ,最终的宏观效应是促进了肿瘤恶性表型。现已发现,有氧糖酵解广泛存在于多种类型肿瘤并与其恶性生物学行为密切相关 [4]。因此,本文在前期研究的基础上,应用3D的培养方式,在常氧、低氧、低氧缺糖的条件下,研究人肺腺癌A549、人胚肺成纤维细胞MRC-5细胞的有氧糖酵解以及养阴扶正汤对人肺腺癌A549有氧糖酵解的干预。
2. 材料与方法
2.1. 材料
人肺癌A549细胞株和人胚肺成纤维细胞MRC-5株购置于武汉博士德生物工程有限公司,3D In Sight™Tumor Maintenance Medium (Insphero公司),Gravity TRAP™ULA培养板(Insphero公司),CCK8试剂盒(万类生物),葡萄糖检测分析试剂盒(Biovision公司),乳酸测定试剂盒(南京建成生物工程研究所),ATP检测试剂盒(南京建成生物工程研究所)。全自动酶标仪(美国Bio-Tek公司)。养阴扶正汤(黄芪、党参、沙参、麦冬、生白术、白花蛇舌草、拳参、茯苓、文术等药物组成)由齐齐哈尔市第一医院制剂室提供。清洁级SD大鼠,雄性,体重250 ± 20 g,由青岛市实验动物和动物实验中心提供,合格证号:SCXK (鲁) 2014-000;动物实验伦理许可证号:2017051008。
2.2. 方法
2.2.1. 含养阴扶方汤药物血清的制备
将SD大鼠随机分为空白药物血清组(等体积生理盐水灌胃)、养阴扶正方低剂量组、中剂量组、高剂量组,分别按大鼠13 g/kg、26 g/kg和52 g/kg浓度分别灌胃给予相应药物4 ml,空白药物血清组给予等体积的生理盐水灌胃,灌胃前禁食12小时,每日早晚2次灌胃,连续给药3天。于末次灌药1小时后,氯胺酮麻醉,无菌条件下腹主动脉采血,无菌分离血清(离心2000 rpm,10分钟),同一条件下动物血清混匀,56℃,30分钟灭活抗体,0.22 μm滤器除菌后分装,−80℃冰箱保存备用。
2.2.2. 细胞培养
1) 3D培养:取对数生长期的A549、MRC-5细胞,胰酶消化,终止消化,调整细胞密度为1.43 × 105个/ml,移液器吸取70 μl缓慢加入提前预湿的培养板内,盖上盖子,250 RCF离心2 min,后置于37℃,5% CO2的培养箱内,3天进行后续实验。2) 常氧培养条件:MRC-5、A549细胞分别用正常MEM、DMEM培养基,在37℃,95%、5% CO2的培养箱中正常条件下培养72 h。3) 低氧培养:MRC-5、A549细胞分别用正常MEM、DMEM培养基,在37℃,5% O2、5% CO2、90% N2缺氧培养箱中培养72 h。4) 低氧缺糖条件:MRC-5、A549细胞分别用正常MEM、DMEM培养基,在37℃,5% O2、5% CO2、90% N2培养箱中培养24 h后,更换为无糖培养基继续培养48 h。
2.2.3. CCK8法检测细胞的增殖活性及PH值的检测
1) CCK8法检测细胞的增殖活性:按试剂盒说明书严格进行操作;2) 将保留的上清液用PH计进行测定,并进行记录。
2.2.4. 葡萄糖消耗量的检测
按试剂盒说明书进行操作。以标准孔的标准品含量为横坐标,OD值为纵坐标,根据标准曲线计算各样本葡萄糖吸收情况。
2.2.5. 乳酸生成量的检测
按试剂盒说明书进行操作,细胞乳酸含量(mmol/gprot) = ((测定OD值 − 空白OD值)/(标准OD值 −空白OD值)) × 标准品浓度(3 mmol/L)/待测样本蛋白浓度(gprot/L)。
2.2.6. ATP生成的检测
按试剂盒说明书进行操作,ATP浓度(μmol/gprot) = (测定OD值 − 对照OD值)/(标准OD值 − 空白OD值)) × 标准品浓度(1000 μmol/L) × 样本测试前稀释倍数/待测样本蛋白浓度(gprot/L)。
3. 统计学方法
采用SPSS 17.0统计软件对数据进行统计分析,两组之间的比较采用Mann-Whitney检验,多组之间比较采用单因素方差分析,数据以x ± s表示。
4. 结果
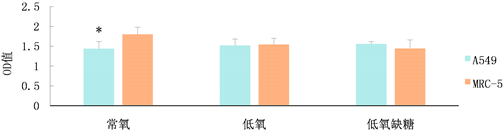
1) 常氧、低氧、低氧缺糖条件下人肺腺癌A549、人胚肺成纤维细胞MRC-5的增殖活性(图1)
在常氧培养条件下,A549细胞增殖能力低于MRC-5细胞(P < 0.05);在低氧培养条件下,A549细胞与MRC-5细胞增殖能力相当(P > 0.05);在低氧缺糖培养条件下,A549细胞与MRC-5细胞增殖能力相当(P > 0.05)。A549细胞在常氧、低氧、低氧缺糖条件下培养,OD值呈升高趋势,表明A549细胞增殖活力逐渐增强,MRC-5细胞常氧、低氧、低氧缺糖条件下培养,OD值呈下降趋势,表明MRC-5细胞增殖活力逐渐减弱。
2) 常氧、低氧、低氧缺糖条件下人肺腺癌A549、人胚肺成纤维细胞MRC-5细胞培养上清液PH值(图2)
在常氧、低氧、低氧缺糖条件下培养,A549、MRC-5细胞培养上清液PH值中比较分别P > 0.05,无统计学差异,表明A549、MRC-5细胞培养上清液PH值无差异,但在常氧、低氧缺糖条件下培养,A549细胞培养液的PH值略低于MRC-5细胞培养液的PH值。
3) 常氧、低氧、低氧缺糖条件下人肺腺癌A549、人胚肺成纤维细胞MRC-5细胞的葡萄糖消耗量以及乳酸的生成量(图3、图4)
在常氧、低氧、低氧缺糖条件下培养,A549细胞对葡萄糖的消耗大于MRC-5细胞P < 0.01,A549细胞的乳酸生成量于MRC-5细胞的乳酸生成量P < 0.05,提示在无论常氧、低氧、低氧缺糖条件下,A549对葡萄糖的利用高于MRC-5细胞,进行有氧糖酵解,A549细胞的乳酸生成量高于MRC-5细胞。
4) 常氧条件下养阴扶正汤对人肺腺癌A549的增殖抑制作用(图5)
在常氧培养条件下,空白血清对A549的增殖无影响,随着养阴扶正方汤药物浓度的增加,对A549的增殖抑制作用亦逐渐增强,高剂量养阴扶正汤药物血清疗效最显著(P < 0.01)。
5) 常氧条件下养阴扶正汤对人肺腺癌A549细胞培养上清液PH值的影响(图6)
在常氧培养条件下,空白血清、低剂量养阴扶正方药物血清、中剂量养阴扶正方药物血清、高剂量养阴扶正方药物血清对人肺腺癌A549细胞培养上清液PH值的无影响(P > 0.05)。
6) 常氧条件下养阴扶正汤对A549细胞的葡萄糖消耗、乳酸生成、ATP生成的影响(图7、图8、图9)
 注:*P < 0.05
注:*P < 0.05
Figure 1. Proliferative activity of A549 and MRC-5 cells under normoxia, hypoxia and hypoxia conditions
图1. 常氧、低氧、低氧缺糖条件下A549、MRC-5细胞的增殖活性
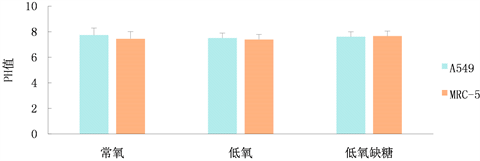
Figure 2. PH values of supernatants of A549 and MRC-5 cell cultures under normoxia, hypoxia and hypoxia conditions
图2. 常氧、低氧、低氧缺糖条件下A549、MRC-5细胞培养上清液PH值
 注:*P < 0.05, **P < 0.01。
注:*P < 0.05, **P < 0.01。
Figure 3. Glucose consumption of A549 and MRC-5 cells under normoxia, hypoxia and hypoxia conditions
图3. 常氧、低氧、低氧缺糖条件下A549、MRC-5细胞的葡萄糖消耗量
 注:*P < 0.05,**P < 0.01。
注:*P < 0.05,**P < 0.01。
Figure 4. Lactate production of A549 and MRC-5 cells under normoxia, hypoxia and hypoxia conditions
图4. 常氧、低氧、低氧缺糖条件下A549、MRC-5细胞的乳酸生成量
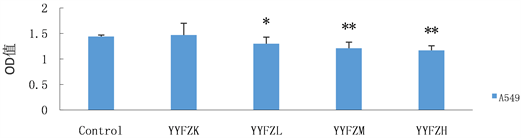 注:*P < 0.05,**P < 0.01,Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
注:*P < 0.05,**P < 0.01,Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
Figure 5. Inhibitory effect of Yangyinfuzheng Decoction on proliferation of human lung adenocarcinoma A549 under normal oxygen condition
图5. 常氧条件下养阴扶正汤对人肺腺癌A549的增殖抑制作用
 注:*P < 0.05,**P < 0.01,Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
注:*P < 0.05,**P < 0.01,Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
Figure 6. Effect of Yangyinfuzheng Decoction on pH value of supernatant of human lung adenocarcinoma A549 cells under normal oxygen condition
图6. 常氧条件下养阴扶正汤对人肺腺癌A549细胞培养上清液PH值的影响
常氧培养条件下,空白血清对A549的葡萄糖消耗、乳酸的生成、ATP的生成无影响(P > 0.05),随着养阴扶正方药物血清剂量的增高,葡萄糖的消耗、乳酸的生成、ATP的生成亦减少,高剂量养阴扶正方药物血清疗效最显著(P < 0.05, P < 0.05),表明养阴扶正方能够抑制A549进行有氧糖酵解。
 注:*P < 0.05,**P < 0.01,Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
注:*P < 0.05,**P < 0.01,Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
Figure 7. Effect of Yangyinfuzheng Decoction on glucose consumption of A549 cells under normal oxygen condition
图7. 常氧条件下养阴扶正汤对A549细胞的葡萄糖消耗量
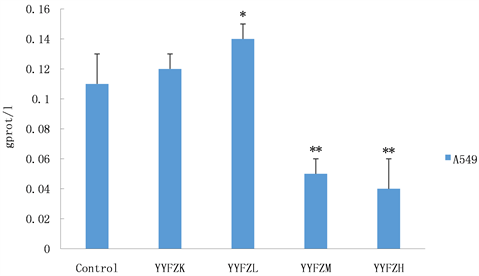 Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
Figure 8. Effect of Yangyinfuzheng Decoction on lactic acid production of A549 cells under normal oxygen condition
图8. 常氧条件下养阴扶正汤对A549细胞的乳酸生成量的影响
 Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
Control:对照组,YYFZK:空白血清组,YYFZL:低剂量养阴扶正汤药物药物血清组,YYFZM:中剂量养阴扶正汤药物药物血清组,YYFZH:高剂量养阴扶正汤药物药物血清组。
Figure 9. Effect of Yangyinfuzheng Decoction on ATP production in A549 cells under normal oxygen condition
图9. 常氧条件下养阴扶正汤对A549细胞的ATP生成的影响
5. 讨论
有氧糖酵解为恶性肿瘤细胞的生长提供了能量及有利的场所,赋予了肿瘤细胞旺盛的生命力,也就是说有氧糖酵解推动了恶性肿瘤的生长。养阴扶正方由黄芪、党参、沙参、天冬、麦冬、生白术、山药、白花蛇舌草、绞股蓝、茯苓、文术等药物组成,具有益气养阴,解毒化瘀散结之功。本课题组前期研究发现养阴扶正方具有明确的抗肺癌的作用,能够改善肺癌患者的临床症状,总有效率76.3%,稳定瘤灶,提高患者的生存质量,减轻化疗毒副反应;抑制人肺腺癌A549细胞的增殖和迁移,促进肺癌细胞凋亡,抑制瘤灶中PI3K、p-AKT的表达、bcl-2蛋白的表达,降低瘤灶N-cadherin、Vimentin、MMP-9、MMP-2的表达,促进bax、野生型p53蛋白增加E-cadherin的作用 [5] [6] [7] 本研究表明,人肺腺癌A549细胞利用葡萄糖进行有氧糖酵解,为肺癌细胞的生长提供能量和有利的酸性微环境,养阴扶正汤可抑制人肺腺癌细胞A549的有氧糖酵解,进而抑制了人肺腺癌细胞A549的增殖,其分子机制有待于进一步研究。
基金项目
黑龙江自然科学基金资助项目编号:H2016095。
NOTES
*通讯作者。