1. 引言
含铜宫内节育器(Intrauterine device, IUD)是一种避孕效果好、可复性强、经济方便的长效避孕方法,主要通过铜离子释放引起局部免疫反应起避孕作用 [1] [2] [3] 。IUD在置入体内早期可出现铜离子的暴释现象,使宫腔内铜离子浓度短期内急剧升高,长期暴露可以造成子宫内膜细胞的损伤 [4] ,同时,许多研究表明,金属铜释放的铜离子通过体内的氧化还原反应,生成活性氧类物质(Reactive Oxygen Species, ROS) [5] ,ROS可以迅速与DNA结合,造成DNA链断裂、碱基突变从而损伤DNA。随着现在高分子复合材料的应用,为解决现存避孕方式的弊端提供了可能性。近年来应用新型材料制作宫内节育器取得了较好的进展,避免了铜离子的暴释现象 [6] [7] [8] [9] ,从而避免高浓度铜离子直接与子宫内膜接触,减少铜离子对子宫内膜的损伤。本课题组前期采用聚乙烯醇(Polyvinyl alcohol, PVA),二氧化硅纳米颗粒加或不加CuCl2制备含铜/无铜高分子复合材料,通过调整成孔剂草酸铵的含量调整微孔大小,使微孔直径为5~10 µm,以便用于制作过滤性输精管内节育装置(Intra-vas device, IVD) [10] 。前期研究中,对于材料的缓释性进行检测,表明该材料可以有效控制材料中铜离子的释放,避免了铜离子暴释。该材料制作的输精管内节育装置(IVD)在宾格犬和新西兰大耳白兔在体内取得了良好的避孕效果,同时对生殖器官组织损伤、细胞凋亡与输精管结扎组相比明显降低 [10] 。在体外细菌回复突变实验(Ames实验)检测中,含铜高分子复合材料在100%、50%以及25%浸提液浓度情况下,可诱发移码型突变;彗星实验检测TM4细胞DNA损伤,结果表明100%、50%以及25%浸提液浓度均可导致DNA损伤,无铜高分子复合材料浸提液均无明显损伤 [11] 。
机体对于铜离子刺激产生的过量ROS首先出现的是抗氧化酶的活性增加,以清除过量的ROS从而维持细胞内的氧化还原平衡,降低ROS的损伤。体内抗氧化酶主要包括:超氧化物歧化酶(superoxidantase, SOD)、过氧化氢过氧化物酶、谷胱甘肽酶等。细胞内的O2-可以被超氧化物歧化酶(SOD)还原为H2O2,然后通过过氧化氢酶或谷胱甘肽过氧化物酶催化下转化为无毒的H2O。机体内存在许多代谢系统,铜离子被吸收入血,在体内再分布,经过一系列的代谢反应,能否将过量离子造成的损伤降低,同时,机体对已受损细胞能否进行修复这仍然值得我们去探讨。Saleha Banu等 [12] 在小鼠体内研究,结果显示,虽然铜在体内能够导致遗传毒性,在处理48小时后,损伤程度逐渐降低,2周后达到处理前水平。这表明机体对铜离子造成的DNA损伤具有一定的修复能力。
本研究采用连续染毒小鼠的方式检测小鼠体内在连续较高浓度铜离子浸提液注射的条件下,通过血细胞检测机体DNA损伤程度,通过检测体内ROS含量推断机体对铜离子造成的DNA损伤修复能力。同时,通过WST法检测染毒后血浆中SOD含量的变化,从而对体内损伤修复机制进行研究。
2. 材料和方法
2.1. 实验材料
所用新型复合材料由华中科技大学材料科学与工程学院模具技术国家重点实验室制作。小鼠淋巴瘤细胞株(L5178Y/tk+/−
3.
7.2
C)购自中国科学院上海生命科学研究院细胞资源中心(中国上海)。昆明小鼠(Kunming Mouse),20只,雌雄各半,体重25~30 g,购买于华中科技大学同济医学院动物中心。动物实验方案严格按照华中科技大学同济医学院伦理委员会的规定执行。
2.2. 材料的提取
按照ISO 10993-12:2007指南制备样品的要求,将材料称量后装入洁净干燥玻璃瓶中,高压蒸汽灭菌30分钟。按照材料重量/体积0.2 g/ml浸提比例加入浸提液——无血清的RMPI 1640培养基用于小鼠淋巴瘤测定和彗星测定,生理盐水用于微核试验。密封瓶口,37℃培养箱中浸提24小时,将浸提液转入无菌玻璃瓶中,4℃保存。
2.3. 单细胞凝胶电泳——彗星实验(Comet Assay)
用含铜高分子复合材料50%和25%浸提液浓度处理细胞3小时,将处理3小时后的细胞用PBS洗涤3遍后,R-10调整密度至2 × 105/ml,制胶、裂解、解旋、电泳和染色分析尾部DNA含量(Tail DNA%)和Olive尾距(Olive Tail Moment, OTM)。
2.4. 动物处理与DNA损伤、修复的检测
用高浓度金属铜离子浸提液(100%)染毒动物,腹腔注射连续染毒七天,染毒剂量为1.5 ml/100g体重。染毒前和每次染毒后24小时断尾取血6 µl加入至94 µl 37℃预热的PBS中,吹散混匀,置于37℃水浴锅中,用于彗星实验检测。按照染毒时间标记,分别标记为0D、1D、2D、3D、4D、5D、6D、7D组,分别代表染毒前,第一次染毒后24小时(染毒1次)、48小时(染毒2次)、3天(染毒3次)……直至第一次染毒后7天(染毒7次)。
2.5. 细胞内活性氧物质(Reactive Oxygen Species, ROS)检测
用含铜高分子复合材料50%和25%浸提液浓度处理细胞,用不含血清培养基洗涤细胞3次,将DCFH-DA按照1:1000用无血清培养基稀释,是最终浓度为10 µmol/L,加入适当的体积重悬细胞,密度约为1 × 106/ml,37℃避光震荡孵育20分钟。用无血清培养基洗涤3次,以充分洗去多余DCFH-DA。检测、拍照和分析。
2.6. 血浆内超氧化物歧化酶(Superoxide Dismutase, SOD)活力单位的检测(WST法)
染毒前以及每次染毒后24小时分别断尾取血,用柠檬酸钠抗凝EP管收集血液,WST法检测血浆内SOD活力单位。
2.7. 数据分析
对Tail DNA%,Olive尾距运用SPSS13.0软件进行统计学分析,ANOVA检验将各实验组与阴性对照组进行比较,P < 0.05为具有统计学意义。
3. 结果
3.1. 处理后继续培养检测彗星实验结果
细胞经两个浓度处理3小时后,细胞DNA出现不同程度的损伤,去除培养物后细胞DNA损伤出现差异,而有些细胞损伤明显增加,与处理组比较有显着性差异(P < 0.05)。相反,培养6小时后,大部分细胞恢复正常。(如图1(A)所示) ROS也显示了类似的趋势,彗星图像将CASP分析后,分析结果见表1,图1(B)。可以看出,ROS在细胞内产生的越多,DNA损伤程度越高。
3.2. 细胞内ROS检测实验结果
检测的各时间点,细胞内均可观察到不同强度的荧光,经含铜复合材料25% (铜离子浓度为3.18 mg/L)处理3小时后,细胞荧光强度明显增加,去除培养物继续培养3小时后,细胞荧光强度仍增加。但是,培养6小时后,荧光强度有所减弱(如图1(C)所示)。
3.3. 小鼠全血细胞彗星实验结果
结果显示雌性小鼠于染毒后第2、3、4天DNA损伤程度最严重,雄性小鼠于染毒后第4天DNA损伤最严重。雌性小鼠第5天DNA损伤有明显降低,雄性小鼠第6天明显降低。(图2(A),图2(B),表2)
3.4. 血浆中SOD活力单位的测定结果
雌性小鼠体内SOD活力第3天达到高峰,雄性小鼠体内SOD含量第4天、第7天显著升高,同时结果表明雌性小鼠体内SOD含量普遍较雄性小鼠体内含量高(图2(C))。

Figure 1. The DNA damage repair ability in vitro and ROS concentration of different time points. (A) is the level of DNA damage after treatment of cells with two groups of material extracts number 1 - 3 mean the copper wire 50% groups for 0, 3 and 6 hours, number 4 - 6 mean the copper wire 25% groups for 0, 3 and 6 hours, 7 is the negative group * indicates that the group compare to the no recultured group, the DNA damage were significantly increased. (B) is the typical Comet images of different time points of different groups. (C) is the ROS results. In this figure, 0 h meant the cells were treated by the new composite and without recultured. 3 h indicated the cells were recultured for 3 hours. 6 h indicated the cells were recultured for 6 hours. a - c mean the copper wire 50% groups. d - f mean the copper wire 25% groups
图1. 体外DNA损伤修复能力和不同时间点的ROS浓度。(A) 是两组材料浸提液处理细胞后DNA损伤水平数字1~3表示含铜复合材料50%再培养0、3、6小时组,4~6表示含铜复合材料25%组再培养0、3、6小时组;7为阴性对照组;*表示与未再培养组相比,DNA损伤显着增加。(B) 是不同组在不同时间点的典型彗星图像。(C) 是ROS的结果。图中0小时表示细胞被新的复合物处理而没有重新培养,3小时表示细胞再培养3小时,6小时表示细胞再培养6小时。a~c表示含铜复合材料50%组,d~f含铜复合材料25%组
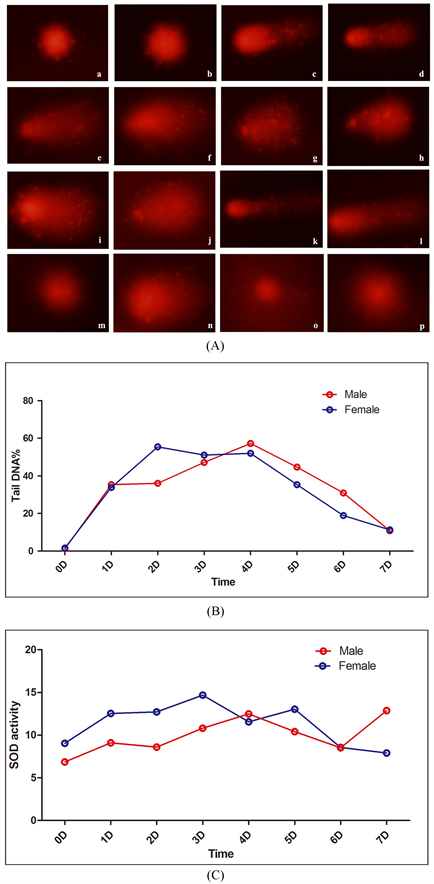
Figure 2. The DNA damage repair ability in vivo and the SOD activity tendency with the time change. (A) is the typical Comet images of different days. a, c, e ,g, i, k, m, and n were the images of female mice, and the rest are the images of mice. Meanwhile, a and b are the pre-treatment, c and d are the 24 h after treatment, e and f are the 48 h after treatment, and o and p are the 7 days after treatment. (B) is the DNA damage level of different time. (C) is the SOD activity tendency in both mice with the time change
图2. 体内DNA损伤修复能力和随时间变化的SOD活性趋势。(A) 是不同染毒时间后血细胞彗星实验的典型彗星图像。a,c,e,g,i,k,m和n是雌性小鼠的图像,其余的是雄性小鼠的图像。同时,a和b是染毒前,c和d是染毒后24小时,e和f是染毒后48小时,o和p是染毒后7天。(B) 是不同染毒时间后的DNA损伤程度。(C) 是雌雄小鼠体内不同染毒时间血浆SOD活性单位变化趋势

Table 1. The comet assay results of two groups of material extracts treated cells for 0, 3, 6 hours and continued to culture for 0, 3, 6 hours
表1. 两组材料浸提液处理细胞3小时与继续培养0,3,6小时彗星实验结果
*表示与同浓度处理3小时后相比具有统计学差异(P < 0.05);Δ表示与阴性对照组相比具有统计学意义(P < 0.05)。

Table 2. The results of blood comet assay after different exposure time
表2. 不同染毒时间后血细胞彗星实验分析结果
*表示:与阴性对照组相比具有统计学意义,P < 0.05。
4. 讨论
许多研究表明,金属铜释放的铜离子通过体内的氧化还原反应,生成ROS [5] ,如OH-等,形成的ROS可以迅速与DNA结合,造成DNA链断裂、碱基突变从而损伤DNA。当然,机体内存在一系列的损伤修复机制,从而使受损的DNA尽可能修复 [13] [14] 。但损伤修复情况受损伤程度和修复能力相互作用的影响。本课题组前期制备的新型避孕高分子复合材料,能够对铜离子的释放进行有效控制,避免了铜离子暴释。为进一步检测该材料的安全性,本研究将继续检测该材料以及金属铜的体内外遗传学毒性,同时检测体内外DNA损伤修复能力,为该材料的安全性进行评定。
本研究用两种不同浓度浸提液处理细胞3小时后去除处理物继续培养3小时和6小时,经彗星实验检测发现继续培养3小时后,虽然发现平均细胞DNA损伤增加,但损伤较小细胞DNA已经开始修复,虽不能完全解释DNA修复程度,但具有一定的意义。而继续培养6小时后,损伤恢复正常。为更好的检测体外实验结果,应进行更长时间修复。由于小鼠淋巴瘤生长周期为10小时,细胞体外培养超过10小时后细胞进行分裂,无形之中即会降低DNA损伤程度。因此,为了更好的研究DNA损伤修复能力,我们进行了体内连续染毒实验,检测不同时间点DNA损伤程度,以此作为判断机体对DNA损伤修复的能力。结果表明,染毒后血细胞DNA损伤程度先逐渐增加(Tail DNA%逐渐增加),染毒24小时后雄性、雌性小鼠尾DNA含量分别为35.32%、33.80%,48小时后为:36.03%、55.41%,3天后为:47.14%、51.05%,第4天为:57.20%、51.99%。虽然期间有一定的波动性(雌性小鼠第二三四天尾DNA含量基本相同),但随着染毒次数的增加,小鼠血细胞DNA损伤呈递增关系。但从第五天开始,尾DNA含量逐渐降低,表明细胞损伤得到了一定的修复。染毒后第6天,第7天尾DNA含量虽然与染毒前统计学分析后仍有统计学差异,但与损伤最严重时相比有大幅降低。
体内对于由过量ROS而造成的DNA损伤主要存在三种修复途径。首先是抗氧化体系来清除过量的ROS,主要包括SOD、过氧化氢酶等;其次是DNA损伤的修复体系,通过碱基修复、核酸修复、同源重组修复等修复轻度受损的DNA;最后是DNA损伤检验点修复,通过基因表达调控使细胞对于损伤进行反应,使受损细胞恢复正常或促进细胞发生凋亡。这三种途径相互作用,使受损后的细胞恢复或凋亡,降低其对机体的影响。虽然体内彗星实验检测到铜离子可以对DNA造成损伤,但也有学者通过Ecoli检测到过量铜离子并未对其造成损伤,这可能是由于体内剩余的铜离子可以与配体结合,从而抑制ROS的生成或者使形成的ROS远离DNA [15] 。本实验通过血浆SOD含量测定,发现小鼠体内SOD含量于第3天(雌性),第4、7天(雄性)达到峰值,说明机体在受到外来刺激引起体内氧化物质增加时,体内的抗氧化酶开始发挥作用,从而降低对细胞的损伤。Pourahmad等研究发现,羟自由基清除剂(DMSO,SOD等)可以明显减少ROS的形成以及脂质过氧化 [16] 。这表明SOD可以通过减少ROS的形成从而降低DNA的损伤。
5. 结论
虽然含铜复合材料和金属铜在体内外均可导致一定的遗传毒性,可以使细胞DNA发生不同程度的损伤。但是,机体对于由铜离子造成的DNA损伤具有一定的修复能力,因此,铜离子对组织细胞的遗传毒性取决于局部铜离子浓度、接触时间以及机体自身修复功能的相互作用。
致 谢
本研究获得武汉科学技术局科研资助,项目(201706201010213),在此表示诚挚的感谢。
NOTES
*通讯作者。