1. 引言
碳糊电极是将导电性的石墨粉与憎水性的粘合剂(如石蜡)混合调成糊状,然后填充到电极管中而制成的一类电极,具有制作方便,重现性好,应用范围广和电位窗口范围宽等优特点 [1] ,因而碳糊电极广泛应用于电化学分析研究等 [2]。在碳糊中加入一定量的修饰剂可制得均匀的化学修饰碳糊电极(CMCPE)。由于特效性修饰剂的加入,使测定的灵敏度、选择性进一步提高;化学修饰碳糊电极还可用于富集待测组分。因此化学修饰碳糊电极是把分离、富集和选择性测定三者合而为一的理想体系 [3]。
过渡金属钴、镍具有良好的催化性能,是一种具有应用前景的氢析出催化剂 [4]。铜在催化有机反应方面应用较为广泛 [5]。
过氧化氢(H2O2)是工业生产、临床医学和环境科学等方面的重要物质,许多氧化还原酶催化反应的产物,通过测定H2O2的浓度可以间接测定酶催化底物的浓度 [6] [7] ,H2O2的测定方法主要有容量分析法 [8] 、光谱法 [9] [10] [11] [12] 、电化学方法 [13] - [18] 等。本文将钴、镍、铜利用电化学沉积的方法修饰到碳糊电极表面,并研究了修饰碳糊电极对H2O2的电催化性能。结果发现,钴、镍、铜修饰碳糊电极对H2O2的氧化还原性质具有较强的催化性能,利用计时电流法对H2O2的测定取得较好的结果。
2. 实验部分
2.1. 仪器
CHI
660a
电化学工作站(上海辰华仪器公司),电子天平(北京赛多利斯天平有限公司),电磁搅拌器(常州国华电器有限公司)。
2.2. 试剂
石墨粉:光谱纯(SP) (国药集团化学试剂有限公司),以下所用到试剂均为分析纯(AR):液体石蜡(徐州试剂厂),过氧化氢(w = 24.90 %高锰酸钾标准溶液标定) (上海桃浦化工厂),硝酸钴(国药集团化学试剂有限公司),硝酸镍(上海虹光化厂),硫酸铜(国药集团化学试剂有限公司)。实验中所使用的过氧化氢含量,均经过KMnO4标准溶液的滴定测量;水为二次水。
2.3. 修饰碳糊电极的制备
2.3.1. 碳糊电极的制备
准确称取石墨粉4.00 g在研钵中,然后称取1.50 g液体石蜡,倒入研钵中,研磨使其混合均匀。将所得碳糊填充到电极管中,并在抛光纸上抛光,使底部水平无凹陷或突出。
2.3.2. 修饰碳糊电极的制备
将制备好的碳糊电极在25 mL 0.1 mol/L H2SO4溶液中,分别加入1 mL 0.1 mol/L硝酸钴、硝酸镍和硫酸铜溶液,在−1.2 V的电位下电化学沉积60 s,得到钴、镍、铜修饰的碳糊电极。
2.4. 实验方法
修饰碳糊电极或碳糊电极为工作电极,铂电极为对电极,饱和甘汞电极(SCE)为参比电极。在电解池加入0.1 mol/LNaOH溶液25.0 mL,再加入H2O2溶液,用循环伏安法进行试验,电位扫描范围为0.0 V~0.7 V,扫描速度为100 mV/s;记录伏安曲线;用计时安培法对H2O2的浓度进行测定。每次使用后,将修饰碳糊电极表面的修饰碳糊除去,用蒸馏水冲洗干净,更新碳糊并重新修饰即可再次使用。
3. 结果与讨论
3.1. 修饰碳糊电极的电化学表征
将电极放在阻抗溶液:2.5 × 10−3 mol/L K3Fe(CN)6/K4Fe(CN)6 + 0.1 mol/L KCl中,进行阻抗测定,得到图1。从图中可以看出铜钴镍修饰碳糊电极(曲线1)上的阻抗半径比裸碳糊电极(曲线2)小,说明碳糊电极已修饰了铜钴镍,且有利于过氧化氢电化学反应的进行。
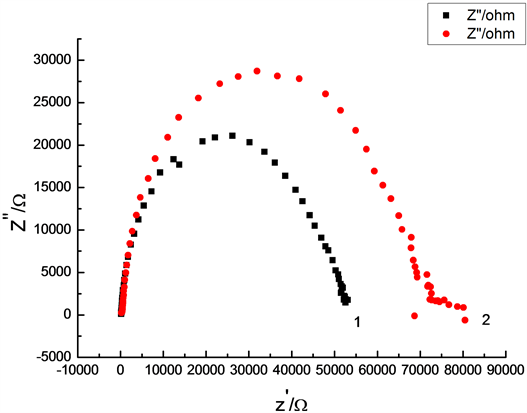
Figure 1. Electrochemical impedance spectroscopy of bare carbon paste electrode (CPE); (2) and Co Ni Cu modified carbon paste electrode (1)
图1. 钴镍铜修饰碳糊电极和裸碳糊电极的阻抗图。(1) 修饰碳糊电极的阻抗图;(2) 裸碳糊的阻抗图
3.2. 修饰碳糊电极对过氧化氢的电化学催化
修饰碳糊电极做工作电极,在0.1 mol/LNaOH溶液中,H2O2浓度为3.25 × 10−5 mol/L,进行循环伏安法扫描,扫描电位范围0.0 V~0.7 V,扫描速度为100 mV/s;记录伏安曲线(见图2)。
从图2可以看出:在0.1 moL/LNaOH溶液中,H2O2在裸碳糊电极的氧化还原作用不明显。但钴镍铜修饰碳糊电极上出现明显的H2O2氧化还原峰。说明该电极对H2O2的氧化还原有催化作用。

Figure 2. Cyclic voltammograms of different electrodes by sweeping potential from 0 V to 0. 7 V. (1) CPE; (2) CPE/Co Ni Cu
图2. 过氧化氢在不同电极上的CV图。(1) 钴镍铜修饰碳糊电极CV图;(2) 裸碳糊电极CV图
3.3. 底液的选择
以修饰碳糊电极为工作电极,分别在NaOH、KCl、KNO3、NaAc、KH2PO4、NaAc-HAc (浓度均为0.1 mol/L)缓冲溶液中进行实验。结果表明在0.1 mol/LNaOH溶液中,峰形较好且稳定,选用其作为实验溶液。
3.4. 沉积时间对检测过氧化氢的影响
在25 mL 0.1 mol/L H2SO4 的底液中,加入1 mL 0.1 mol/L硫酸铜、硝酸钴、硝酸镍溶液。将电极置于上述溶液中,确定沉积电位−1.2V。改变沉积时间分别为(20 s、40 s、50 s、60 s、80 s),将钴镍铜修饰的碳糊电极置于H2O2浓度为3.25 × 10−5 mol/L的0.1 mol/LNaOH溶液中,工作电位为0.2 V,进行计时安培扫描,得到图3。从图中可以看出沉积时间由20 s延长至80 s时,响应电流逐渐增大。如图当时间为60 s时过氧化氢更稳定,所以最佳沉积时间为60 s。
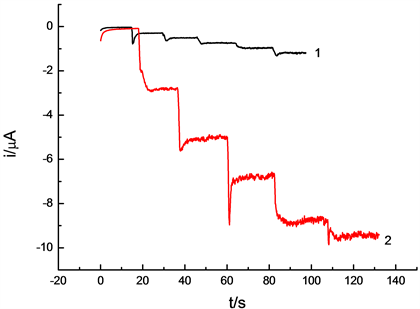
Figure 3. Amperometric response of different electrodes for successive addition of hydrogen peroxide to 0.1 mol/L NaOH solution at 0.2 V. (1) Deposition time: 20 s; (2) Deposition time: 60 s
图3. 过氧化氢在不同沉积时间制得修饰电极上的计时安培图。(1) 沉积时间20 s;(2) 沉积时间60 s
3.5. 沉积电位对检测过氧化氢的影响
在25 mL 0.1 mol/L H2SO4的沉积液中,加入1 mL 0.1 mol/L硫酸铜、硝酸钴、硝酸镍溶液。确定沉积时间60 s,改变沉积电位分别为(−1 V、−1.2 V、−1.3 V、−1.4 V、−1.5 V),将钴镍铜修饰的碳糊电极置于H2O2浓度为3.25 × 10−5 mol/L的0.1 mol/L NaOH溶液中,工作电位为0.2 V,进行计时安培扫描,得到图4。结果表明沉积电位由−1 V至−1.5 V时,响应电流逐渐增大,当沉积电位为−1.2 V时葡萄糖稳定性好,所以最佳沉积电位为−1.2 V。
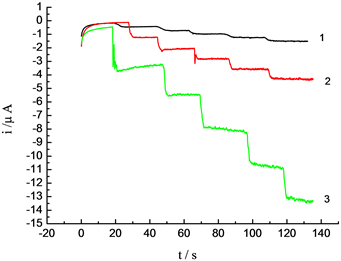
Figure 4. Amperometric response of different electrodes for successive addition of hydrogen peroxide to 0.1 mol /L NaOH solution at 0.2 V. (1) Deposition potential: −1.4 V; (2) Deposition potential: −1.1 V; (3) Deposition potential: −1.2 V
图4. 过氧化氢在不同沉积电位制得的修饰电极上的计时安培图。(1) 沉积电位−1.4 V;(2) 沉积电位−1.1 V;(3) 沉积电位−1.2 V
3.6. 工作电位对检测过氧化氢的影响
用计时安培法测定过氧化氢时,工作电位是重要的影响因素。在最佳条件下得到的修饰电极,放入H2O2浓度为3.25 × 10−5 mol/L的0.1 mol/L NaOH溶液中,研究不同工作电位(0.1 V、0.2 V、0.3 V、0.4 V、0.5 V)对检测过氧化氢的影响。结果见图5。结果表明,当工作电位由0.1 V增至0.5 V时,电流响应逐渐增强,响应信号的增幅相对减小且背景电流明显增大。由于在较高工作电位下,一些在低电位下稳定的物质可能被氧化。因此最佳工作电位是0.2 V。
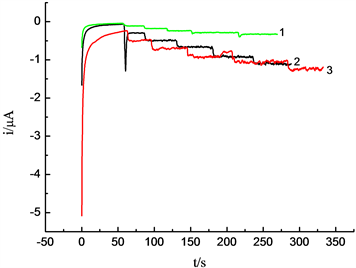
Figure 5. Amperometric response of hydrogen peroxide at different work potential. (1) Work potential: 0.3 V; (2) Work potential: 0.5 V; (3) Work potential: 0.2 V
图5. 过氧化氢在不同工作电位下的计时安培图。(1) 电位为0.3 V;(2) 电位为0.5 V;(3) 电位为0.2 V
3.7. 干扰试验
在H2O2浓度为3.25 × 10−5 mol/L的0.1 mol/L NaOH溶液中,研究干扰情况。结果表明,下列物质在该溶液中最少允许量为(给定允许误差 ± 10%):1000倍Ca2+、Mg2+;500倍葡萄糖、尿素、蔗糖、柠檬酸、草酸。10倍抗坏血酸有干扰(图6)。
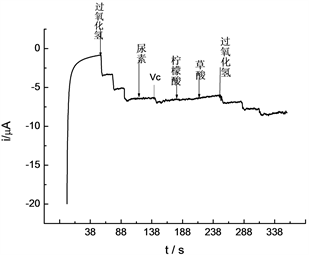
Figure 6. Amperometric response of hydrogen peroxide in the presence of the disturbance
图6. 过氧化氢干扰实验计时安培图
3.8. 电极的重现性与稳定性
将钴镍铜修饰碳糊电极置于H2O2浓度为3.25 × 10−5 mol/L的0.1 mol/L NaOH溶液中,连续测定10次,峰电流的平均值为3.16 × 10−6 A,相对标准偏差为3.5%。将制备好的电极在室温下放置1个月后,同样条件下对过氧化氢进行检测,其对过氧化氢的电流响应几乎不变,说明电极的重现性好,使用寿命长。另外电极在H2O2浓度为3.25 × 10−5 mol/L的0.1 mol/L NaOH溶液中,用计时电流法测定180 s,电流值稳定,结果见图7。
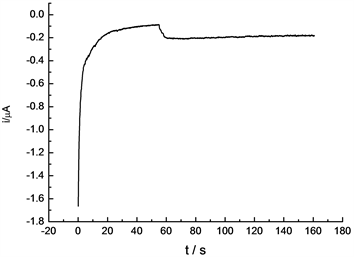
Figure 7. Amperometric response of hydrogen peroxide
图7. 过氧化氢的计时安培图
3.9. 线性范围与检出限
在25 mL 0.1 mol/L氢氧化钠溶液中,工作电位为0.2 V,连续加入12次10 μL 0.08129 mol/L过氧化氢溶液,用计时安培法对过氧化氢进行定量测定,得到图8。结果表明,随溶液中过氧化氢浓度的增加,响应电流不断增大。在3.25 × 10−6 mol/L~3.25 × 10−4 mol/L浓度范围内,响应电流与浓度呈良好的线性关系。见图9,线性方程为:I(10−5 A) = 0.3 + 0.005 C(10−5 mol/L),r = 0.996,检出限为3.0 × 10−7 mol/L。
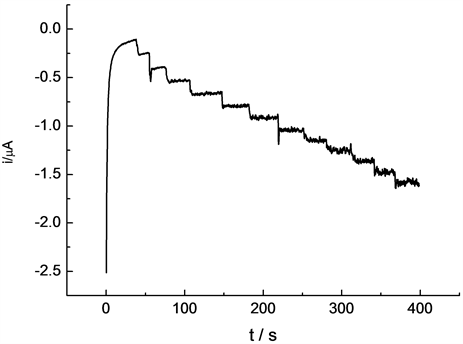
Figure 8. Amperometric response for successive addition of hydrogen peroxide to 0.1 mol/L NaOH solution at 0.2 V
图8. 过氧化氢的计时安培曲线
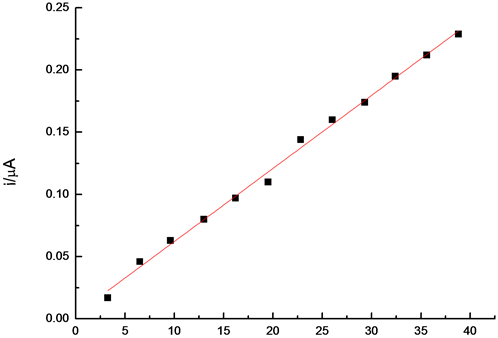
Figure 9. Relationship between current response and hydrogen peroxide concentration at CoNiCu/CPE
图9. 过氧化氢电流与浓度的关系曲线
3.10. H2O2回收率及样品测定
准确移取H2O2 (w= 30 %) 25.00 mL于250 mL容量瓶中进行定容,得到w = 3%的H2O2样品溶液,用KMnO4溶液标定其准确浓度为0.08129 mol/L。在25.0 mL 0.1 mol/L NaOH溶液中,加入一定量的w = 3%的H2O2样品溶液,按实验方法测定过氧化氢含量,并用标准加入法进行加标回收实验,结果见表1,回收率在94.5%~102.1%之间,平均回收率为97.3%。在25 mL 0.1 mol/L氢氧化钠的溶液中,用本法和高锰酸钾滴定法对抑菌洗剂样品中的H2O2含量进行测定,测定结果见表2。

Table 1. The recovery of hydrogen peroxide
表1. 过氧化氢回收率测定

Table 2. The determination of hydrogen peroxide samples
表2. 过氧化氢样品检测
4. 结论
本实验用电位沉积法在碳糊电极表面修饰钴、镍、铜,研究了修饰碳糊电极的性能。结果表明,钴、镍、铜修饰碳糊电极对H2O2的电化学还原过程具有催化作用,用于实际样品中H2O2的测定取得较好的结果。测定的线性范围:3.25 × 10−6 mol/L~3.25 × 10−4 mol/L,该电极具有灵敏度高、稳定性、重现性好等特点。