摘要:
本文应用密度泛函理论的B3LYP方法,在6-31 + G(d, p)基组水平上对苯基亚磷酸甲酯分子进行了理论计算,得到了分子的稳定构型及其红外光谱。分析后发现,根据分子振动类型的不同可将红外光谱划分为(0~800) cm
−1、(800~3000) cm
−1和(3000~4000) cm
−1三个区域,由于存在简并和无红外活性的现象致使红外谱中实际谱线的数目小于简正振动的数目。
Abstract:
The methyl phenylphosphinate is studied at the 6-31 + G(d, p) basis set level, using the B3LYP method of density functional theory, and the stable structure and its infra-red spectrum are gained. After researched, according to vibration modes, the infra-red spectrum of methyl phe-nylphosphinate mainly lies in three different regions: (0 - 800) cm−1, (800 - 3000) cm−1 and (3000 - 4000) cm−1. Because there is degeneration and non-infrared activity appears in the spectrum, the practicable number of the spectral line is less than that of the normal modes.
1. 引言
元素磷在生物体内主要存在于核苷酸和细胞膜中,同时磷酸在生物的物质代谢和能量代谢中也发挥着重要作用,因此,磷是所有细胞必不可少的原酸。在生物圈中,磷主要以三种状态存在:① 在生物体内与有机分子结合;② 以可溶解状态存在于水溶液中;③ 不溶解的磷酸盐大部分存在于沉积物中。磷的循环主要在土壤、植物和微生物之间进行。微生物在其中起着重要作用,它既参加了无机磷化物的溶解和有机物的矿化作用,也参加了可溶性磷的同化作用。目前对于含磷化合物的合成、结构与反应、含磷生物活性物质及含磷化合物分析应用的研究十分活跃 [1] [2] [3] 。苯基亚磷酸甲酯是含磷类有机化合物,是一种重要的晶体,为了能更加深入地了解苯基亚磷酸甲酯的各类性质,本文利用量化计算的方法对苯基亚磷酸甲酯分子的结构和红外光谱的特点进行了研究,这对于快速分析实验中所获苯基磷酸甲酯分子的红外振动光谱具有极大的参考价值。
2. 计算方法
Gaussian计算软件在化学计算领域应用比较广泛。它提供了多种泛函的密度泛函方法 [3] [4] ,可用于计算分子能量和结构、过渡态能量和结构、化学键和反应能量、红外和拉曼光谱反应路径和激发态性质等,除了计算分子体系,还可以计算溶液体系和周期性体系 [4] [5] [6] 。本文对苯基亚磷酸甲酯的分子结构及红外光谱的分布规律进行了系统的研究,我们先用Gauss View构型软件构建了苯基亚磷酸甲酯分子的初始结构,在B3lYP/3-21G水平上利用Gaussian09计算软件对初始结构进了结构优化,在此基础上利用B3LYP/6-31 + G(d, p)的方法再次对构型进行了结构优化和频率计算,频率计算没有出现虚频,故确定构型为稳定构型,通过对频率计算结构的分析得到了苯基亚磷酸甲酯分子的红外振动光谱,并对光谱中出现的各条谱线进行了指认,对谱线形成的机理进行了分析。频率计算采用0.9613 [7] 的修正因子进行矫正。
3. 结果与讨论
3.1. 分子的结构特点
苯基亚磷酸甲酯分子的稳定构型如图1所示。表1中列出了苯基亚磷酸甲酯分子的相关结构参数。在分子结构中共含有的H-C、C-C、C-O、O-P、O=P和C-C五种化学键,分子结构不具有良好对称性。在苯环中,C-C双键的键长各不相同,其中3C-4C键长为1.402 Å,而1C-2C和5C-6C两个化学键的键长分别为1.394 Å和1.396 Å,3C-2C、5C-4C和6C-1C三个键长分别为1.402 Å、1.395 Å和1.397 Å。苯环中H-C键中10H-5C、11H-6C和7H-1C三个化学键的键长均为1.087 Å,8H-2C和9H-4C两个化学键略有不同,分别为1.085 Å和1.086 Å,在CH3基团中的三个H-C键的键长也各有不同,其中16H-15C键长为1.094 Å,17H-15C键长为1.092 Å,18H-15C键长为1.096 Å。结构中O原子参与形成的化学键中,14O-15C键长为1.437 Å,14O-12P键长为1.647 Å,13O=12P键长为1.507 Å,而结构中P原子参与形成的12P-3C键长为1.822 Å。在各原子形成的尖角中,∠14O-12P-3C和∠17H-15C-14O分别为100˚和106˚,∠16H-15C-14O和∠18H-15C-14O均为111˚,而∠13O-12P-3C和∠15C-14O-12P分别为114˚和119˚,分子其余键角均为120˚,详见表1。在各原子所形成的二面角中,∠7H-1C-6C和∠8H-2C-1C两个二面角均为179˚,参与形成三个二面角的四个原子近似处于同一平面内。
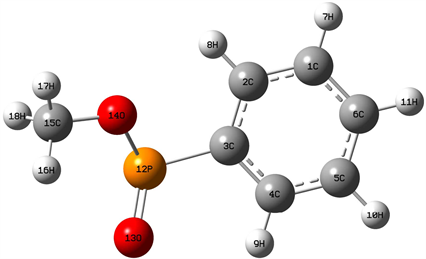
Figure 1. Stable structure of methyl phenylphosphinate
图1. 苯基亚磷酸甲酯分子的稳定构型

Table 1. Structure parameters of methyl phenylphosphinate
表1. 苯基亚磷酸甲酯分子的部分结构参数
3.2. 苯基亚磷酸甲酯分子的红外振动光谱
红外振动光谱是由于分子振动能级的跃迁(同时伴随转动能级的跃迁)而产生的,其谱线强度决定于跃迁几率,理论计算 [8] 有:
式中
为红外电磁波的电矢量;
为跃迁偶极矩,它不同于分子的永久偶极矩
,它反应振动时偶极矩变化的大小。因此,红外吸收强度决定于振动时偶极矩变化的大小。若振动过程中偶极矩变化较大,则跃迁几率就会越大,光谱强度相应就会较强;若分子在振动过程中偶极矩变化较小,则跃迁几率相应较小,红外光谱强度也就会较弱。
苯基亚磷酸甲酯分子的红外振动光谱如图2所示。分析发现,分子简正振动的数目要大于光谱中出现的谱线的实际数目,这主要是由于部分分子振动模式所引起的分子偶极矩没有发生较大变化,并且存在简并现象。此外,基本上红外光谱的每条谱线都是由多个振动模式叠加而成的。按分子振动类型的不同苯基亚磷酸甲酯分子的红外振动光谱可划分为(0~800) cm−1、(800~3000) cm−1和(3000~4000) cm−1三个区域。
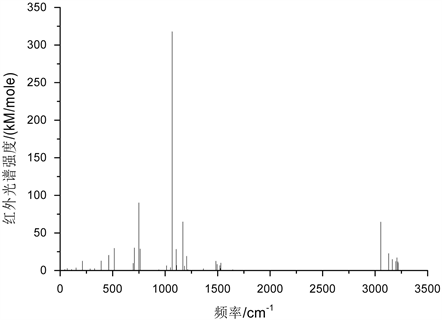
Figure 2. Infra-red spectrum of methyl phenylphosphinate
图2. 苯基亚磷酸甲酯分子的红外光谱
在(0~800) cm−1区域,主要以分子内各基团的整体转动和苯环的呼吸振动为主,该区域中光谱强度较其它区域低,最强峰出现在749 cm−1位置,它是由含15C的CH3基团绕15C-14O键的整体转动和苯环绕3C-12P键的整体转动的复合振动引起地,它也是整个红外光谱中的次强峰。该区域次强峰出现在706 cm−1位置它是由苯环的呼吸振动引起地,此外含15C的CH3基团的整体转动还在515位置引起一较强共振峰,而762 cm−1位置的振动峰是由苯环的呼吸振动和含15C的CH3基团的整体转动的复合振动造成。在该区域的光谱中,在463 cm−1位置出现了三重简并现象,分别与整个苯环的整体转动、含15C的CH3基团的整体转动及苯环的呼吸振动相对应。在409 cm−1位置还出现了无红外活性的现象,其分子振动模式主要是整个分子中骨架原子的整体摆动。
在(800~3000) cm−1区域,分子的振动模式主要为分子的弯曲振动,包含面外弯曲振动(扭曲振动和面外摇摆振动)和面内弯曲振动(剪式振动和面内摇摆振动)。该区域中的红外光谱的振动峰主要在(800~1700) cm−1范围内,而在(1700~3000) cm−1区域没有共振峰的出现,其中该区域的最强峰出现在1067 cm−1位置,是由含16H和18H的扭曲振动引起地,该振动峰也是整个红外光谱的最强峰,该区域的次强峰出现在1169 cm−1位置,它是由16H和17H的剪式振动及13O的面外摇摆振动引起地,1105 cm−1位置振动峰是由7H和11H的面外摇摆振动的复合振动引起地,11H的面内摇摆振动和18H的面外摇摆振动的复合振动在1204 cm−1位置引起一较强共振峰;在1483 cm−1位置的振动峰是由7H、8H和10H的面内摇摆振动引起地,振动模式如图3所示,1530 cm−1位置的共振峰是由16H和18H的剪式振动引起地,振动模式如图4所示。16H、17H和18H的伞状振动在1495 cm−1位置引起一较强共振峰,振动模式如图5所示。8H、10H和11H的面内摇摆振动在1109 cm−1位置引起一共振峰,但其强度较弱,其振动模式如图6所示。1520 cm−1位置谱峰是由16H和17H的剪式振动及18H的面内摇摆振动的复合振动在1520 cm−1位置引起一共振峰。在1013 cm−1位置出现了三重简并现象,其分别与8H和11H的面内摇摆振动、9H的面外摇摆振动及13O的面外摇摆振动相对应。867 cm−1、981 cm−1、1006 cm−1、1195 cm−1、1336 cm−1和1631 cm−1六个位置的谱峰出现了无红外活性的现象,其中867 cm−1位置振动峰是由7H、8H、9H和10H的面外摇摆振动引起地,981 cm−1位置的振动峰是由8H和10H的面内摇摆振动引起地,1006 cm−1位置振动峰是由11H和7H的扭曲振动引起地,1195 cm−1位置振动峰是由7H和11H的剪式振动和10H的面外摇摆振动造成地,1336 cm−1位置振动峰是由16H和18H的剪式振动引起地,而1631 cm−1位置共振峰是由11H和8H剪式振动及17H和18H的剪式振动的复合振动造成地。
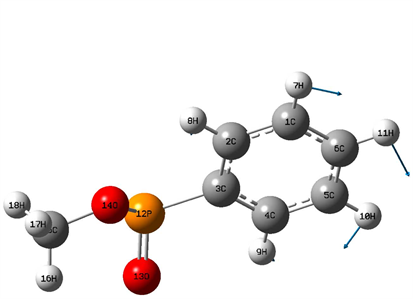
Figure 3. 1668 cm−1 vibration mode
图3. 1483 cm−1振动模式

Figure 4. 1530 cm−1 vibration mode
图4. 1530 cm−1振动模式
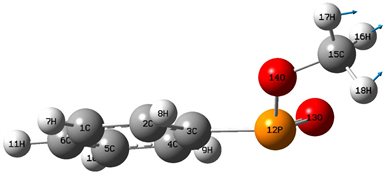
Figure 5. 1495 cm−1 vibration mode
图5. 1495 cm−1振动模式
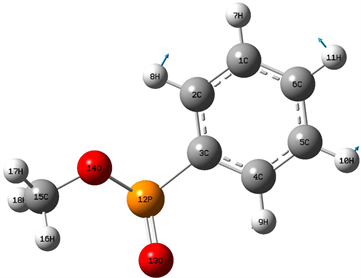
Figure 6. 1109 cm−1 vibration mode
图6. 1109 cm−1振动模式
在(3000~4000) cm−1区域,该区域中的红外振动峰数量较少,分子的振动类型主要为分子中C-H键的对称和反对称伸缩振动。该区域中的最强峰出现在3053 cm−1位置,它是由16H、17H和18H的对称伸缩振动引起地,分子振动模式如图7所示。区域次强峰出现在3129 cm−1位置,其对应的分子振动模式主要是17H和18H的反对称伸缩振动。在3163 cm−1位置出现的共振峰主要是由16H和17H的反对称伸缩振动引起地,其分子振动模式如图8所示。11H的伸缩振动在3186 cm−1位置引起一较强共振峰,而苯环中7H、9H和10H的伸缩振动在3196 cm−1位置引起一共振峰,分子振动模式如图9所示。3219 cm−1位置共振峰是由苯环中四个H原子的对称伸缩振动引起地,分子振动模式如图10所示。此外,3186 cm−1位置共振峰出现了无红外活性的现象,其对应的分子振动模式主要是8H和11H的反对称伸缩振动。

Figure 7. 3053 cm−1 vibration mode
图7. 3053 cm−1振动模式

Figure 8. 3163 cm−1 vibration mode
图8. 3163 cm−1振动模式

Figure 9. 3196 cm−1 vibration mode
图9. 3196 cm−1振动模式
4. 结论
本文利用Gaussian计算软件在B3LYP/6-31 + G(d, p)水平上确定出了苯基亚磷酸甲酯分子的稳定构型,并通过频率分析的方法得到了苯基亚磷酸甲酯分子的红外振动光谱。对分子结构特点进行了详细的分析,然后对红外光谱中的谱线进行了指认归属。研究发现,苯基亚磷酸甲酯分子的红外振动光谱可划分为(0~800) cm−1、(800~3000) cm−1和(3000~4000) cm−1三个区域,每个区域中的谱线所对应的分子振动模式有所不同,其中在(0~800) cm−1区域,主要以分子内各基团的整体转动和苯环的呼吸振动为主,该区域中光谱强度较其它区域低;在(800~3000) cm−1区域,分子的振动模式主要为分子的弯曲振动,光谱的最强峰和次强峰均出现在该区域;在(3000~4000) cm−1区域,该区域中的红外振动峰数量较少,分子的振动类型主要为分子中C-H键的对称和反对称伸缩振动。由于分子部分振动模式无红外活性或存在简并现象,致使光谱中的实际光谱峰数量小于理论数量。