1. 引言
LeShan (1996)在他的书《超越技术:21世纪的心理治疗》中记录了这么一个故事:有一天,医生在查病房,有位女性患者问他:“医生,我的癌症是什么性别?”医生反问:“为什么你要这么问呢?”患者回答:“因为我听说我得的癌症是女性的,我会感到更疼,但是如果是男性的,会不那么疼。”医生回答:“好的,你的癌症是女性的。”在这个故事中,明显医生没有讲真话。他反而给患者一个安慰剂,用善意的谎言给她一个正性的期待。事实证明,他的话确实对患者起到了作用。但是反过来想,如果医生说了真话会怎样呢?
反安慰剂效应的简史
Kennedy (1961)首先在他的文章中提出了反安慰剂效应这个词。反安慰剂效应,是安慰剂效应的孪生姊妹,能够被负性预期引起,从而加重患者的疼痛。反安慰剂效应会损害患者的治疗结果,每年都会因为反安慰效应浪费数量庞大的资源。虽然反安慰剂效应值得研究,但是因为伦理道德约束,关于这方面的研究很少。不过这些很少的研究成果也是非常出色并且值得赞扬的,表1整理了一些主要的相关文献。
反安慰剂效应(nocebo effect)涉及到了对疼痛(治疗结果)的消极预期(焦虑),会诱导患者的痛敏反应(hyperalgesic effect) (Benedetti, Amanzio, Casadio, Oliaro, & Maggi, 1997; Andre, Zeau, Pohl, Benoliel, & Becker, 2005; Benedetti, Amanzio, Vighetti, & Asteggiano, 2006; Benedetti, Lanotte, Lopiano, & Colloca, 2007; Benedetti, Durando, & Vighetti, 2014; Reicherts, Gerdes, Pauli, & Wieser, 2015)。研究者们通常通过预期和条件化来研究疼痛的反安慰剂效应(Benedetti, Pollo, Lopiano, Lanotte, Vighetti, & Rainero, 2003; Benedetti et al., 2006; Colloca, Sigaudo, & Benedetti, 2008; Jensen, Kaptchuk, Kirsch, Raicek, Lindstrom, Berna, Gollub, Ingvar, & Kong, 2012; Bartels, Van Laarhoven, Haverkamp, Wilder-Smith, Donders, Van Middendorp, Van De Kerkhof, & Evers, 2014; Jensen, Kaptchuk, Chen, Kirsch, Ingvar, Gollub, & Kong, 2015; Jensen, Kirsch, Odmalm, Kaptchuk, & Ingvar, 2015)。
丙谷胺(proglumide, PROG)是胆囊收缩素(cholecystokinin, CCK)的一种拮抗剂(Baber, Dourish, & Hill, 1989),被证实能够促进安慰剂引起的内源性阿片系统(Benedetti, Amanzio, & Maggi, 1995; Benedetti, 1996),表明CCK在安慰剂止痛中扮演了抑制性的角色。Benedetti et al. (1997)解释了CCK能使反安慰剂条件下的疼痛加强,并且PROG能破坏反安慰剂效果,这一过程独立于阿片。通过结合局部缺血疼痛和言语诱发疼痛,Benedetti et al. (2006)用PROG阻断反安慰剂效应的痛敏,但它对这过程中的焦虑没有效果,但是安定(diazepam)既可以破坏痛敏又可以阻断焦虑。也有研究表明,CCK系统在痛敏和反安慰剂的关系中扮演重要角色(Andre et al., 2005)。总而言之,焦虑与反安慰剂痛敏密切相关。
随着神经影像技术的发展,研究者们逐渐揭开了疼痛反安慰剂效应的脑机制。在人类疼痛的大脑表征中,一条通路把感知疼痛的信号从丘脑运输到躯体运动皮层,另一条通路则产生情绪有关的信号并输送到海马、杏仁核这些区域(Kalat, 2011)。除了涉及到疼痛经验和情绪有关的脑区,反安慰剂效应也涉及到了眶额皮层(OFC) (Kong, Gollub, Polich, Kirsch, Laviolette, Vangel, Rosen, & Kaptchuk, 2008; Scott, Stohler, Egnatuk, Wang, Koeppe, & Zubieta, 2008; Freeman, Yu, Egorova, Chen, Kirsch, Claggett, Kaptchuk, Gollub, & Kong, 2015; Jensen et al., 2015),还有伏隔核(NAC) (Scott, Stohler, Egnatuk, Wang, Koeppe, & Zubieta, 2007; Scott, Stohler, Egnatuk, Wang, Koeppe, & Zubieta, 2008) (见表1)。

Table 1. Summary of models and methods used to study nocebo effect in pain
表1. 被用来研究反安慰剂效应的不同疼痛模型和方法
2. 反安慰剂的机制
这部系统综述了反安慰剂效应的三个方面的机制:心理学,生物化学,脑机制。1) 反安慰剂有两个心理机制,预期和条件化;2) 反安慰剂与胆囊收缩素密切相关;3) 除了疼痛经验本身相关的脑区外,奖赏回路和情绪相关脑区也涉及。
2.1. 心理机制
反安慰剂效应,与安慰剂效应相反,通过对疼痛的消极预期来诱发痛敏。其中涉及了两个机制:消极预期和条件化。
对疼痛的消极预期会诱发疼痛患者痛敏(Spiegel, 1997),这种现象也会发生在健康被试身上。通过结合缺血性疼痛和言语诱导的焦虑,Benedetti et al. (2003)对健康成年人的研究发现,消极预期不但能导致反安慰剂痛敏,而且还能抵消安慰剂效应引发的镇痛作用。以健康被试为研究对象,Benedetti et al. (2006)揭示了在反安慰剂组的疼痛评级更高,Colloca et al. (2008)随后也有类似发现。
条件化在反安慰剂痛敏中也起到重要作用。Jensen et al. (2015)把人脸图片分别和高中低程度疼痛刺激建立条件反射,在之后的测验中,呈现疼痛面孔图片同时进行中等强度疼痛刺激,让被试进行疼痛评分。结果发现,当呈现与高疼痛刺激相关的图片时,被试的疼痛评分显著高于其它两种条件下的疼痛评分。
但是与之前关于条件化的设想相反,反安慰剂痛敏的形成过程并不一定需要意识的参与,无意识也能导致反安慰剂痛敏(Jensen et al., 2012; Jensen, Kaptchuk, Chen, et al., 2015; Jensen, Kirsch, Odmalm, et al., 2015)。
2.2. 生物化学机制
胆囊收缩素(cholecystokinin, CCK)和丙谷胺(proglumide, PROG)在反安慰剂痛敏过程中已经被详细的研究过。
CCK和PROG与内源性阿片密切相关,而内源性阿片能够缓解疼痛。CCK分布于大脑皮层灰质,导水管周围灰质,腹内侧丘脑,脊髓背角,这些区域都与疼痛调节有关(Baber et al., 1989),并且CCK能拮抗内源性阿片系统(Watkins, Kinscheck, & Mayer, 1984; Watkins, Kinscheck, Rosenquist, Miller, Wimberg, Frenk, Kaufman, Coghill, Suberg, & Mayer, 1985; Watkins, Kinscheck, Kaufman, Miller, Frenk, & Mayer, 1985)。PROG,是CCK的拮抗剂,能够增强安慰剂效应引起的内源性阿片的释放(Watkins et al, 1984; Watkins, Kinscheck, Rosenquist, et al., 1985; Watkins, et al., 1985; Baber et al, 1989; Benedetti et al., 1995; Benedetti, 1996),表明CCK在安慰剂止痛中起到抑制作用。
焦虑也在反安慰剂痛敏中涉及到并且CCK系统在焦虑诱发的痛敏中也扮演着重要作用。Benedetti et al. (1997)解释CCK能导致反安慰剂组被试的疼痛增加,但是PROG能破坏反安慰剂效果,而不涉及阿片机制。通过止血带技术,结合言语诱发疼痛,Benedetti et al. (2006)对之前的研究进行了完善,他在健康被试身上发现,PROG能破坏反安慰剂痛敏,却不能破坏海马–垂体–肾上腺(HPA)轴的激活,然而安定却能对两者进行破坏。又因为安定是抗焦虑类药物,这说明PROG不能对痛敏中的焦虑成分起作用。另外,Andre et al. (2005)在大鼠身上也发现CCK系统在焦虑和痛敏的关系中有所涉及。
此外,安慰剂和反安慰剂效应涉及到了相反的多巴胺和内源性阿片系统的机制,反安慰剂效应中观察到了多巴胺和阿片释放的减少(Scott et al, 2008),表明涉及到了奖赏机制(见图1,Benedetti et al., 2003)。
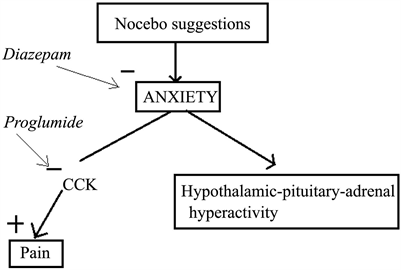
Figure 1. Model to explain the biochemical mechanism of nocebo effects
图1. 解释反安慰剂效应的生化机制的模型
2.3. 脑机制
大脑皮层的几个脑区涉及到了疼痛伤害输入,包括躯体运动皮层、扣带回、脑岛,在这其中,脑岛收到来自丘脑的直接投射,尤其是内侧核和腹后内侧核(Kandel, Schwartz, Jessell, Siegelbaum, & Hudspeth, 2015)。关于安慰剂效应有详尽的研究,为数不多的研究探索了反安慰剂的脑机制(Ploghaus, Becerra, Borras, & Borsook, 2003; Scott et al., 2007; Scott et al., 2008; Jensen et al., 2015)。但是这些都是一些创造性又令人钦佩的工作。
反安慰剂的影像研究揭示了奖赏加工在疼痛预期中有涉及到。通过预期和条件化程序,Jensen et al. (2015)对健康被试的研究发现,与有意识的条件化安慰剂镇痛相比,无意识条件与眶额皮层的激活上升有关,这是一个与情绪和基本奖赏脑区有关的结构。之前的研究也发现眶额皮层在反安慰剂痛敏中被激活(Scott et al., 2008; Kong et al., 2008; Freeman et al., 2015)。除此之外,伏隔核也被发现在反安慰剂效应过程中被激活(Scott et al., 2008)。研究者在安慰剂条件下观察到伏隔核中多巴胺释放,高安慰剂反应与伏隔核更高的多巴胺和内源性阿片释放有关,但是反安慰剂效应条件下多巴胺和内源性阿片释放却减少了(Scott et al., 2007; Scott et al., 2008) (过程见图2,Scott et al., 2008)。
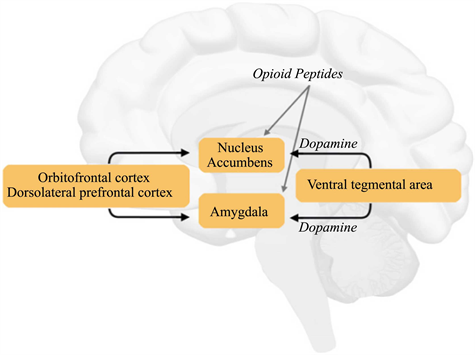
Figure 2. Brain regions involved in dopaminergic system
图2. 涉及多巴胺系统的脑区
然而,很少有研究关注把预期从疼痛中分离出来。Ploghaus, Tracey, Gati, Clare, Menon, Matthews, et al. (1999)把功能核磁共振应用于研究疼痛中的预期的脑机制,并发现疼痛预期激活了内侧额叶、脑岛、小脑,这些区域临近疼痛经验本身激活的脑区。
另一方面,脑岛也在反安慰剂痛敏过程中被激活(Ploghaus et al., 1999; Kong et al., 2008; Scott et al., 2008; Schmid et al., 2013; Freeman et al., 2015)。脑岛与识别厌恶刺激有关(Gazzaniga, Ivry, Mangun, & Steven, 2009)。显而易见,疼痛是一种厌恶刺激,可以理解脑岛在反安慰剂效应中被激活。
研究者们也关注了威胁和疼痛信号的直接加工。Jensen et al. (2015)发现反安慰剂效应中皮层下一些结构的激活,包括丘脑,杏仁核,海马,与之前的研究结果一致(Kong et al., 2008; Scott et al., 2008)。关于恐惧的研究发现,情绪刺激的暗示(基于海马)对杏仁核活动有影响,可以间接调节情绪反应(Gazzaniga et al., 2009)。考虑到大部分研究用消极暗示诱发痛敏,海马和杏仁核在这其中起作用是可以解释的。
3. 对反安慰剂效应的一些未来研究思路
Ploghaus et al. (1999)在影像研究中把预期从疼痛中分离出来,并且发现疼痛的预期激活了额叶中部、脑岛和小脑。这些脑区与调节疼痛经验的脑区的位置相近。那是为数不多的把疼痛从预期中分离出来的研究。预期也是疼痛的组成成分,未来的疼痛中反安慰剂的研究需要调查涉及了预期的脑区,来更好的了解疼痛中发安慰剂效应的脑机制。
之前的研究已经检查了疼痛的反安慰剂效应中大脑的奖赏加工,并且观察到在安慰剂模型下伏隔核中多巴胺释放的增加,高安慰剂反应与伏隔核与更多的多巴胺释放有关,但是反安慰剂反应与多巴胺和阿片释放降低有关(Scott et al., 2007; Scott et al., 2008)。但是反安慰剂痛敏中奖赏环路的特定作用还需要进一步的研究。