1. 引言
干扰素(Interferon, IFN)是一类具有广泛的抗病毒、抗肿瘤和免疫调节等作用的由多种细胞分泌的多功能糖蛋白。正常细胞一般不会自发产生,只存在合成的潜能,其基因通常处于被抑制的静止状态,只有当机体受到特定诱生剂刺激,如病毒、某些细菌和原虫感染等情况下才诱发细胞产生干扰素。干扰素的细胞来源因动物种类、细胞类型、诱生剂的性质和诱生条件而异,可分为来自白细胞的α干扰素,来自纤维母细胞的β干扰素和来自淋巴细胞及NK细胞的γ干扰素 [1] 。其中,耐酸的IFN-α干扰素和IFN-β,又合称为I型干扰素;对酸敏感的γ干扰素称为II型干扰素或免疫干扰素 [2] ;近年新发现的III型干扰素是一类细胞因子,称为λ干扰素。干扰素的生物学功能发挥是通过与特异性受体结合,诱导细胞表达多种效应蛋白质而实现的。干扰素主要通过介导信号转导系统引起特定反应,诱导效应分子的表达 [3] ,而干扰病毒的复制,并不是直接作为反式因子对效应分子进行基因调控。
IFN-γ全基因为501个碱基,编码166个氨基酸,前20个氨基酸为信号肽,后146个氨基酸为成熟多肽,含有两个糖基化位点 [4] 。研究表明,猪γ干扰素原核表达产物经复性后具有较高的生物活性 [5] 。国内外研究表明,猪γ干扰素在抑制猪口蹄疫病毒,蓝耳病病毒和非洲猪瘟病毒的试验中均取得了良好效果 [6] ,γ干扰素对清除中枢神经系统中持续感染的疱疹病毒也起关键作用 [7] 。研究还表明,猪γ干扰素能增强仔猪对痢疾抗原的免疫应答 [8] ,在沙门氏菌感染中也起着重要作用 [9] 。猪传染性胃肠炎(Transmissible gastroenteritis, TGE)是由猪传染性胃肠炎病毒(Transmissible gastroenteritis virus, TGEV)引起的以猪发生呕吐、水样腹泻等症状为特征的一种急性、高度接触性传染病。2周龄以下的仔猪死亡率高达100%,严重危害着养殖业的发展。目前我国尚没有有效的治疗手段遏制该病情的发生。
近年来,养猪业在我国得到了快速的发展,规模化养猪场的数量在不断增加,病毒性疾病的爆发给养猪业增添了风险,并且某些人畜共患病也严重威胁着人类的公共卫生安全。本试验的目的主要是通过杆状病毒/昆虫细胞表达系统,生产具廉价、高效等优点的广谱抗病毒制品,为生产中治疗和预防疾病发生、促进养殖业健康发展及开发更高效优质的新一代疫苗佐剂奠定基础。
2. 材料和方法
2.1. 主要材料与试剂
Sf9昆虫细胞购自齐氏生物科技有限公司;PK-15细胞为西南大学刘娟教授惠赠;大肠杆菌DH5α菌株、大肠杆菌DH10BacTM菌株、TGEV CQ株由本实验室保;RNA PCRTM Kit(AMV)Ver3.0、RNAiso Plus、pMD19-T Vector试剂盒、SYBR®Premix Ex TaqTM II试剂盒购自TaKaRa公司产品;Gel Extraction Kit胶回收试剂盒购自OMEGA公司;PRMI1640培养基购自上海英俊生物技术有限公司;淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;Bac-to-Bac杆状病毒表达系统、pFastBacTM Dual载体试剂盒购自Invitrogen公司;GV-plasmid DNA mini Extration kit小量质粒提取试剂盒购自GENVIEW公司;Grace’s无血清培养基、DMEM培养基购自Gibco公司;荧光素(FITC)标记的羊抗兔IgG购自Sigma公司;兔抗猪IFN-γ多克隆抗体购自上海通蔚实业有限公司。
2.2. 引物设计与合成
通过Primer5.0软件,根据参考文献报道和Gene Bank发布的序列设计IFN-γ、TGEV N基因荧光定量PCR引物,上、下游引物分别引入EcoR I和Xho I限制性酶切位点,序列如表1所示。

Table 1. IFN-γ, TGEV-N primer sequence
表1. IFN-γ、TGEV-N引物序列
上述引物由上海生工生物工程技术有限公司合成。
2.3. 荣昌猪γ干扰素基因的克隆及序列分析
利用刀豆素诱导荣昌猪外周血液淋巴细胞,提取淋巴细胞总RNA并反转录为cDNA;以cDNA为模板,利用聚合酶链式反应(PCR)扩增荣昌猪IFN-γ基因片段。反应体系如表2所示。
反应参数:94℃预变性3 min;94℃变性30 s、56℃退火1 min、72℃延伸50 s,进行30个循环;最后72℃延伸10 min。PCR产物用0.8%琼脂糖凝胶电泳,在凝胶成像系统下观察结果。将PCR扩增的目的基因克隆于原核表达质粒pMD18-T的EcoR I和Xho I的位点,转化DH5α,经IPTG诱导,PCR扩增及双酶切鉴定重组质粒表达,送上海生工生物公司测序及利用DNAstar软件与已发表的猪种的γ干扰素基因进行同源性比较。
2.4. 重组猪γ干扰素的杆状病毒表达及鉴定以pMD-IFN-γ
阳性重组质粒为模板进行PCR扩增,EcoR I和Xho I分别双酶切pFastBacTM Dual载体质粒和PCR产物并在T4连接酶作用下连接IFN-γ基因与pFastBacTM Dual载体得到重组转移质粒命名为pFastBacTM Dual-IFN-γ,转化DH5α感受态细胞,通过蓝白斑筛选,PCR鉴定出阳性重组转移质粒,并将阳性重组转移质粒转化至DH10BacTM感受态细胞,提取质粒,PCR鉴定出阳性重组穿梭质粒rBacmid-IFN-γ,纯化后转染Sf9昆虫细胞。待细胞出现病变后,扩增重组病毒,蛋白酶-K-SDS-酚-氯仿抽提病毒基因组DNA,以M13-48f、M13-47r为引物PCR验证目的基因在重组病毒中是否获得稳定重组,并间接免疫荧光(IFA)检测重组蛋白的表达。
2.5. 重组猪干扰素-γ体外抗病毒活性的测定
用TGEV-PK-15病毒细胞系统测定其病毒活性,以密度为2 × 106个/mL将PK-15细胞接种到六孔细胞培养板中,分成三个实验组,待细胞贴壁形成单层后,分别加入收集rBacmid-IFN-γ感染后昆虫细胞的细胞裂解液和含2%胎牛血清的DMEM培养基,并且每孔加入含100 TCID50的病毒,于37℃,5%CO2条件下培养,分别收集0 h、4 h、8 h、12 h、24 h、36 h、48 h、72 h三个试验组的上清并提取细胞的RNA并反转录为cDNA,取经序列测定验证的阳性重组质粒,稀释7个梯度,作为实时荧光定量PCR阳性标准模板进行荧光定量PCR扩增。反应体系如表3所示。

Table 3. RT-PCR reaction system
表3. 荧光定量PCR反应体系
将以上各组分充分混匀,瞬时离心后,在Eppendorf PCR仪上进行反应。
反应参数:95℃预变性3 min;94℃变性30 s、55℃退火30 s、72℃延伸30 s,40个循环。
利用Bio-Rad CFX Manager软件进行分析,得到扩增曲线和标准曲线。之后进行重复性试验。分析rPoIFN-γ是否能在PK-15细胞上抑制TGEV的复制。
3. 结果
3.1. 荣昌猪γ干扰素基因的克隆及序列分析
提取的RNA进行逆转录得到的cDNA为模板,分别引入EcoR I和Xho I限制性酶切位点的IFN-γ-F 和IFN-γ-R为引物,进行猪IFN-γ基因的PCR扩增出一条大小约为600 bp的DNA片段(图2);将IFN-γ基因经胶回收纯化后,克隆至pMD18-T载体,将PCR和双酶切鉴定结果阳性的重组克隆质粒(图1)送至生物技术公司完成测序,测序结果表明扩增的目的片段全长603 bp (Genbank收录号是GU433229),包括了由166个氨基酸组成的完整的开放阅读框。根据测序结果表明荣昌猪IFN-γ基因长603 bp,利用DNA star软件与GenBank上发表的IFN-γ基因序列进行核苷酸序列分析得到同属之间(图2)与DQ839398 (长白猪)、AY293733 (成华猪)等猪种同源性最高,为99.8%;与X53085 (野猪)同源性最低,为96.8%;不同属之间与AB107652 (骆驼)同源性最高,为84.8%;与EF614201 (羊)同源性最低,为60.7%;其中与Genbank刊载的DQ902588 (荣昌猪)同源性为99.2% (图3)。
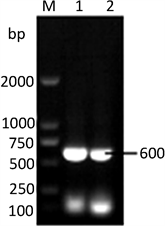
Figure 1. Agarose electrophoresis analysis of the PCR production of porcine IFN-γgene; M: DL2000 DNA Marker; 1: PCR production of poIFN-γgene
图1. 猪 IFN-γ基因的PCR产物电泳分析;M:DL2000标准分子量;A:猪IFN-γ基因的PCR产物

Figure 2. Percent identity analysis of interferon-gamma
图2. 同种属间的同源性分析

Figure 3. Homology of different species
图3. 不同种属间的同源性分析
3.2. 重组猪γ干扰素的杆状病毒表达及鉴定
将重组阳性转移质粒pFastBacTM Dual-IFN-γ转化DH10BacTM感受态细胞,经抗性及蓝白斑筛选,获得阳性重组菌,用重组杆状病毒rBacmid-IFN-γ感染对数生长期的Sf9昆虫细胞,提取重组杆状病毒rBacmid-IFN-γ的基因组,用M13通用引物进行PCR鉴定,扩增出的条带约3000 bp大小,与预期结果符合(图4);用猪IFN-γ重组杆状病毒感染Sf9昆虫细胞,72 h后细胞出现明显的病变,细胞变大,生长缓慢、停滞(图5);用阳性重组杆状病毒rBacmid-IFN-γ和野生杆状病毒Bacmid分别感染对数生长期的Sf9昆虫细胞,培养72 h或至出现病变,收集上清和昆虫细胞裂解液制成蛋白样品,同时设置正常Sf9昆虫细胞作为对照,进行SDS-PAGE分析。结果显示重组杆状病毒rBacmid-IFN-γ感染的Sf9昆虫细胞裂解液蛋白样品出现了大小约为20KDa的条带,感染野生杆状病毒的Sf9昆虫细胞和正常sf9昆虫细胞、培养上清蛋白样品均没有类似条带(图6)。将鉴定正确的重组杆状病毒rBacmid-IFN-γ感染对数生长期的Sf9昆虫细胞,培养72 h或至出现病变后,进行间接免疫荧光检测。结果显示,rBacmid-IFN-γ感染的Sf9细胞与对照组相比在荧光下发出了特异性荧光,表明重组猪γ干扰素在Sf9细胞中得到表达(图7)。
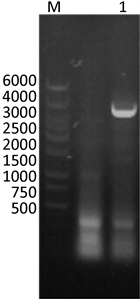
Figure 4. Identification of recombinant of the rBacmid-IFN-γ; M: DL6000 DNA Marker; 1: PCR production of rBacmid-IFN-γ
图4. 重组杆状病毒的PCR鉴定;M:DL6000标准分子量;1:重组杆状病毒PCR扩增产物

Figure 5. Cytopathic effect of sf9 infected with PoIFN-γrecombinant baculovirus; A: Normal Sf9 cells; B: Sf9 cells with IFN-γrecombinant baculovirus
图5. 猪IFN-γ重组杆状病毒感染Sf9细胞后的细胞病变;A:正常Sf9细胞;B:猪IFN-γ重组杆状病毒感染后的Sf9细胞

Figure 6. Analysis of recombinant PoIFN-γby SDS-PAGE; M: Protein Marker; 1: culture supernatant of Sf9 infected by wild baculovirus; 2: lysis liquid of Sf9 cells infected by wild baculovirus; 3: culture supernatant of Sf9 infected by recombinant baculovirus; 4: lysis liquid of Sf9 cells infected by recombinant baculovirus; 5: culture supernatant of normal Sf9 cells; 6: lysis liquid of normal Sf9 cells
图6. SDS-PAGE分析猪IFN-γ蛋白在sf9昆虫细胞中的表达;M:蛋白Marker;1:感染野生杆状病毒后培养上清;2:感染野生杆状病毒后细胞裂解液;3:感染重组杆状病毒后培养上清;4:感染重组杆状病毒后细胞裂解液;5:正常Sf9昆虫细胞培养上清;6:正常Sf9昆虫细胞裂解液

Figure 7. Identification of PoIFN-γprotein expression with IFA; A: negative control; B: Sf9 cells with rBacmid-IFN-γ
图7. 间接免疫荧光鉴定猪IFN-γ的表达;A:阴性对照;B:Bacmid-IFN-γ感染的Sf9细胞
3.3. 重组猪干扰素-γ体外抗病毒活性的测定
将TGEV病毒接种单层且生长活力大于95%的PK-15细胞培养,每天观察病变情况,当病变达到80%以上的时候按三冻三融的方法将病毒收集,TGEV在PK-15细胞上的病变如图8。
分别提取收集样品的总RNA进行反转录,利用特异性荧光定量引物对克隆的阳性质粒进行PCR鉴定,扩增的条带大小约为139 bp的条带,与预期相符,见图9。

Figure 8. Cytopathic effect of sf9 infected with TGEV; A: Normal PK-15 cells; B: Sf9 cells with IFN-γ recombinant baculovirus; C: PK-15 cells effected by TGEV After rPoIFN-γ processed
图8. TGEV接种PK-15细产生的细胞病变;A:正常PK-15细胞;B:接种TGEV的PK-15细胞;C:经重组PoIFN-γ处理的PK-15细胞接种TGEV

Figure 9. Identification of the PCR product ofplasmid; M: DL2000 DNA Marker; 1: PCR product of plasmid
图9. 阳性克隆质粒的PCR鉴定;M:DL2000标准分子量;1:阳性克隆质粒PCR扩增产物
根据质粒拷贝数计算公式计算出质粒拷贝数为4.55 × 1012 copies/μL,做10倍稀释后使用4.55 × 1011、4.55 × 1010、4.55 × 109、4.55 × 108、4.55 × 107、4.55 × 106、4.55 × 105 copies/μL 7个稀释度为模板进行荧光定量PCR,通过Bio-Rad CFX Manager软件分析得到荧光定量标准曲线。结果显示在模板稀释度范围内出现7条“S”型特异性扩增动力学曲线(见图10),得到比较理想的标准曲线,y = −3.436x + 45.552 (y为Ct值,x为Lg quantity),相关系数R为0.998,扩增效率为95.4%,标准品各稀释度扩增产物的溶解温度在80.5℃~81℃,平均融解温度为80.8℃ (见图11),且只有一个融解波峰,结果理想。重复性实验结果显示(见图12),同一浓度样品所得的“S”型曲线接近,实际所得的Ct值也基本相同,样品融解温度均为81℃,且只有一个融解波峰。
将反转录产物按建立的荧光定量PCR体系进行荧光定量PCR分析。荧光定量PCR反应中,每个模板的Ct值都与起始拷贝数的对数存在线性关系,起始拷贝数越大则Ct值越小。结果表明,用猪γ干扰素重组杆状病毒作用过的PK-15细胞能一定程度阻止TGEV进入PK-15细胞并抑制其在细胞内的增殖,见图13。
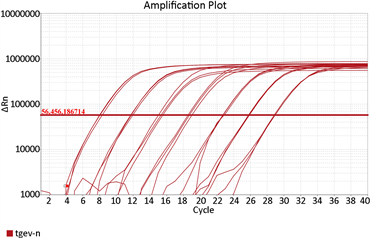
Figure 10. Amplification (A) and standard curve (B) of real-time PCR for the detection of TGEV N
图10. TGEV N基因荧光定量PCR扩增曲线(A)和标准曲线(B)
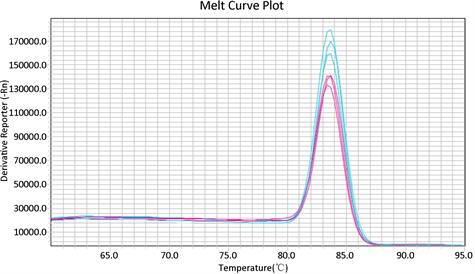
Figure 11. Melting curves of real-time PCR for the detection of TGEV N
图11. TGEV N基因荧光定量PCR溶解曲线

Figure 12. Amplification (A) and Melting curves of the repeatability test
图12. 重复性试验的扩增曲线(A)和溶解曲线(B)
4. 讨论
国际上最先克隆的干扰素为IFN-γ,由日本的Taniguch等人在1979年完成。1980年Derynck等克隆了人干扰素基因,1981年Goeddel报道IFN-γ基因克隆成功。我国干扰素的基因工程研制最初是由侯云德教授开始的,1982年建立了无性繁殖系统,并于1985年成功表达出干扰素 [3] 。后来,陈炬等 [9] 人首次在烟草植株中表达成功人IFN-α基因。随后,人IFN-γ基因也在烟草中获得成功表达。新型载体不

Figure 13. Analysis by real-time PCR; A: culture supernatant of PK-15 effected by TGEV; B: culture supernatant of PK-15 effected by TGEV After rPoIFN-γ processed; C: cells of PK-15 effected by TGEV; D: cells of PK-15 effected by TGEV After rPoIFN-γ processed
图13. 荧光定量PCR分析;A:感染TGEV的PK-15细胞培养上清;B:经猪γ干扰素重组杆状病毒作用的PK-15细胞感染TGEV的培养上清;C:感染TGEV的PK-15细胞;D:经猪γ干扰素重组杆状病毒作用的PK-15细胞感染TGEV的细胞
断构建成功,新的亚型干扰素基因也陆续被克隆和表达。柴玉波等构建了新型双顺反子表达载体pEC34;江漪 [10] 等构建了人IFN-γ植物双元表达载体;夏春等克隆和测序了猪IFN-γ基因;目前国内对于品种优良的地方猪种的研究比较少,本试验成功将地方猪种——荣昌猪的IFN-γ进行克隆及序列分析,更好地为进一步成功的表达出该干扰素提供材料。
本试验从荣昌猪外周血淋巴细胞中成功克隆了IFN-γ基因,并将获得到的IFN-γ基因与GenBank上发表的猪IFN-γ基因进行核苷酸同源性比较,得到同属之间与DQ839398 (长白猪)、AY293733 (成华猪)等猪种同源性最高,为99.8%,两者之间的差异性仅在235号碱基T变成了C。与X53085 (野猪)同源性最低,为96.8%;不同属之间与AB107652 (骆驼)同源性最高,为84.8%;与EF614201 (羊)同源性最低,为60.7%;与Genbank刊载的DQ902588 (荣昌猪)同源性为99.2%,两者之间发生了131位碱基G-A,169位碱基G-A,235位碱基T-C,355位碱基G-A的颠换。而这四个地方碱基对的颠换只有第131位的碱基对所编码的氨基酸发生了Pro-Leu的变化。与Genbank刊载的DQ839398 (长白猪)的IFN-γcDNA序列之间仅在235位碱基T-C发生了颠换,而这个颠换没有改变所编码的氨基酸(Leu)种类。推测氨基酸的变化可能对IFN-γ蛋白的理化性质、生物学活性有一定的影响。这些影响还有待进一步研究。
目前市场上使用的猪干扰素大多是通过大肠杆菌表达的,但是由于原核表达系统存在缺陷,表达的重组蛋白无法实现天然状态的修饰和折叠,而必须经过变性复性后使用,大大折损其效果,应用不太理想。相对原核表达系统而言,真核表达系统具有翻译后的加工修饰系统,表达的重组蛋白更接近天然蛋白质。在昆虫细胞中表达重组蛋白,王彦彬 [11] 分别用带蜂素信号肽和不带蜂素信号肽的重组杆状病毒感染sf9昆虫细胞进行重组蛋白的表达,发现二者在昆虫细胞中表达的蛋白分布存在显著差异。本试验中,表达的重组蛋白极少被分泌到细胞培养上清中,应用杆状病毒表达系统对猪干扰素进行表达的条件有待改进和提高。
干扰素抗病毒活性的检测最常见的方法就是细胞病变抑制法,秦立廷 [12] 等人用VSV*GFP-MDBK细胞系统测定了重组牛IFN-γ的抗病毒活性,重组VSV*GFP可以在宿主细胞内复制,并表达绿色的荧光蛋白,故通过观察荧光强度和数量就能测定重组干扰素的抗病毒活性,与传统的细胞病变抑制法通过直接观察细胞病变相比更直观且简单,是检测抗病毒活性的好选择。本试验将目的基因与转移载体pFastBacTM Dual连接构建了重组转移载体pFastBacTM Dual-IFN-γ,转化DH10BacTM感受态细胞,通过X-gal、IPTG和抗性筛选,获得重组穿梭质粒Bacmid-IFN-γ。Bacmid-IFN-γ转染Sf9昆虫细胞,得到重组杆状病毒,经过扩大培养获得稳定扩增的重组杆状病毒。通过SDS-PAGE和IFA鉴定,发现表达的重组蛋白主要存在于感染了重组杆状病毒的Sf9细胞上,并不能在Sf9昆虫细胞培养上清中进行大量分泌,在上清中重组蛋白量少,SDS-PAGE电泳的灵敏度不足以将其分辨出来,表明应用杆状病毒表达系统对猪干扰素进行表达的条件有待改进和提高。
本试验采用SYBR荧光染料法进行Real-time PCR检测并对起始模板的拷贝数进行分析,结果表明rPoIFN-γ能一定程度阻止TGEV在PK-15细胞中的增殖复制。试验用来处理PK-15细胞的重组PoIFN-γ感染昆虫细胞的细胞裂解液并未进行纯化浓缩,浓缩纯化后的抑制效果应该会更好。亦或将重组猪γ干扰素表达成蛋白,纯化后抑制病毒的效果想必要较为可观,重组猪IFN-γ能一定程度抑制病毒在细胞内的复制增殖。