1. 引言
铜是许多生物体必需的一种微量元素 [1] [2] ,在骨骼形成和细胞呼吸等生理和病理过程中起着重要作用,在血红蛋白、弹性蛋白和胶原的合成过程中重要的催化辅助作用 [3]。缺乏铜会导致多种疾病,如贫血、全血细胞减少和骨髓异常等 [4]。过量摄取铜也会对生物体造成毒害,给肝脏、肾脏和中枢神经系统造成严重损害(如Wilson氏病和老年痴呆症)。因此,建立一种操作简便、准确测定茶叶中痕量的铜的方法是十分必要的。
常用的铜离子检测方法有:原子吸收光谱法(AAS) [5] [6] 、电感耦合等离子体原子发射光谱法(ICP-OES) [7] [8] 、电感耦合等离子体质谱法(ICP-MS) [9] 和荧光分析法 [10] [11] [12] 等。
CDs作为一种荧光纳米材料,因具有良好的生物相容性、较低的细胞毒性、突出的光学性质以及良好的化学稳定性而成为研究的热点。
荧光探针检测技术具有检出限低、选择性高等优点,在食品、环境、生物等领域的重金属离子检测、有机小分子检测和生物大分子检测过程中得到了广泛的应用。
本文以柠檬酸为碳源,去离子水为溶剂,通过水热法制备CDs,并用邻苯二胺(OPD)对CDs进行修饰,得到邻苯二胺修饰碳点(CDs-OPD)。实验发现,在BR缓冲介质下,Cu2+与CDs-OPD相互作用,使得CDs-OPD荧光峰强度降低,基于此实现了对茶叶中痕量铜的测定。
2. 实验部分
2.1. 实验仪器
Cary Eclipse荧光光谱仪(Varian,美国);紫外可见分光光度计(UV-2450,日本岛津);傅里叶变换红外光谱仪(WQF-510,北京瑞利分析仪器公司);FA604A电子天平(上海精天电子仪器有限公司);雷磁PHS-3C型pH计(上海精密科学仪器有限公司);DZF-真空干燥箱(北京市永光明医疗仪器有限公司)。
2.2. 实验试剂
一水合柠檬酸(AR, Aladdin),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC HCl, AR, Aladdin),N-羟基琥珀酰亚胺(NHS, AR, Aladdin),三羟甲基氨基甲烷(Tris, AR, Aladdin)。磷酸氢二钠(Na2HPO4),磷酸二氢钠(NaH2PO4) (均购自天津市科密欧化学试剂有限公司)。磷酸(H3PO4),硼酸(H3BO3),醋酸(CH3COOH),氢氧化钠(NaOH),盐酸(HCl) (均购自洛阳市化学试剂厂)。
实验用水为去离子水(18 MΩ cm−1),实验所用容器用稀硝酸浸泡24 h,并用去离子水清洗,干燥后备用。
2.3. 邻苯二胺修饰CDs的制备(CDs-OPD)
CDs-OPD的制备主要包括水热法制备CDs和CDs表面修饰两个步骤。如图1所示。
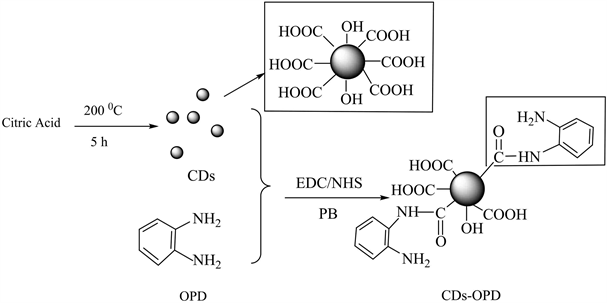
Figure 1. Preparation of o-phenylenediamine (OPD) modified carbon dots
图1. 邻苯二胺修饰CDs的合成示意图
荧光CDs的制备参考文献 [13] 的方法,准确称取2.3 g一水合柠檬酸,用40 mL去离子水溶解,超声并搅拌10 min,使其充分溶解。所得溶液转至60 mL聚四氟乙烯内衬的水热反应釜中,接着把60 mL反应釜放入烘箱中加热(200℃,升温时间为60 min,保温时间为240 min)。反应结束后,冷反应釜冷却至室温,所得溶液经过0.22 μm的有机滤膜过滤,最终得到无色的CDs溶液。
邻苯二胺修饰荧光CDs (OPD@CDs):参考文献 [14] 的方法,利用EDC HCl和NHS的活化偶联反应将OPD连接到CDs的表面。在上述制备的CDs溶液中加入数滴NaOH (10 mol L−1)溶液,调节溶液pH值至7.4,再加入0.192 g的EDC∙HCl,搅拌40 min后再加入等体积的PB缓冲液(0.1 mol L−1, pH 7.4)和0.115 g的NHS,搅拌2 h。然后再加入0.108 g的OPD,磁力搅拌3 h。反应结束后,得到溶液用1000 mL去离子水透析24 h (透析膜孔径为100 Da),除去未反应的反应物和副产物,并将透析液在真空干燥箱(40℃)浓缩至20 mL,即得到CDs-OPD溶液,于4℃冰箱保存。
2.4. 样品处理
茶叶样品购于当地超市(河南,郑州)。分别准确称取0.5 g的茶叶样品,放置于100 mL瓷坩埚内,电炉上加热至没有白烟冒出;然后转至马弗炉中继续加热(500℃ ± 25℃, 5 h),冷至室温后,取出瓷坩埚,用适量稀硝酸溶液(1%, V/V)溶解,然后转移至100 mL的容量瓶中,用去离子水定容。所得溶液用于分析测试。
2.5. 实验方法
于10 mL具塞刻度管中依次加入60 μLCDs-OPD溶液,一定量的Cu2+工作液(或样品溶液),BR缓冲溶液定容(pH 9.0),摇匀后静置5 min,同时做空白实验(不加入Cu2+工作液或样品溶液)。在激发波长260 nm条件下,测定测试液和空白溶液的荧光发射强度(Em 295 nm),分别用F295和
表示,计算
。
3. 结果与讨论
3.1. CDs-OPD的表征
图2是CDs和CDs-OPD的紫外-可见光谱(左)和荧光光谱(右)。由UV-Vis光谱可以看出,CDs在紫外区有弱吸收;邻苯二胺(OPD)在210 nm处有较强吸收;CDs-OPD相比CDs,在210 nm处也出现较强吸收峰。这表明CDs-OPD具有OPD的特征生色团,即OPD连接到了CDs的表面。

Figure 2. The UV-vis spectrum of CDs, OPD and CDs-OPD (left); Fluorescence emission spectrum of CDs and CDs-OPD (right)
图2. CDs、OPD和CDs-OPD的UV-vis光谱(左);CDs和CDs-OPD的荧光光谱(右)
由荧光光谱可以看出,未经表面修饰的CDs在激发波长310 nm处具有最大荧光发射峰(415 nm);经OPD表面修饰后,CDs-OPD的荧光光谱发生了较大变化,在260 nm激发波长条件下,CDs-OPD在295 nm、440 nm、580 nm处出现了三个荧光发射峰。其中440 nm应归因于CDs的荧光发射峰,而580 nm则可能是2,3-二氨基吩嗪的荧光发射峰,而295 nm处的荧光峰则归因于OPD在210 nm处的强吸收。
由图3可以看出,修饰前的CDs在1690 cm−1处出现C=O的伸缩振动吸收峰,1402 cm−1出现C-H的变形振动峰,1217 cm−1出现C-O的伸缩振动吸收峰,947 cm−1出现O-H的变形振动吸收峰;经OPD表面修饰后,CDs-OPD相比CDs,在3460~3400 cm−1出现仲酰胺的N-H吸收,1531.5 cm−1和1290 cm−1处出现强的仲酰胺吸收峰;754 cm−1出现苯环平面外弯曲振动吸收峰。上述特征峰表明OPD成功连接到了CDs的表面。
3.2. Cu2+的检测机理
对CDs-OPD体系的荧光光谱进行扫描(图4左),以260 nm激发波长条件下,CDs-OPD分别在295 nm、440 nm、580 nm处出现三个荧光发射峰,Cu2+与CDs-OPD发生相互作用,使得CDs-OPD在295 nm处的荧光强度降低。从图4可以看出,往CDs-OPD体系中加入一定量的Cu2+时,随着加入的Cu2+含量不断加大,CDs-OPD在295 nm处的荧光发射峰强度不断下降,而且荧光强度降低值与体系中加入的Cu2+含量成线性关系,这可能是由于Cu2+对CDs-OPD具有较强的络合作用,高浓度的Cu2+使得猝灭作用不断增强,从而导致荧光强度降低程度逐渐变大。
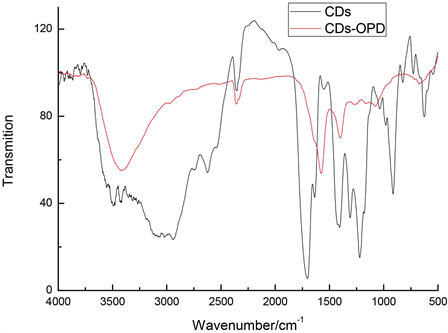
Figure 3. The FT-IR spectrum for CDs and CDs-OPD
图3. CDs和CDs-OPD的FT-IR光谱
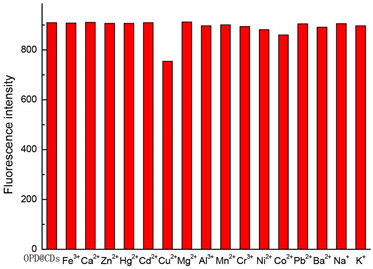
Figure 4. The fluorescence quenching for CDs-OPD (left, 60 μL CDs-OPD, 25˚C, 5 min, pH 9.0 BR buffer solution);The selectivity of the CDs-OPD probe (right, concentration of interference substance, 100 ng∙mL−1, 60 μL CDs-OPD, pH 9.0 BR buffer solution, 25˚C, 5 min)
图4. CDs-OPD的荧光猝灭趋势图(左,CDs-OPD (60 μL),25℃,5 min,BR缓冲溶液(pH 9.0))和CDs-OPD荧光探针的选择性(干扰离子浓度均为100 ng∙mL−1) (右,CDs-OPD (60 μL),BR缓冲溶液(pH 9.0),25℃,5 min)
往CDs-OPD中加入不同类型的金属离子(浓度均为100 ng mL−1),并用BR溶液定容。然后以260 nm为激发波长,测量295 nm处的荧光发射峰强度,结果如图4右所示,除了Co2+、Ni2+对CDs-OPD体系的荧光有小幅度影响外,其余大部分的金属离子基本不对CDs-OPD体系的荧光产生影响,加入Cu2+后,对CDs-OPD体系的荧光强度影响最大,说明CDs-OPD中的基团对Cu2+具有较高的选择性。
3.3. CDs-OPD + Cu2+传感体系的优化
对影响荧光降低程度的pH值进行了优化。如图5左可知,当pH由弱酸性变化至碱性时(6~8.0),CDs-OPD体系和CDs-OPD + Cu2+体系的荧光强度均快速增大;当pH由碱性变化至强碱性时(8~10.0),CDs-OPD体系的荧光强度值在pH为9.0时最大,而此时CDs-OPD + Cu2+体系的荧光强度值最小,此时荧光强度降低程度最大,所以选择9.0作为反应的pH。
Figure 5. Effect of pH on ∆F (left, 60 μL CDs-OPD, Cu2+ 100 ng∙mL−1, BR buffer, 25˚C, 5 min) and Effect of time on ∆F (right, 60 μL CDs-OPD, Cu2+ 100 ng mL−1, pH 9.0 BR buffer, 25˚C)
图5. pH对∆F值的影响(左,CDs-OPD (60 μL),Cu2+ (100 ng∙mL−1),BR缓冲溶液,25℃,5 min)和时间对∆F值的影响(右,CDs-OPD (60 μL),Cu2+ (100 ng∙mL−1),BR缓冲溶液(pH 9.0),25℃)
如图5右所示,1~10 min内,CDs-OPD体系的荧光强度保持不变,CDs-OPD + Cu2+体系的荧光强度在5 min时荧光值最低,此时荧光减低程度最大,因此选择5 min作为Cu2+猝灭CDs-OPD的反应时间。
3.4. 干扰离子的影响
根据实验方法,研究了多种干扰离子(100 ng∙mL−1)对CDs-OPD + Cu2+体系荧光强度的影响。这里我们规定当CDs-OPD + Cu2+ + 干扰离子体系的荧光强度变化值F2值小于CDs-OPD + Cu2+体系的荧光强度变化值 值的偏差小于 ±10%时,符合该条件的干扰离子最大浓度则为该干扰离子最大允许浓度。所考察的常见干扰离子的最大允许浓度列于表1,从表1可以看出,绝大部分的离子对CDs-OPD + Cu2+分析体系没有干扰。
值的偏差小于 ±10%时,符合该条件的干扰离子最大浓度则为该干扰离子最大允许浓度。所考察的常见干扰离子的最大允许浓度列于表1,从表1可以看出,绝大部分的离子对CDs-OPD + Cu2+分析体系没有干扰。

Table 1. The interference tolerance of metal ions
表1. 干扰离子的最大允许浓度
Continued
3.5. 实际样品分析
将该方法应用于三种茶叶样品中痕量Cu2+的测定,分析结果和加标回收实验结果列于表2。加标回收率在91.5%~108.5%之间,表明该方法具有较好的灵敏度和准确性。

Table 2. Determination of Cu2+ in tea samples (n = 3, mean ± SD, µg g−1)
表2. 茶叶中痕量Cu2+测定(n = 3, mean ± SD, µg g−1)
4. 结论
以柠檬酸为碳源,通过水热法制备CDs,以邻苯二胺对CDs进行表面修饰,得到了邻苯二胺修饰CDs (CDs-OPD),所得CDs-OPD在260 nm激发波长条件下,具有295 nm、440 nm、580 nm三个荧光发射峰,Cu2+与CDs-OPD相互作用,使得CDs-OPD在295 nm处的荧光峰强度降低,基于此实现了对茶叶中痕量铜的测定,该方法具有操作简单、准确定量的特点。
基金项目
河南工业大学科教融合项目:掺杂碳量子点的制备及其食品分析应用。