1. 引言
众所周知,银和银离子是广谱抗菌剂,具有强烈的抑菌和杀菌作用 [1] 。 一般认为,银离子与细菌体内蛋白质上的巯基(-SH)发生化学反应,导致蛋白质失活 [2] 。从抗菌产品到环境中的银离子浸出风险很大,中国的饮用水和地表水质量标准设定为0.05 ng∙mL−1。因此,越来越需要监测抗菌产品浸出溶液中浓度不断降低的银含量。为此,需要灵敏度高,便捷,快速且低成本的分析方法。
目前,Ag+检测方法主要集中在火焰原子吸收法(FAAS) [3] [4] [5] ,电感耦合等离子体–原子发射光谱法/质谱法(ICP-AEC/MS) [6] ,荧光分析法 [7] [8] [9] [10] ,电化学方法(ECL) [11] [12] [13] 等等。与其他光谱分析方法相比,化学发光法无背景光干扰,操作简单,仪器价格适中,无需专业培训,检测时间短,灵敏度高等优点,受到了越来越多的关注 [14] [15] [16] [17] 。
本文制备的Eu-CDs,对Luminol-KMnO4具有强烈增敏作用,而Ag+可以增加Luminol-KMnO4-Eu-CDs体系的化学发光强度,从而建立了一种快速,高效,灵敏的检测痕量Ag+的方法,实验表明此方法对痕量Ag+的检测效果良好。
2. 实验部分
2.1. 仪器设备
BPCL-1-KGC型超微弱发光测量仪(中科院生物物理研究所)
RF-6000荧光分光光度计(岛津企业管理中国有限公司)
UV-2450紫外可见分光光度计(岛津企业管理中国有限公司)
QF-510FT-IR傅里叶变换红外光谱仪(北京瑞利分析仪器公司)
ESCALAB 250Xi X射线光电子能谱仪(XPS,赛默飞中国有限公司)
JEOJ JEM-2011透射电子显微镜(TEM,日本电子株式会社)
2.2. 试剂及溶液配制
鲁米诺(Luminol),高锰酸钾(KMnO4),三乙烯四胺(TETA),氢氧化钠,硝酸银(AgNO3)六水合氯化铕(EuCl3·6H2O),乙二胺四乙酸二钠(EDTA),等均购于上海阿拉丁生化科技有限公司,实验用水均为超纯水(18 MΩ·cm−1)。
AgNO3储备液(1 mg·mL−1),准确称取0.3117 g AgNO3于烧杯溶解并转移至棕色容量瓶,用超纯水定容至200 mL,低温避光保存;Luminol储备液(1.0 × 10−2 mol·L−1):准确称取177 mg Luminol于棕色容量瓶,用氢氧化钠溶液(0.1 mol·L−1)溶解,于100 mL棕色容量瓶中定容后摇匀低温避光一周后使用;KMnO4储备液(2.0 × 10−2 mol·L−1):配好后放置一周,使用前用草酸钠标准溶液标定。
2.3. Eu掺杂碳量子点(Eu-CDs)的制备
准确称取0.45 g EDTA和0.1418 g EuCl3·6H2O于锥形瓶中,加入0.5 mL TETA用25 mL水溶解,置于振荡器上摇匀30 min,转至PPL水热反应釜(60 mL),在200℃条件下反应4 h,自然冷却后,所得溶液经离心去除不溶物后收集,用于后续实验。
2.4. 实验方法
于测量杯(3 mL)中依次加入0.2 mL Luminol溶液(1.0 × 10−5 mol∙L−1)、0.2 mL Eu-CDs溶液、0.3 mL PB缓冲液(pH 9.5)和一定量Ag+标准溶液,采用静态注射化学发光方法,采样间隔0.1 s,采样时间30 s,在5s时用注射器将0.2 mL KMnO4标准液(5.0 × 10−6 mol∙L−1)注入测量杯中,记录化学发光强度信号I,同时做空白溶液(不加Ag+)的化学发光强度为I0,计算
。
3. 结果与讨论
3.1. Eu-CDs的表征
通过TEM、紫外吸收光谱、荧光光谱等手段对Eu-CDs进行了表征。图1(a)为Eu-CDs的透射电镜图,碳量子点的大小约为16 nm。如图1(b)可以看出,Eu-CDs在320 nm (蓝线)处有明显紫外吸收峰,当激发波长为320 nm时,Eu-CDs的荧光发射峰位于390 nm (红线)处。
 (a) TEM pattern of Eu-CDs; (b) UV-vis Absorption spectrum and fluorescence emission spectra (excited at 320 nm)
(a) TEM pattern of Eu-CDs; (b) UV-vis Absorption spectrum and fluorescence emission spectra (excited at 320 nm)
Figure 1. Characterization of Eu-CDs
图1. Eu-CDs的表征
3.2. 化学发光体系的动力学曲线
考察了化学发光体系的动力学曲线,由图2看出,Eu-CDs对Luminol-KMnO4化学发光体系具有明显的增敏作用(曲线2),而Ag+的加入进一步增敏了Eu-CDs-Luminol-KMnO4体系的化学发光(曲线3)。随着加入Ag+浓度的增加,Eu-CDs-Luminol-KMnO4体系的化学发光也逐渐增加。
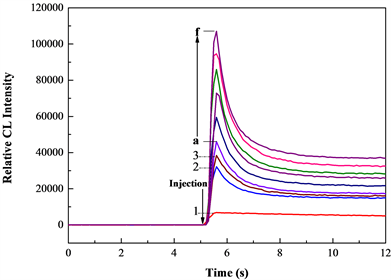 Luminol: 1.0 × 10−5 mol L−1; PB: 5.0 × 10−2 mol∙L−1; KMnO4: 5.0 × 10−6 mol∙L−1; Eu CDs: (0.2 mL); Ag+(a~f): 5~30 ng∙mL−1
Luminol: 1.0 × 10−5 mol L−1; PB: 5.0 × 10−2 mol∙L−1; KMnO4: 5.0 × 10−6 mol∙L−1; Eu CDs: (0.2 mL); Ag+(a~f): 5~30 ng∙mL−1
Figure 2. Chemiluminescence kinetic curves of the CL systems
图2. 化学发光动力学曲线
3.3. 化学发光体系的优化
3.3.1. pH的影响
在碱性介质中,Luminol-KMnO4化学发光体系能够产生化学发光信号。考察了不同Ph (7~10)条件,Ag+对Eu-CDs-Luminol-KMnO4化学发光体系的增敏作用。结果如图3(a)所示,随着pH值的增大,Ag+对化学发光体系的增敏作用(
)也逐渐增强;当pH超过9.0时,
的变化趋于平缓。由于在pH 9.5时,化学发光体系具有最高的强度值,因此选择9.5为体系最佳pH值。
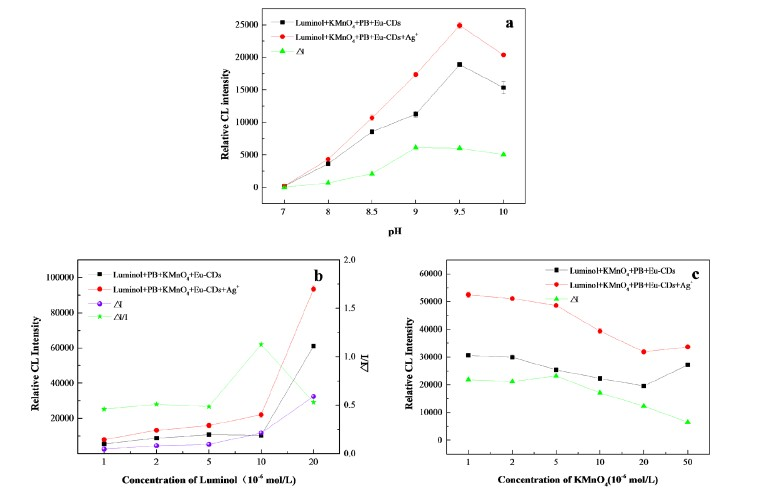 (a) Effect of pH on CL intensity; (b) Effect of Luminol concentration on CL intensity; (c) Effect of KMnO4concentrationon CL intensity,(Luminol: 1.0 × 10−5 mol∙L-1; PB: 5.0 × 10−2 mol∙L−1;KMnO4: 5.0 × 10−6 mol∙L−1; Eu-CDs, (0.2 mL); Ag+: 10 ng∙mL−1)
(a) Effect of pH on CL intensity; (b) Effect of Luminol concentration on CL intensity; (c) Effect of KMnO4concentrationon CL intensity,(Luminol: 1.0 × 10−5 mol∙L-1; PB: 5.0 × 10−2 mol∙L−1;KMnO4: 5.0 × 10−6 mol∙L−1; Eu-CDs, (0.2 mL); Ag+: 10 ng∙mL−1)
Figure 3. Effect of pH、Luminol and KMnO4concentrationon CL intensity
图3. pH、Luminol浓度、KMnO4浓度对化学发光的影响
3.3.2. Luminol浓度的影响
考察了Luminol浓度对化学发光体系
和
值的影响。实验结果如图3(b)所示,随着Luminol浓度的升高,体系
随之增加,而体系
随之升高后下降;当Luminol浓度为1.0 × 10−5 mol·L−1时
达到最大值。故Luminol的最佳浓度为1.0 × 10−5 mol·L−1。
3.3.3. KMnO4浓度的影响
考察了KMnO4浓度对体系化学发光强度的影响。实验结果如图3(c)所示,随着KMnO4浓度的增加,化学发光强度趋于稳定,当KMnO4浓度大于5.0 × 10−6 mol·L−1时,体系
也随之下降,故KMnO4的最佳浓度为5.0 × 10−6 mol·L−1。
3.4. 干扰实验
在最佳条件下,考察样品中共存的组分或离子对Ag+的测定的影响。结果如图4所示,100倍的Al3+,Zn2+,La3+,Cu2+,Cr3+,S2-,Cd2+,Pb2+,Mg2+,Mn2+,葡萄糖,精氨酸,苯丙氨酸,乳糖,甲硫氨酸,甘露糖,组氨酸,蔗糖,硫脲,柠檬酸,尿素;50倍的Ni2+,Fe3+,果糖,乳果糖;10倍的Hg2+对测定没有干扰。
 Luminol:1.0 × 10−5 mol∙L−1; PB: pH 9.5; Eu-CDs: (0.2 mL); KMnO4: 5.0 × 10−6 mol∙L−1; Ag+: 10 ng∙mL−1; 图中Fe3+、Ni2+、乳果糖、果糖浓度均为5.0 × 10−6 mol∙L−1
Luminol:1.0 × 10−5 mol∙L−1; PB: pH 9.5; Eu-CDs: (0.2 mL); KMnO4: 5.0 × 10−6 mol∙L−1; Ag+: 10 ng∙mL−1; 图中Fe3+、Ni2+、乳果糖、果糖浓度均为5.0 × 10−6 mol∙L−1
Figure 4. Effect of Metal ions and organic compounds
图4. 金属离子和有机物的干扰
3.5. 分析性能
在最佳实验条件下,考察Ag+对Eu-CDs-Luminol-KMnO4体系化学发光信号的影响。结果如图5所示,在0.5~30 ng∙mL−1范围内,体系
与Ag+浓度呈良好的线性关系,标准曲线为
,相关系数r为0.9993。根据IUPAC规定,该方法的检出限为0.08 ng·mL−1,相对标准偏差(RSD)为2.1% (C = 15 ng·mL−1)。
3.6. 样品测定
样品1、2、3均为食品抗菌塑料收纳盒,去除表面图案后将瓶身剪碎,称重17.5 g放于锥形瓶中,加入100 mL双重蒸馏水(pH 6.0)浸泡24 h后,整个过程避光保存。按照实验方法测定浸取液中痕量Ag+,同时进行加标回收实验,样品的加标回收率在91%~117% (表1),测定结果令人满意。

Table 1. Results of the determination of Ag+ in samples (n = 3)
表1. 标样品加标回收实验(n = 3)
4. 结论
制备的Eu-CDs对Luminol-KMnO4体系增敏效果明显,基于Ag+对Luminol-KMnO4-Eu-CDs体系的增敏作用,建立了测定食品包装材料中Ag+的新方法。该方法操作简单,选择性好,分析时间短,成功应用于食品包装材料中银溶出量的测定。
NOTES
*通讯作者。