1. 引言
半导体光催化材料作为处理污水的重要催化剂,其具备区别于金属或绝缘物质特殊的能带结构,即在导带和价带之间存在一个禁带,其中以ZnO,TiO2和CdS半导体的催化活性最高 [1] [2]。半导体光催化过程实质是将吸收的光能直接转变为化学能,用于降解有机污染物的过程。光催化剂技术不仅具有无毒、廉价和可以重复利用等优点 [3],而且可以充分利用太阳能 [4]。因此,该技术已经成为理想的节约能源和保护环境的有效手段 [5]。然而,仅仅用这些单一的半导体材料作为光催化剂并不能实现高的降解效率,因为它们本身带隙能较大、光吸收范围较窄、电子空穴对复合机率大,进而导致较低的光催化效率。研究者们尝试了多种方法对光催化剂进行改性,以提高其光催化效率。
ZnO作为一种宽禁带直接带隙II-VI族半导体材料,室温下ZnO的禁带宽度为3.37 eV,激子束缚能高达60 meV,是一种适合于室温或更高温度下的紫外发光材料。同时ZnO又具有很高的导电、导热性能和化学稳定性,ZnO材料的制备、形貌的控制与应用研究成为当前研究热点之一。目前,掺杂是改变半导体物理性质的有效手段,而将稀土离子掺杂到ZnO材料中可以有效的改善ZnO材料的发光性能 [6] [7] [8]。稀土元素原子具有特殊的4f层电子结构,原子磁矩相对较大、自旋耦合较强,由于其4f组态未配对电子的自旋运动和轨道运动的相互作用,导致大量的磁性信息的产生,而电子在f-f组态内或在f-d之间的能级对跃迁,将产生大量的吸收和荧光信息。由于具备这些特有的磁信息和光信息,使得稀土元素具有区别于一般元素的磁、电、光等特性,这些性质成为合成具有特定功能的新型材料的重要保障。稀土Ce离子掺入到ZnO晶格中,有较好的结晶质量和吸光性能。
在本文中,我们利用简单水热法制备了形貌特殊的ZnO纳米花结构,通过各类表征和光催化降解实验对比其他ZnO结构显其优势,然后对其进行Ce掺杂,通过光催化实验结果和机理研究,可说明结构调控和稀土元素掺杂的功能修饰策略有效提高了ZnO的光催化活性。
2. 实验部分
2.1. 试剂和仪器
乙醇,六水合硝酸锌,氢氧化钠,氢氧化钾,聚乙二醇,六水合硝酸铈均为AR分析纯,购于国药集团化学试剂有限公司。
UV-1100型紫外可见分光光度计(上海美谱达仪器有限公司),DX-2600型X-射线粉末衍射仪(丹东方圆仪器有限公司),EX-250型X-射线能谱仪(日本HORIBA公司),日立S-4800扫描电子显微镜(日本日立公司)。
2.2. 催化剂制备及性能测试
ZnO纳米花的制备:分别称取2.97 g六水硝酸锌和4.48 g KOH于两个烧杯中,各加入20 mL去离子水搅拌溶解,然后注入到其中一个烧杯中混合,得到透明溶液。将烧杯加盖置于70℃的烘箱中保温10 h,取出后冷却至室温,抽滤水洗固体三次以上,在70℃下真空干燥24 h,即可得到ZnO纳米花材料。
Ce掺杂ZnO的制备:(Ce摩尔分数为1%、2%、3%、4%、5%)分别称取m (ZnO):m (六水硝酸铈)为(0.0972 g:0.0052 g)、(0.0972 g:0.0104 g)、(0.0972 g:0.0156 g)、(0.0972 g:0.0208 g)、(0.0972 g:0.026 g)于5个烧杯中,加入10 mL乙醇搅拌溶解;分别加入0.5 g NaOH的10 mL乙醇溶液,搅拌10 min后分别注入5个反应釜中,置于150℃的烘箱保温24 h。降温后取出,分别离心分离,用乙醇洗涤三次,去离子水洗三次,在70℃下进行过夜真空干燥。
光催化性能测试:配置0.005 mol/L的罗丹明B溶液500 mL,取50 mL罗丹明B溶液和0.05 g ZnO或Ce@ZnO纳米材料加入到烧杯中,加入磁子,暗吸附平衡15 min后,置于紫外灯下搅拌催化,每隔20 min取样,离心取清液,用紫外可见分光光度计测试罗丹明B吸光度和浓度的变化。
3. 实验结果与讨论
3.1. ZnO纳米花结构表征
水热溶剂热法制备半导体纳米材料一直受到人们的推崇。水热合成法制备纳米ZnO颗粒的反应实质是:将可溶性锌盐和碱液混合形成Zn(OH)2的“沉淀反应”与Zn(OH)2脱水生成ZnO的“脱水反应”在同一反应器内完成,从而得到颗粒细小结晶完好的ZnO晶粒。本文开发了一种新颖的制备ZnO纳米结构的方法,只需要将锌盐(硝酸锌)水溶液加入到碱溶液(KOH),常压下70℃恒温反应10 h即可。该方法简单温和,时间短,产率高,产品微观形貌特殊,记为ZnO-A。为了对比ZnO的优势特征,我们采用相同原料硝酸锌和碱溶液(NaOH)在乙醇和水的混合液中,加入聚乙二醇(PEG)做诱导剂,置于高压反应釜中180℃反应20 h,得到ZnO-B [9]。对两种ZnO纳米结构进行SEM和XRD表征。

Figure 1. SEM images of ZnO-A (a, b, c) and ZnO-B (d, e, f) at different magnifications
图1. 不同放大倍数的ZnO-A (a, b, c)和ZnO-B (d, e, f)的SEM图
图1是ZnO-A和ZnO-B的SEM图,由图1(a),图1(b)可以看到,ZnO-A呈现特殊的球体多枝状,均匀的“触手”朝着四面八方伸展开来,像一朵花,每一根触手长约4.3 μm,图1(c)给出了更加放大的ZnO枝状触手的照片,六方棱柱的截面出现一层一层堆积褶皱的细节(图中红箭头)。值得注意的是,ZnO-A结构中几乎见不到传统的纳米颗粒、纳米线之类的杂乱景象,“纳米花”的成型率极高。这种复杂的形态学特征必将产生优异的物理化学特性。相比之下,ZnO-B的形貌略显杂乱无章,如图1(d),图1(e)可见,无规则堆积的短纳米棒相互交织,长度约为30 μm,图1(f)展现的单根纳米棒表面光滑无褶皱,有圆柱和四方柱形。就SEM给出的二者形貌上的差异,我们推测ZnO-A的催化性能要比ZnO-B好。
虽然ZnO-A和ZnO-B两种纳米结构的微观形貌大相径庭,但是图2(a)的XRD图显示,二者的晶体结构均一,结晶度较好,与ZnO标准卡(图中绿色直线)均一一对应,无杂质峰。注意到在2θ = 56˚、68˚时,ZnO-A的峰明显比ZnO-B高,可能会造成二者催化性能上的不同。

Figure 2. (a) XRD patterns of ZnO-A and ZnO-B; (b) EDX pattern of ZnO-A
图2. (a) ZnO-A和ZnO-B的XRD图;(b) ZnO-A的EDX图
为了进一步确定ZnO-A和ZnO-B的光催化性能的优劣,我们对二者做了紫外光降解罗丹明B的实验。称取相同质量的ZnO样品分别加入到50 mL 1 × 10−5 mol/L罗丹明B溶液,暗吸附平衡后,置于紫外灯下搅拌催化,分时取样,离心取清液,用紫外可见分光光度计测试吸光度A的变化,计算降解率,并依据一级反应动力学方程计算速率常数K,结果如图3和表1所示。

Figure 3. Degradation curve (a) and photodegradation kinetic curve (b) of rhodamine B catalyzed by ZnO-A and ZnO-B
图3. ZnO-A和ZnO-B对罗丹明B的降解率曲线(a)和光降解动力学曲线(b)

Table 1. Kinetic rate constant K of ZnO-A and ZnO-B for the degradation of rhodamine B
表1. ZnO-A和ZnO-B催化降解罗丹明B动力学方程速率常数K
由上图表可知,以温和水热法制备的ZnO-A表现了更优的光催化活性,其反应速率是ZnO-B的2.6倍,对ZnO-A的EDX测试(图2(b))表明Zn、O原子比例正确,无杂原子。综合SEM、XRD和EDX分析可知,ZnO-A呈现出特殊而规整的微观形态,结晶性好,晶体缺陷少,比表面积大,为待降解的染料分子顺利进入和附着提供便利。值得一提的是,ZnO-A结构中向四周伸出的“花瓣”,大大提高了光利用率,进一步促进了光降解效率。
综上所述,温和水热法构建的ZnO-A以其独特的形态学特征,高结晶度,展现出较为可观的光催化活性,30 min降解率可达90%以上,化学动力学计算速率常数为0.0694,为之后的Ce掺杂提供了有力保障。
3.2. Ce掺杂ZnO纳米复合物的表征
虽然ZnO-A的光催化性能已相当可观,但是ZnO这种半导体的弊端也很明显:高禁带宽度3.37 eV限制其只能吸收太阳光中极少的紫外光,太阳光利用率较低;而且,ZnO在光照下产生的电子-空穴对容易发生复合,从而限制其催化活性。鉴于此,在ZnO体系中掺入稀土元素Ce,发挥特殊电子层结构的优势,捕获光生电子,降低电子–空穴复合几率,扩大吸收光波长范围,提高材料催化活性。以上述ZnO-A为原料,以Ce(NO3)3·6H2O为Ce源,在NaOH的乙醇溶液中,高压水热反应制得Ce掺杂ZnO复合材料,记为Ce-ZnO,并对产品进行了相应的SEM和XRD表征。
图4是不同Ce含量的Ce-ZnO材料的SEM图,图4(a)是ZnO-A在Ce含量为0%的情况下经反应体系后得到了产物形貌,注意到原本纳米花的特殊形貌已不复存在,但是球体表面短棒和颗粒大量富集,推断这是由于高温高压反应条件破坏了ZnO-A的结构。图4(b),图4(c),图4(d)分别是掺Ce摩尔比为1%,2%和4%的ZnO结构的SEM图,记为1% Ce-ZnO,2% Ce-ZnO和4% Ce-ZnO。从图可以看出,制备的Ce掺杂ZnO样品形貌都比较规整,基本呈短棒或颗粒,粒径比较均一,表面光滑。仔细观察可以发现,随着Ce掺杂量的增大,ZnO粒径在不断减小,且堆积更加紧密,这可能是因为Ce的掺入影响了ZnO的结晶过程,抑制了晶体的生长。

Figure 4. SEM images of Ce-ZnO materials with different Ce molar content: (a) 0% Ce-ZnO, (b) 1% Ce-ZnO, (c) 2% Ce-ZnO, (d) 4% Ce-ZnO
图4. 不同Ce摩尔含量的Ce-ZnO材料的SEM图:(a) 0% Ce-ZnO,(b) 1% Ce-ZnO,(c) 2% Ce-ZnO,(d) 4% Ce-ZnO
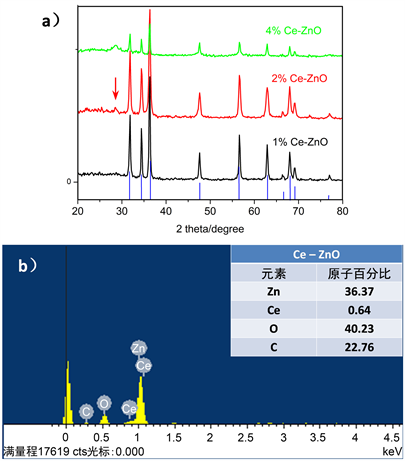
Figure 5. (a) XRD patterns of Ce-ZnO with different Ce contents; (b) EDX pattern of 2% Ce-ZnO
图5. (a) 不同Ce含量的Ce-ZnO材料的XRD图;(b) 2% Ce-ZnO材样品的EDX图
为了找到不同Ce含量的Ce-ZnO材料的之间的差异,我们对相应材料做了XRD测试,如图5(a)所示,各组Ce-ZnO复合材料的XRD图谱均保持了之前ZnO的衍射峰,与蓝线的标准卡符合较好,这些峰的峰型尖锐,且半峰宽较窄,表明该样品具有很高的结晶度,同时没有出现其它衍射峰,表明制备的样品纯度较高。在1% Ce掺杂后的ZnO的衍射曲线上没有检测出CeO2的特征峰和其它杂峰,可能的原因是Ce处于高分散状态或者Ce4+离子的掺入量过少,XRD难以检测出。但是在2% Ce-ZnO,尤其4% Ce-ZnO样品的XRD图中,在28.5˚出现CeO2(111)晶面的特征峰(图中红箭头所指),为面心立方结构。说明随着掺Ce量的增加,复合材料中CeO2成分逐渐显现,也正是因为Ce成分不断增多,导致了原ZnO微观结构的变化,这一点在SEM图中可见。为了确认合成的Ce-ZnO产物中掺Ce量的准确度,我们对2% Ce-ZnO样品进行了EDX测试(图5(b)),测得Ce与Zn的原子百分比为0.64:36.37 = 1.76%,接近2%,表明掺入Ce的量是符合实验设计的。
众所周知,光催化剂的比表面积对光催化活性具有直接而显著的影响,一般来说,比表面积越大,光催化活性越高。我们利用氮气吸附–脱附测试技术分别对ZnO-A和2% Ce-ZnO复合物进行BET比表面积测试(图6),比较Ce掺杂前后的比表面积变化。BET测试结果表明ZnO的比表面积为34.635 m2/g,孔径大小为25.7 nm,Ce-ZnO复合物比表面积为81.907 m2/g,孔径大小为12.08 nm。结果表明,Ce-ZnO复合物的比表面积约为ZnO的2.4倍,比表面积越大意味着催化反应位点越多,此外Ce掺杂后复合材料的孔径从25.7 nm减小到12.08 nm,这种典型的介孔特征有利于光的吸收和光催化反应物的浓缩传递 [10] [11],对光催化活性具有显著的增强作用。

Figure 6. (a) Nitrogen sorption-desorption isotherms of ZnO and Ce-ZnO; (b) Pore size distribution of ZnO and Ce-ZnO
图6. (a) ZnO与Ce-ZnO复合物N2吸附–脱附等温曲线;(b) ZnO与Ce-ZnO复合物的孔径分布图
3.3. Ce-ZnO催化性能研究
3.3.1. 不同Ce含量对光催化降解性能的影响
分别称取等量的不同Ce掺杂量的Ce-ZnO复合物,加入到相同浓度等量罗丹明B溶液,暗吸附平衡后,置于紫外灯下搅拌催化,分时取样,离心取清液,用紫外可见分光光度计测试罗丹明B浓度的变化,得到图7的光催化动力学曲线。
由图7和表2可知,掺杂Ce之后的ZnO催化能力确实得以提高,均比单纯的ZnO的催化性能好,而且Ce掺杂量在2%时具有最高的光催化活性,其速率常数K值是纯ZnO的1.6倍。最优值之前随着Ce掺杂量的增加,样品的光催化能力逐渐增强,当掺杂量超过2%后,随着Ce掺杂量的增加,样品的光催化能力反而下降。这是因为,一方面Ce作为稀土元素,具有复杂的能级结构,Ce离子掺入ZnO后,会在其禁带中引入新的杂质能级,减小禁带宽度,降低带隙能,扩大ZnO吸收光谱的响应范围,从而提高了光子的利用率,增强了ZnO的光催化活性。另一方面,Ce的电子层结构([Xe] 4f1 5d1 6s2)中,存在未配对的4f层电子,能够促进界面电荷转移,并且抑制光生电子–空穴对的复合。Ce离子作为一种路易斯酸,比O2分子更容易捕获电子,当ZnO受到光激发,产生光生电子时,间隙位置的Ce4+能够有效地将其捕获,使其与催化剂表面吸附的O2分子反应,生成超氧离子自由基(
),进而完成光催化降解罗丹明B的过程,具体过程如反应(1)~(5)所示。但是当Ce4+的掺入量太多时,又会成为电子–空穴对的复合中心,加速了电子–空穴的复合,反而抑制了ZnO的光催化性能。
(1)
(2)
(3)
(4)
(5)
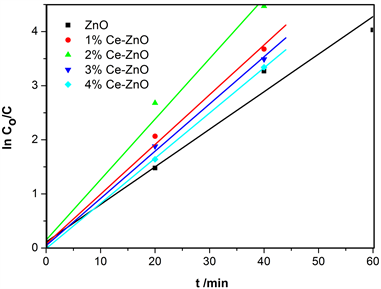
Figure 7. Kinetics of Rhodamine B photodegradation of Ce-ZnO with different Ce doping contents
图7. 不同Ce掺杂量的Ce-ZnO复合物的罗丹明B光降解动力学曲线

Table 2. Kinetic rate constant K of Rhodamine B degradation by Ce-ZnO with different Ce doping amounts
表2. 不同Ce掺杂量的Ce-ZnO复合物降解罗丹明B动力学速率常数K
3.3.2. 紫外光下催化剂降解罗丹明B行为
取0.075 g 2%的Ce-ZnO纳米复合物,加入50 mL 1 × 10–5 mol/L罗丹明B溶液,同样方法测试光催化降解性能。由图8可看出,反应时间为1 h,罗丹明B被Ce-ZnO复合物逐渐降解,吸光度值越来越低。
3.3.3. 日光下催化剂降解罗丹明B行为
将ZnO-A,2% Ce-ZnO各称取0.075 g于100 mL烧杯中,各加入50 mL 1 × 10–5 mol/L罗丹明B,在暗室内吸附平衡20 min,在正午日光直射下降解,搅拌,分时取样,离心取清液,用紫外可见分光光度计测试罗丹明B浓度的变化,得到图9。
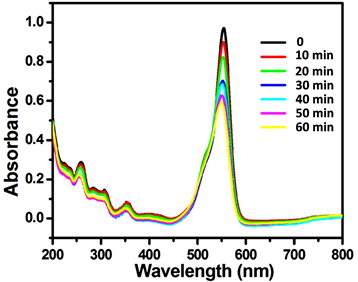
Figure 8. UV absorption curves of rhodamine B at different times
图8. 不同时刻罗丹明B的紫外全波段吸收图
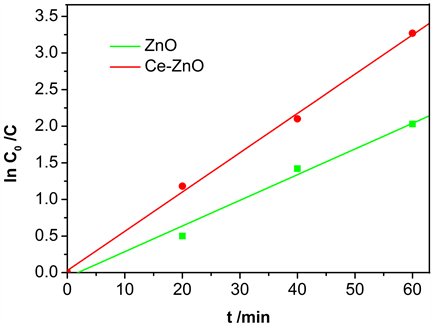
Figure 9. Photocatalytic kinetics curves of ZnO-A and 2% Ce-ZnO in sunlight
图9. 日光下ZnO-A,2% Ce-ZnO的光催化动力学曲线

Table 3. Kinetic rate constant k for degradation of rhodamine B by ZnO-A and 2% Ce-ZnO in sunlight
表3. 日光下ZnO-A,2% Ce-ZnO降解罗丹明B动力学速率常数k
由图9和表3看出,日光下2% Ce-ZnO比ZnO-A催化活性高,掺杂了2% Ce之后速率常数变为纯ZnO的1.5倍。光催化活性增强的核心原理都与拓宽的光响应反应、改进的光生载流子分离效率和增强的吸附能力有关。稀土Ce的电子层结构:[Xe] 4f1 5d1 6s2,特殊的4f电子层,掺杂后会产生较多的电子能级来捕获光生电子和空穴,从而抑制电子–空穴对复合,如图10,且Ce的离子半径为0.114 nm,远大于Zn2+的半径,所以在掺杂后较容易在ZnO表面替代Zn2+引起晶格畸变,从而提高催化剂的活性。而且,稀土Ce禁带较窄,可吸收较宽波长的光线,复合之后提高了太阳光利用率,故在太阳光照下掺Ce的ZnO催化活性高。
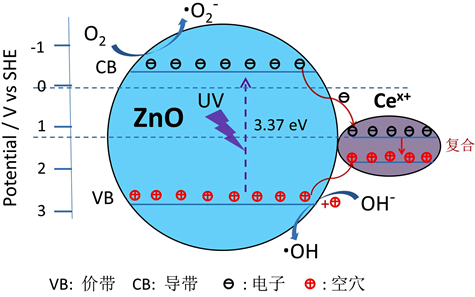
Figure 10. Schematic photocatalytic mechanism of Ce-doped ZnO
图10. Ce掺杂ZnO光催化降解机理图
4. 结论
采用温和水热法一步得到形貌特殊的ZnO纳米花结构,其光催化反应速率是普通ZnO纳米结构的2.6倍,在掺杂了2%的Ce之后光催化反应速率进一步提高了1.6倍,说明结构优化和稀土元素掺杂的功能修饰策略有效提高了ZnO的光催化活性,为实现更高效的半导体纳米光催化剂的构建提供了新思路。
基金项目
浙江省大学生科技创新活动计划暨新苗人才计划项目(851919029),浙江省自然科学基金青年项目(LQ19B030005)。
NOTES
*通讯作者。