1. 引言
蜂蜜是一种具有较高营养价值的天然产品,除直接使用以外,还常被用作食品添加剂。蜂蜜主要是由糖和水组成的 [1],它们占蜂蜜成分的90%。此外,有机酸、蛋白质、酚酸和类黄酮等也是蜂蜜的重要组成成分。这些成分共同决定了蜂蜜所具有的风味。蜂蜜的成分和质量会受到许多因素的影响,例如蜜蜂的类型、花朵的类型、开花期、采集月份、产地 [2] 、蜂蜜的形成过程和环境温度等。例如,以往的研究表明蜂蜜中的类黄酮含量很容易受到花卉种类和蜂蜜加工过程的影响 [3]。不同的蜂蜜所具有的口味差异很大,因此为了选择合适的蜂蜜添加剂,非常有必要使用一些方法来对蜂蜜进行有效地区分。
近年来,许多研究人员对不同种类蜂蜜的质量进行了大量的研究 [4] [5] [6],所用方法主要有液相色谱(HPLC)、固相微萃取的GC-MS分析、顶空进样的气相色谱法(GC)和红外光谱法(IF-IR)等 [7] [8]。这些方法虽然能够对蜂蜜进行可靠地分析,但是也存在精度低、操作复杂、实时性较差等缺陷。这些方法通常需要大量的样本,以致测试过程耗费过多时间。其中,HPLC法的灵敏度较低,测试结果很容易受到温度的影响;同位素质谱法 [9] 和IF-IR [10] 只能由专业测试人员在具有特殊设备的实验室环境中进行 [11];此外,GC-MS和IF-IR对于成分复杂的香料的区分效果并不理想。
电子鼻技术作为对生物鼻子的仿真,能够和挥发性气体分子相作用,对物质综合气味进行检测,获取其特征气味指纹,随后通过对特征气味指纹数据的进一步分析,可实现对物质的鉴别与区分。以法国的Alpha MOS电子鼻为例,可以对牛奶调味品的风味差异进行区分 [12];还可用于对芒果匀浆和整个水果进行分类,从而实现了芒果品种的鉴别以及水果不同大小与成熟度的区分 [13];在饮料行业中,带有18个传感器的Alpha MOS电子鼻将加工过的橙汁与来自健康树木的鲜榨橙汁分开,并可识别出来自黄龙病(HLB)感染树木的同类商业加工果汁,并且将电子鼻和PCA结合可以分离出所有这些类型的果汁 [14] [15];对于樱桃、苹果、黑莓和蔓越莓等水果的不同气味特征,法国的Alpha MOS电子鼻可以对这些水果相应的果酒进行分类 [16]。可以看出,电子鼻技术可以实现对食品等物质的品质控制及鉴别,但同时也存在集成度差、传感器选择无针对性等缺陷。
本文针对蜂蜜中主要的醇类、酮类、醛类等挥发性物质,制备了纳米WO3、In2O3、TiO2、SnO2材料,采用丝网印刷方法集成了体积紧凑的共面阵列传感器,通过对蜂蜜饱和挥发蒸气检测获得了蜂蜜特征气味指纹,最后利用SPSS软件对特征气味指纹数据进行主成分降维因子分析,实现了蜂蜜因蜂种、采花种类、采集日期、生产地任一生产要素所导致品质差异的有效鉴别与区分。
2. 实验部分
2.1. 材料制备
实验中使用的所有试剂均为分析纯,具体的制备步骤如下。
2.1.1. 棉花模板法制备WO3
在剧烈搅拌的条件下,将六氯化钨(12.0 g)溶解在100 ml乙醇中,得到深蓝色溶液。将用作模板的棉花(5.0 g)依次用无水乙醇和蒸馏水洗涤数次,然后在85℃的烤箱中干燥20小时。然后将其浸入制备的深蓝色溶液中,用聚乙烯薄膜密封,渗透24小时。将充分渗透的棉花在80℃的烘箱中干燥2天。然后,将无定形棉混合物于500℃条件下煅烧3小时,以除去原棉,得到所需的WO3。
2.1.2. In2O3纳米颗粒的合成
量取50 ml的二甲基甲酰胺(DMF)于烧杯中,在磁力搅拌的条件下将InN3O9·xH2O (0.5 g),尿素(0.3 g),十二烷基磺酸钠(1.5 g)溶解在DMF中。搅拌0.5 h后,形成澄清溶液,然后转移至反应釜中,在100℃的条件下加热24小时。取出后冷却至室温,离心得到白色沉淀。将沉淀物用无水乙醇和蒸馏水洗涤数次,在60℃的空气中干燥6小时。然后将其在500℃条件下煅烧2小时,获得In2O3纳米微球。
2.1.3. TiO2纳米颗粒的制备
将50 ml 1 M的葡萄糖溶液转移到反应釜中,密封并在180℃下保持10小时。通过离心获得深棕色沉淀物,并用无水乙醇和蒸馏水洗涤数次,然后在80℃下进行真空干燥,获得碳微球。将制得的碳微球(0.1 g)加入到20 ml乙醇中进行超声处理,持续30分钟,形成深棕色悬浮液。然后将1.5 ml的Ti(OBu)4加入到碳微球的悬浮液中,并将该混合物在密封的烧杯中剧烈搅拌12小时。离心得到沉淀,将沉淀物用无水乙醇和蒸馏水洗涤数次,将沉淀在450℃条件下煅烧2小时,获得中空的TiO2微球。
2.1.4. SnO2纳米颗粒的制备
采用共沉淀法制备纳米SnO2,在连续搅拌的条件下,将氢氧化铵加入到0.2 M的SnCl4·5H2O溶液中直至溶液的pH为9,离心获得沉淀,将沉淀物用无水乙醇和蒸馏水洗涤数次,并在500℃条件下煅烧。
2.1.5. 器件制备
用一定量的松油醇、丁基卡必醇、乙基纤维素、Span#85和邻苯二甲酸二正丁酯制备所需的有机溶液,分别将1 g的WO3、In2O3、TiO2和SnO2与该有机溶液混合,然后在玛瑙研钵中研磨2小时。经过充分研磨后获得相应的浆料,然后在印有加热电阻和Au测试电极的共面传感器基板(96系氧化铝陶瓷)表面进行丝网印刷(300目钢网网板),敏感材料尺寸为2 × 2 mm,厚度5 μm,传感器尺寸为10 × 10 mm,得到所需的阵列传感器器件。
2.2. 材料表征
对于合成的纳米WO3、In2O3、TiO2和SnO2材料,在2θ为5˚到90˚的范围进行X射线衍射(XRD-7000s)表征。所用的是Cu Kα1辐射(λ = 1.5406 A˚)。通过场发射扫描电子显微镜(FEI Sirion 200)对合成的WO3、In2O3、TiO2和SnO2材料的微观形貌进行表征,加速电压为10 kV。
2.3. 蜂蜜样品信息
表1为蜂蜜样品信息表,本实验测试所用的6个蜂蜜样品的蜂种、产地、采花期均有所不同,其中1~4号样品均为野坝子蜂蜜,1号为意蜂于2017年11月在云南楚雄大姚采出的,2号为意蜂于2016年12月在云南楚雄大姚采出的,3号为中蜂于2017年1月在云南楚雄大姚采出的,4号为中蜂于2017年1月在云南楚雄姚安采出的;5号为荔枝蜂蜜,中蜂于2017年4月在广东潮州采出的;6号为桂花蜂蜜,中蜂于2016年10月在广东揭阳采出的。

Table 1. Information sheet for honey samples
表1. 蜂蜜样品信息表
2.4. 气敏测试
使用实验室自主开发的气敏测试设备搭载所制作的阵列传感器,对不同的蜂蜜样品进行测试。蜂蜜测试所用的方法为饱和顶空法,图1为测试气路示意图。

Figure 1. Schematic diagram of test method for saturated headspace method
图1. 饱和顶空法的测试气路示意图
在图1中,下方洗气瓶中的蓝色液体代表蜂蜜样品。所有样品的用量相同,均为2 g。在测试开始前,空气由左侧进入,经过绿色电磁阀之后按照红色箭头气路进入黄色测试腔,待测试腔中的传感器信号稳定后,绿色电磁阀切换气路,空气切换至绿色箭头气路,将洗气瓶中蜂蜜样品的饱和蒸气带出,进入到测试腔中进行检测,对测试数据进行保存。
2.5. 指纹图绘制
根据In2O3、WO3、SnO2和TiO2这四种气敏单元所在电路的电压和电流计算各自的电阻。将气体传感器在洁净空气中的稳定基础电阻设为Ro,通入蜂蜜挥发成分后的最低电阻值为Rg,各气敏单元对蜂蜜样品的响应值S的计算公式为S = (Ro/Rg – 1),把计算获得的四个响应值按照气敏单元材料依次为氧化锡、氧化钛、氧化锌、氧化钨的顺序分别列为轴1、2、3、4来绘制指纹图,各个轴的数值分别为四种气敏材料对蜂蜜挥发成分的响应值S。每进行一次测试,图中会连接形成一个四边形,每个图中各四边形的变化趋势基本一致。
2.6. PCA主成分分析法
通过基于SPSS软件的PCA主成分分析法,对气味指纹数据进行进一步的分析。所用的软件版本为IBM SPSS Statistics 25.0。对标准化后的数据进行降维分析,抽取主成分因子,将特征值设定为1,并对因子进行旋转。
3. 结果与讨论
3.1. 材料表征结果
对于合成的纳米In2O3、WO3、SnO2和TiO2材料,其XRD图谱如图2所示,根据In2O3的PDF标准卡(JCPDS卡:22-0336)、WO3的PDF标准卡(JCPDS卡:43-1035)、SnO2的PDF标准卡(JCPDS卡:41-1445)、TiO2的PDF标准卡(JCPDS卡:21-1272),这些材料的特征峰分别与对应的XRD卡片相符。

Figure 2. XRD patterns of the prepared In2O3, WO3, SnO2 and TiO2 materials
图2. 制备获得的In2O3、WO3、SnO2和TiO2材料的XRD图谱
对于合成的纳米SnO2、In2O3、TiO2和WO3材料,其微观形貌如图3所示,其中(a) 纳米SnO2的微观形貌为均匀的颗粒,尺寸约为60 nm;(b) 纳米In2O3的微观形貌为均匀的颗粒,尺寸约为50 nm;(c) 纳米TiO2的微观形貌为均匀的颗粒,尺寸约为45 nm;(d) 纳米WO3的微观形貌为片状,尺寸约为500 nm,厚度约为50 nm。

Figure 3. SEM morphology of the prepared nano-SnO2,In2O3, TiO2 and WO3 materials
图3. 制备获得的纳米SnO2、In2O3、TiO2和WO3材料的SEM形貌图
3.2. 气敏测试结果与分析
3.2.1. 蜂蜜样品指纹图
根据测试数据(详见附录),作出各个蜂蜜样品的指纹图(如图4所示,其中a为1号蜂蜜样品,b为2号蜂蜜样品,c为3号蜂蜜样品,d为4号蜂蜜样品,e为5号蜂蜜样品,f为6号蜂蜜样品)。从图中可以看出,不同蜂蜜样品的指纹图形状各不相同,除3号和4号样品的指纹形状略为相似外,其他各样品之间均存在明显的差异。
3.2.2. 聚类分析结果
用基于SPSS软件对数据进行主成分降维因子分析的结果如图5所示。
从图中的区分情况可以获得如下结果:
(1) 1~4号野坝子蜂蜜样品均散落在图中的右下半区,5号和6号样品则散落在图中的左上半区,差异非常明显,这说明本实验能够有效地区分不同采花品种的蜂蜜样品。
(2) 1~3号野坝子蜂蜜样品相互之间也存在这明显的区分,其中1号和2号样品的差别仅为采花期不同,2号和3号样品的蜂种分别为意蜂和中蜂,这说明本实验能够对同种蜂蜜因采花期、蜂种所导致的品质差异进行区分。
(3) 3号与4号样品的散落区域有所重合,这两种样品的采花品种、蜂种以及采集时间均相同,唯一的差别仅在于产地不同,由于云南楚雄大姚与楚雄姚安相邻,地域跨度太小,所以这两种样品的差异难以测出。
(4) 5号与6号样品虽然均散落在图中的左上半区,但二者存在明显的差异。
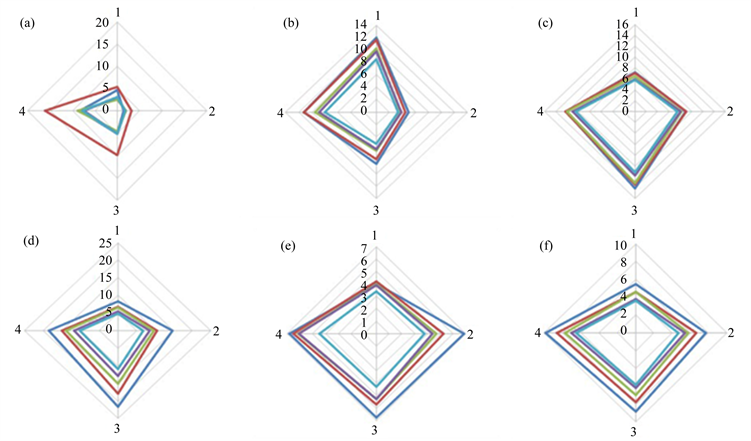
Figure 4. Fingerprint of honey samples
图4. 蜂蜜样品的指纹图

Figure 5. Overall discrimination results for honey samples
图5. 蜂蜜样品总体区分结果
3.2.3. 气敏机制
当通入干燥的空气,氧分子将被吸附在传感器表面,产生化学吸附氧,从而使得载流子浓度降低,导致传感器的宏观电阻升高并最终达到稳定电阻Ro;当通入蜂蜜挥发性成分之后,其包含的还原性基团会被传感器表面吸附的电离氧(例如O2−和O−)所氧化,这个过程释放了捕获的电子,使得载流子浓度增加,导致传感器的宏观电阻减小并最终降至最低值Rg。通过公式S = Ro/Rg – 1来计算各气敏单元对蜂蜜样品的响应值S。
但是单一传感器具有广谱响应性,对于不同气体均会产生响应,仅从响应值的大小无法对各个样品进行区分。鉴于不同材料的气敏特性有所不同,具体而言,是对蜂蜜挥发物中不同组分的选择性倾向不同,因此选择四种材料集成为阵列传感器对蜂蜜挥发物进行气敏检测,可获得蜂蜜的特征指纹图。而直观地利用指纹图形状难以实现相似度较高的蜂蜜样品的区分,借助PCA主成分降维分析法能够实现对蜂蜜特征气味指纹图谱的聚类分析,从而达到蜂蜜品质控制的目的。
3.3. 结论
经过测试和分析后,对于所有蜂蜜样品的品质控制,可以采用基于纳米氧化物半导体材料的高集成度阵列传感器对蜂蜜的挥发性物质进行检测,利用主成分降维分析处理所获得蜂蜜特征气味指纹,实现对蜂蜜因蜂种、采花种类、生产日期、生产地任一生产要素所导致品质差异的有效鉴别与区分。
致谢
本文的研究得到了CNTC项目的支持(编号为2016TX04)。在此还要感谢华中科技大学分析测试中心提供XRD表征与SEM形貌表征,感谢材料成型与模具技术国家重点实验室的支持。
附录
使用阵列传感器对6个蜂蜜样品进行测试,各样品的响应值数据分别如下表所示:

Table A1. Response data for honey sample # 1 (100%)
表A1. 1号蜂蜜样品的响应值数据(100%)

Table A2. Response data for honey sample # 2 (100%)
表A2. 2号蜂蜜样品的响应值数据(100%)

Table A3. Response data for honey sample # 3 (100%)
表A3. 3号蜂蜜样品的响应值数据(100%)

Table A4. Response data for honey sample # 4 (100%)
表A4. 4号蜂蜜样品的响应值数据(100%)

Table A5. Response data for honey sample # 5 (100%)
表A5. 5号蜂蜜样品的响应值数据(100%)

Table A6. Response data for honey sample # 6 (100%)
表A6. 6号蜂蜜样品的响应值数据(100%)
NOTES
*通讯作者。