1. 引言
在20世纪70年代,提出了钙离子作为胞内重要信使分子。多年来,大量的研究发现细胞的很多功能都与Ca2+有着密不可分的关系 [1]。而第一个发现参与Ca2+转运的细胞器是线粒体 [2] [3]。线粒体的Ca2+摄取主要是通过内膜上的线粒体钙单向转运蛋白(Mitochondrial Calcium Uniporter, MCU)完成的。2011年,MCU首次在《Nature》被发布并提出,它是一个高度选择性的钙离子通道蛋白 [4] [5] [6],它能够顺着电化学梯度来转运Ca2+,而不需要消耗或者偶联其他离子的转运,但需要MICU1 (Mitochondrial Calcium Uptake 1)的相互作用 [7]。多年来,针对MCU的研究多集中在动物,植物中虽也发现了同源蛋白,但相关研究甚少。
Stael等 [8] 发现拟南芥中有6个MCU同源蛋白,但这些蛋白在线粒体中的功能目前尚不清楚。直至2019年,Enrico等 [9] 发现AtMCU6 (cMCU)能把特定的应激信号转化为调节叶绿体基质Ca2+信号来响应环境。针对除模式植物拟南芥外,科研工作者只对梨的MCU基因家族进行了系统全面地研究,共鉴定出7个PbrMCU基因,并将其分成了两个亚组;其中,PbrMCU3、PbrMCU4和PbrMCU7在梨的成熟过程中发挥重要作用 [10]。可见,MCU家族在不同物种的植物中并未做过系统的分析和鉴定,它的结构和功能还存在大量的挖掘信息。
高粱(Sorghum bicolor)是世界第五大禾谷作物,除作为粮食外,还可用作饲料、染料和工业淀粉等,具有很大的应用价值 [11]。然而,盐碱、低温和干旱等逆境严重影响高粱的生长和应用价值。目前,高粱全基因组测序已经完成,为从全基因组水平揭示高粱重要基因家族的功能奠定了重要基础。因此,本研究以MCU为研究对象,利用生物信息学手段挖掘并分析高粱MCU家族基本成员信息、系统进化及表达模式,为后续深入解析SbMCU基因在多种逆境环境应答中生物学功能和分子机制提供了重要参考和依据。
2. 材料与方法
2.1. SbMCUs家族成员全基因组鉴定
利用查询文献获得拟南芥(Arabidopsis thaliana) AtMCUs家族的蛋白序列,同源比对Phytozome数据库(https://phytozome.jgi.doe.gov/pz/portal.html)、GRAMENE数据库(http://www.gramene.org/)和NCBI数据库(https://www.ncbi.nlm.nih.gov/)获得高粱MCU基因相关的信息,同时通过HMMER3.0软件进行比对搜索,人工去除冗余蛋白序列。利用SMART(http://smart.embl-heidelberg.de/)和NCBI中的Conserved Domains程序(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测并分析上述候选蛋白序列的保守结构域,进一步确定高粱MCU蛋白家族成员。同时,高粱MCU蛋白的分子量和等电点基本信息应用ExPASy数据库(http://www.expasy.org/)进行分析。高粱MCU蛋白的亚细胞定位应用Softberry (http://linux1.softberry.com/berry.phtml)中的ProtComp程序进行预测。高粱MCU蛋白的跨膜结构域应用TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)进行预测。
2.2. MCUs蛋白进化分析及SbMCUs蛋白间系统进化分析
利用MEGA 5.1软件内置的Clustal W程序对拟南芥、水稻和高粱MCUs蛋白进行多重序列比对,生成.meg格式文件,然后采用邻接法(Neighbor-Joining, NJ)进行聚类分析并构建系统进化树,其中,Bootstrap Method值设为1000,其余参数为默认,以分析不同物种蛋白系统间的亲缘关系及进化关系。同理,单独对获得SbMCUs蛋白序列进行多重序列比对,采用NJ法构建进化树。
2.3. SbMCUs基因的定位和重复
SbMCUs基因复制关系应用植物基因组复制数据库PGDD(http://chibba.agtec.uga.edu/duplication/)获得,进一步分析家族成员间的Ka (非同义替换率)和Ks (同义替换率)之间的关系。结合SbMCUs基因在染色体上的位置,采用Perl语言的软件包Circis进行可视化分析。
2.4. SbMCUs基因结构及蛋白保守结构域分析
利用从Phytozome上已下载的SbMCUs基因家族DNA和CDS序列,应用GSDS软件(http://gsds.cbi.pku.edu.cn/)绘制外显子–内含子结构图。SbMCUs家族功能结构域信息从Phytozome上直接获取,蛋白序列的保守基序分析采用MEME在线软件(http://meme-suite.org/)预测,参数设置如下:Maximum number of motifs为15;Occurrences of a single motif为zero or one per sequence。
2.5. SbMCUs基因表达量分析
利用Phytozome数据库对注释的SbMCUs基因家族Expression进行分析,使用Multiexperiment Viewer (MeV4)软件(http://www.tm4.org/mev.html)进行聚类并绘制热图。
2.6. 干旱和高温逆境下SbMCUs基因表达分析
PEG、ABA胁迫和干旱胁迫转录组数据均从NCBI的GEO数据库获取。GEO登录号分别为GSE30249 [12] 和GSE80699 [13]。分别从中提取SbMCUs基因家族成员在不同组织及不同逆境胁迫处理下的表达数据,以Control为对照,Log2 (变化倍数)为差异表达基因。利用TBTools进行热图绘制。
2.7. SbMCUs基因启动子区域顺式作用元件分析
利用New PLACE (https://www.dna.affrc.go.jp/PLACE/?action=newplace)检测SbMCUs基因上游1000 bp启动子序列,获得SbMCUs基因启动子中与逆境应答相关的顺式作用元件。
3. 结果与分析
3.1. SbMCUs家族成员全基因组鉴定
利用AtMCUs家族成员蛋白序列进行blastp比对,从Phytozone搜索SbMCUs蛋白序列,利用PFAM、SMART和NCBI分析蛋白保守结构域,去掉不完整结构域的序列,获得4个SbMCUs家族成员(表1,SbOSCA1-SbOSCA5.2)。前人研究表明,拟南芥OSCA家族基因为6个 [8],梨有7个 [10]。可见,SbMCUs基因家族成员数目较少。
如表1所示,SbMCU5.1和SbMCU5.2均定位在1号染色体上,虽然基因组序列差异较大,但氨基酸序列差异不大;SbMCU1和SbMCU2分别定位在3号和8号染色体上,两者的基因组序列差异较大,致使等电点和分子量差异也较大。TMHMM预测发现SbMCUs家族含有2个跨膜结构域(除SbMCU5.1外)。Softberry分析发现SbMCUs家族蛋白均定位在很多细胞器上,但根据前人已有的研究结果显示,MCU蛋白定位于叶绿体或线粒体中 [9] [14],说明SbMCUs家族的亚细胞定位需要后续实验加以验证。

Table 1. Detailed information of the MCU family genes in Sorghum bicolor
表1. SbMCUs基因家族成员信息
Note: Chlo: Chloroplast; Mito: Mitochondria; Nucl: Nucleus; Cyto: Cytoplasm; Pero: Peroxisome; ER: Endoplasmic reticulum; Extr: Extracellular; Golgi: Golgi
注:Chlo:叶绿体;Mito:线粒体;Cyto:细胞质;Pero:过氧化物酶体;ER:内质网;Extr:细胞外;Golgi:高尔基体
3.2. SbMCUs基因家族进化关系分析
为了揭示SbMCUs基因家族的进化关系,以拟南芥和水稻MCU家族基因作为参考,构建了系统进化树。对进化树进行拓扑结构分析发现(图1),15个MCU基因被分为2个亚组(Subgroup I和Subgroup II)。每个亚组中都包含了双子叶在植物拟南芥和单子叶植物水稻、高粱中至少两个MCU家族成员,说明MCU家族的分化时间早于单、双子叶植物的分化时间。

Figure 1. Phylogenetic relationship of the MCUs gene family from sorghum, Arabidopsis and rice
图1. 高粱、拟南芥和水稻MCUs基因家族进化关系分析
3.3. SbMCUs基因家族染色体定位及基因复制分析
根据高粱基因组信息,对4个MCU基因进行了染色体定位分析(图2)。结果发现MCU分布在3条染色体上,其中1号染色体上有2个。
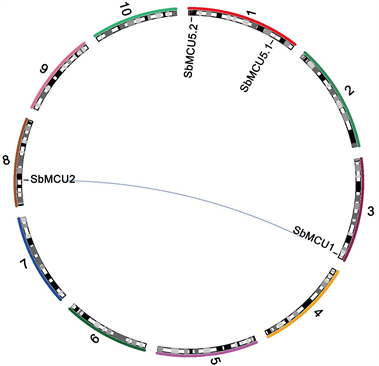 Note: The red line within chromosomes represents the location of SbMCUs, the blue line indicates duplication. 10 Arabic numerals correspond to 10 chromosomes of sorghum, respectively注:染色体内的红线段表示SbMCUs所在的位置,蓝色连线表示发生复制的基因,10个阿拉伯数字分别对应高粱的10条染色体
Note: The red line within chromosomes represents the location of SbMCUs, the blue line indicates duplication. 10 Arabic numerals correspond to 10 chromosomes of sorghum, respectively注:染色体内的红线段表示SbMCUs所在的位置,蓝色连线表示发生复制的基因,10个阿拉伯数字分别对应高粱的10条染色体
Figure 2. Chromosomal localization of SbMCUs genes
图2. 高粱MCU家族基因染色体定位
利用植物基因组复制数据库PGDD分析基因复制情况(表2)。结果发现,SbMCUs基因家族只有一对复制基因(SbMCU1和SbMCU2);结合它们在染色体上的分布情况,判断它们以片段复制的方式实现进化,SbMCU1和SbMCU2的Ka/Ks为0.37,小于0.5,说明基因发生片段复制后,高粱基因经历了强烈的纯化选择,说明SbMCUs家族基因在结构上比较保守。

Table 2. Informations of gene duplication
表2. 复制基因信息
3.4. SbMCUs家族基因结构分析
为了进一步鉴定不同组间的SbMCUs基因保守性和进化关系,本文对SbMCUs家族成员之间外显子和内含子分布的差异进行了比较(图3)。结果发现,SbMCUs家族均含有1个内含子和两个外显子;Subgroup I中,SbMCU2没有5’-UTR,Subgroup II中,SbMCU5.2没有3’-UTR。
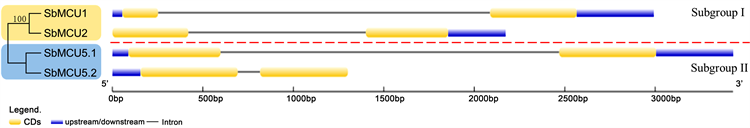 Note: Yellow and blue boxes represented exons and lines represented introns注:蓝色框代表非编码区,黄色框代表外显子,横线代表内含子
Note: Yellow and blue boxes represented exons and lines represented introns注:蓝色框代表非编码区,黄色框代表外显子,横线代表内含子
Figure 3. Gene architecture and phylogenetic analyses of SbMCUs genes
图3. SbMCUs家族基因的进化树及结构分析

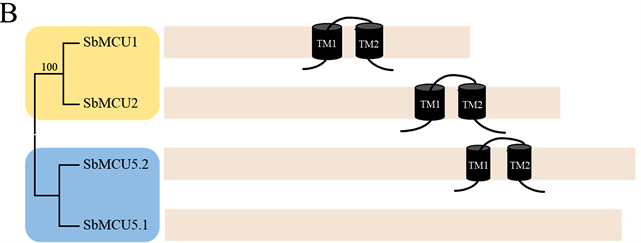
Figure 4. Transmembrane domain prediction and multiple sequence alignment of conserved region in SbMCUs. (A) Multiple sequence alignment of the MCU conserved region in SbMCUs. The transmembrane regions are marked by black lines; (B) Transmembrane domain prediction of the SbMCUsproteins
图4. SbMCUs家族功能结构域蛋白序列保守性和跨膜结构域分析。(A) SbMCUs家族MCU功能结构域蛋白序列比对。黑色框标注的为跨膜结构域;(B) SbMCUs蛋白跨膜结构域预测
3.5. SbMCUs家族蛋白序列保守性分析
通过氨基酸多重序列比对发现,SbMCUs家族蛋白具有高度的序列保守性,特别是Mitochondrial Calcium Uniporter (MCU,PF04678)结构域(图4(A))。TMHMM在线软件预测SbMCUs蛋白的跨膜结构域,发现SbMCUs家族蛋白有2个跨膜结构域,除SbMCU5.1外,而且跨膜结构域均在Mitochondrial Calcium Uniporter结构域中(图4(B))。
3.6. SbMCUs家族成员蛋白保守结构域分析
为进一步明确SbMCUs家族成员的蛋白结构,分析了其功能结构域。如图5(A)所示,SbMCUs家族成员具有高度保守的1个功能结构域,即Mitochondrial Calcium Uniporter (MCU,PF04678)。
为了进一步分析SbMCUs家族的保守性,利用MEME软件,鉴定了保守基序。如图5(B)所示,每个亚组的蛋白序列都高度保守,而不同亚组之间有一些差异,如SbMCU5.1和SbMCU5.2 (Subgroup II)比SbMCU1和SbMCU2 (Subgroup I)多了两个基序,为Motif 8和Motif 9。

Figure 5. Characterization of conserved domains within SbMCUs proteins. (A) Conserved domains within SbMCUs proteins; (B) Conserved motif within SbMCUs proteins
图5. SbMCUs家族蛋白保守结构域分析。(A) SbMCUs家族蛋白保守功能结构域分析;(B) MEME分析SbMCUs家族保守Motif
3.7. SbMCUs家族组织表达模式分析
为了进一步了解SbMCUs基因家族,利用Phytozome基因表达数据,分析了SbMCUs基因在不同组织的表达(图6)。结果表明,SbMCU5.2在不同组织器官和生长发育阶段的表达量较SbMCUs基因家族的其他成员均高,在开花期下方处于生长状态的叶片和花蕾形成期处于生长状态的叶鞘表达量最高;SbMCU2和SbMCU5.1在不同组织器官和生长发育阶段的表达量在SbMCUs基因家族中最低;SbMCUs基因家族在花期的基因表达量较其他时期高。
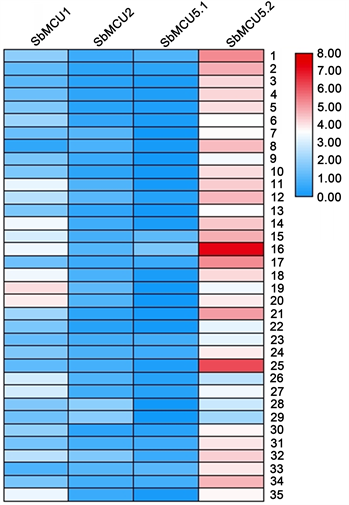
Note: 1: Surface root in immature stage; 2: Bottom root in immature stage; 3: Surface root in vegetative growth stage; 4: Bottom root in vegetative growth stage; 5: Upper rolled leaves in vegetative growth stage; 6: Upper leaves in immature stage; 7: Growing leaf sheath in immature stage; 8: Below rolled leaves in vegetative growth stage; 9: Below leaves in immature stage; 10: Central rolled leaves in vegetative growth stage; 11: 2 mm stem in immature stage; 12: 1 cm stem in vegetative growth stage; 13: Bottom root in flowering stage; 14: Leaf flag 1internode in flowering stage; 15: Upper growing leaves in flowering stage; 16: Below growing leaves in flowering stage; 17: growing leaf sheath in flouring stage; 18: Stem mid internode in flowering stage; 19: Upper panicle in flowering stage; 20: Below panicle in flowering stage; 21: Middle root in floral initiation stage; 22: Bottom root in floral initiation stage; 23: Below growing leaves in floral initiation stage; 24: Upper growing leaves in floral initiation stage; 25: Growing leaf sheath in floral initiation stage; 26: Upper growing internode in floral initiation stage; 27: Growing leaf sheath in floral initiation stage; 28: Panicle in floral initiation stage; 29: Peduncle in floral initiation stage; 30: Bottom root in grain maturity stage; 31: Leaf flag 1 internode ingrain maturity stage; 32: Below growing leaves in grain maturity stage; 33: Growing leaf sheath in grain maturity; 34: Stem mid internode in grain maturity stage; 35: Mature internode in floral initiation
注:1:幼嫩期表层根系;2:幼年嫩期底层根系;3:营养生长期表层根系;4:营养生长期底层根系;5:营养生长期上方卷叶;6:幼嫩期上方叶片;7:幼嫩期处于生长状态的叶鞘;8:营养生长期下方卷叶;9:幼嫩期下方叶片;10:营养生长期中部卷叶;11:幼嫩期 2 mm 的茎;12:营养生长期 1 cm 的茎;13:开花期底层根系;14:开花期旗叶 1 节间;15:开花期上方处于生长状态的叶片;16:开花期下方处于生长状态的叶片;17:开花期处于生长状态的叶鞘;18:开花期茎中部节间;19:开花期上方圆锥花序;20:开花期下方圆锥花序;21:花蕾形成期中层根系;22:花蕾形成期底层根系;23:花蕾形成期下方处于生长状态的叶片;24:花蕾形成期上方处于生长状态的叶片;25:花蕾形成期处于生长状态的叶鞘;26:花蕾形成期上方处于生长状态的节间;27:花蕾形成期处于生长状态的节间;28:花蕾形成期圆锥花序;29:花蕾形成期花梗;30:谷物成熟期底层根系。31:谷物成熟期旗叶 1 节间;32:谷物成熟期下方处于生长状态的叶片;33:谷物成熟期处于生长状态的叶鞘;34:谷物成熟期茎中部节间;35:花蕾形成期成熟节间
Figure 6. Heat map of tissue specific expression in SbMCUs
图6. SbMCU家族组织表达分析
3.8. 逆境胁迫应答下SbMCUs基因的表达量分析
为了筛选响应逆境胁迫的SbMCUs基因,利用下载的转录组测序数据分析了SbMCUs家族在ABA、PEG和干旱胁迫下的表达(图7)。如图7(A)所示,Subgroup II中SbMCU5.1对ABA和PEG (渗透胁迫)在根和幼苗均有明显响应,在根中均显著下调(Log2变化倍数>2),而在ABA处理后,SbMCU5.1在幼苗中显著上调(Log2变化倍数>3);Subgroup I中2个基因在ABA和PEG处理下响应均不明显(−0.6 < Log2变化倍数<0.4)。如图7(B)所示,两种不同基因型(Sensitive genotype, SG和Tolerant genotype, TG)高粱在42 d时叶片的表达谱中发现,SbMCU5.1对干旱均有明显响应,其中SG的表达量上调最高(Log2变化倍数=5.41);Subgroup I中2个基因在不同基因型高粱经干旱处理后响应模式不同,其中SG均呈下调表达,而TG均呈上调表达。
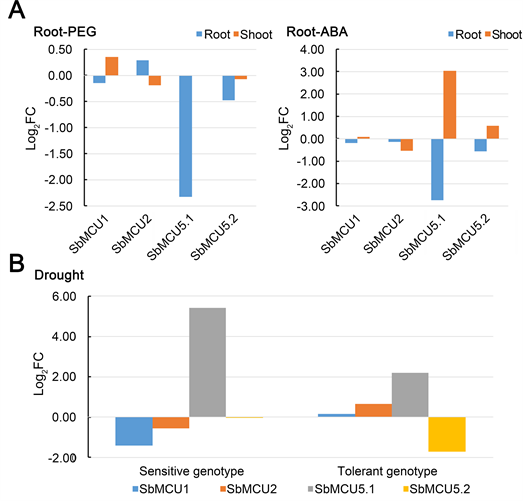
Figure 7. Expression profiles of the stress responsiveSbMCUsgenes. (A) RNA-Seq of Sorghum bicolor 9d seedlings in response to osmotic stress and abscisic acid; (B) Drought stress tolerance strategies revealed by RNA-Seq in two sorghum genotypes contrasting for WUE
图7. 逆境胁迫应答的SbMCUs家族基因表达模式分析。(A) 高粱幼苗(9d)对渗透胁迫和脱落酸的影响;(B) 两个不同基因型高粱对水分利用效率的比较研究
3.9. SbMCUs基因启动子顺式元件
为进一步解析SbMCUs家族成员对ABA和干旱胁迫的应答,我们对上SbMCUs家族成员基因的启动子区域进行元件分析(表3)。通过New PLACE在线预测所检测到的顺式元件中有3个响应元件,为ABRE、CBF和DRE。其中,干旱和ABA应答的ABRE元件存在于SbMCUs家族的每一个成员中;SbMCU1中含有ABRE和DRE元件的数量最多,均为3个,但是结合转录组数据分析发现,SbMCU1对ABA和干旱的响应并不明显。

Table 3. Detailed information of stress related motif in the SbMCUs promoter
表3. SbMCUs基因启动子胁迫相关的元件分析
4. 结论与讨论
随着杂粮关注度的增加,从高粱全基因组测序完成后,众多科研工作者从基因家族的角度对其进行了系统研究,已经鉴定出很多基因家族。MCU调节Ca2+信号转导,并参与胞质的很多生理活动,本研究鉴定分析SbMCUs家族有利于抗性基因的筛选,为进一步研究胞质内部活动提供参考依据,也为今后选育优良品种提供有力证据。
本研究应用生物信息学方法,筛选并鉴定出4个SbMCU基因,其与拟南芥和水稻MCU家族系统进化树中发现,水稻和高粱具有更紧密的系统发育关系,验证了水稻(单子叶植物)比拟南芥(双子叶物种)更与高粱(单子叶植物)接近的观点。高粱MCU基因数目较拟南芥和水稻是最少的,且存在的1对复制基因Ka/Ks < 0.5,说明高粱MCU家族基因数目并未通过复制现象得到扩充,同时说明其家族基因的结构较保守。从SbMCUs基因结构和蛋白结构上同时也发现,SbMCUs基因的高度保守性。在基因结构上,SbMCUs家族均含有1个内含子和两个外显子;在蛋白结构上,SbMCUs家族只含有一个功能结构域(Mitochondrial Calcium Uniporter),在其功能结构域上存在2个跨膜结构域(除SbMCU5.1不含有跨膜结构域外)。
在研究SbMCUs基因家族功能时,我们发现SbMCU5.2在不同组织器官和生长发育阶段的表达量最高;SbMCU5.1对ABA和渗透胁迫均有明显响应,而SbMCU5.1中含有其响应的作用元件并不多。以上只是对SbMCUs基因家族做出的初步鉴定和一些表达分析,并未对相应基因做进一步功能验证。因此,本研究会对已有结果进一步研究并加以验证,同时进一步研究SbMCUs基因家族在恶劣环境中的作用机理。