1. 背景
肺癌的死亡率在所有恶性肿瘤中居首位。肺癌可分为小细胞肺癌(Small cell lung cancer, SCLC)和非小细胞肺癌(Non-small cell lung cancer, NSCLC)两种类型,其中NSCLC约占85%的病例 [1]。早期NSCLC临床表现不典型,确诊时常出现局部进展或远处转移。一线化疗(以铂类为主的化疗)效果不佳,预后差,5年生存率低,低于20% [2]。2007年,研究人员发现编码受体酪氨酸激酶间变性淋巴瘤激酶(Anaplastic lymphoma kinas, ALK)的基因易位后,突变的基因可以表达ALK融合蛋白 [3] [4]。激活的ALK融合蛋白可产生持续的异常信号,通过激活下游通路 [5],如:PI3K/ALK/mTOR、RAS/RAF/MEK、JAK/STAT等通路,从正常细胞向肿瘤细胞进化。使用ALK酪氨酸激酶抑制剂(ALK-TKIs)可以有效抑制ALK融合蛋白的活化。克唑替尼是第一代小分子ALK-TKIs。在世界范围内广泛用于ALK阳性NSCLC的治疗。克唑替尼是ALK、c-MET和ROS1酪氨酸激酶三磷酸腺苷(ATP)的竞争性抑制剂,通过抑制ALK激酶磷酸化来抑制下游信号的激活,进而抑制肿瘤细胞的增殖 [6]。目前,克唑替尼与化疗相比的大型临床试验并不多见,有关克唑替尼与化疗相比的药物不良反应的讨论尚不明确。与化疗相比,克唑替尼有哪些风险和益处?因此,我们通过3个指标,包括无进展生存期(PFS)、客观应答率(ORR)和3/4级药物不良反应(ADE)的发生率,进行Meta分析,以确认克唑替尼的疗效和安全性。
2. 方法
2.1. 临床试验的搜索策略
2019年12月至2020年1月,两位作者(郝晨幸和孙丹彤)利用关键词“克唑替尼”、“crizotinib”和“PF-06260182”,对pubmad、EBSCO、ClinicalTrials.gov、中国国家知识基础设施(CNKI)、Cochrane图书馆等数据库进行了独立检索,检索文献为2011~2020年。所有作者都将讨论是否应该参与这项研究的任何分歧。此外,我们联系了一些相关研究的作者以获得进一步的信息。
2.2. 文献选择标准
所有比较克唑替尼与化疗治疗ALK阳性NSCLC的疗效和安全性的临床试验均被认为符合分析条件。两位作者(郝晨幸和孙丹彤)独立完成文献筛选。入选标准如下:1) 3/4期随机对照试验(RCT);2) 治疗ALK阳性NSCLC患者;3) 从研究中可以计算出完整的数据,包括ORR值、危险比(HR)值或3/4级ADE的发生率;4) 有全文;5) 对照组采用二线化疗方案。
2.3. 数据提取
两位作者(郝晨幸和孙丹彤)独立完成相关文献数据的提取,包括研究ID、发表年份、患者人数、药物剂量、化疗药物等研究特点。同时,提取本Meta分析选取的研究指标。首先,我们可以计算ORR值的临床结局指标,包括完全缓解(CR)、部分缓解(PR)、稳定病(SD)、进展病(PD)等。然后提取PFS的HR值,进行对数计算。同时,我们提取了3/4级ADE的病例数。
2.4. 质量评估
两位作者(孙丹彤和郝晨幸)使用Cochrane协作网(Cochrane Collaboration)的偏倚风险评估工具独立评估了文章的质量。偏差评估是由7部分组成包括:随机序列生成(选择性偏差),分配隐藏(选择性偏差),炫目的参与和人员(性能偏差),炫目的结果评估(检测偏差),不完整的结果数据(摩擦偏见),选择性报告(报告偏差)和其他偏见。不同意见将由所有作者讨论。
2.5. 统计分析
本Meta分析由Review Manager 5.3软件完成。计数资料以优势比(优势比,OR)和95%置信区间(95%置信区间,CI)表示,生存相关资料以危险比(危险比,HR)和95%置信区间(95%置信区间,CI)表示。目的比较克唑替尼组与化疗组的疗效及不良反应。Revman5.3的Meta分析将干预措施视为有害因素,因此,对于ORR、CR、PR、SD,相关事件数等于事件总数与相应结果事件数之差。采用卡方检验检验纳入结果的异质性。此外,使用I2统计量评估异质性。I2值高表示异质性。发表偏倚采用漏斗图进行评估。本研究采用随机效应模型比较克唑替尼与化疗治疗ALK阳性NSCLC的疗效和安全性。
3. 结果
3.1. 包括研究
通过数据库检索,共检索到4858篇关于“克唑替尼”的文献,最终纳入7篇文献进行Meta分析。排除重复项后,有4427篇文章未通过审核,有4322篇文章未通过审核。在剩下的101篇文章中,有94篇文章被排除在外。31篇因文章分类错误而被排除的文章,如:病例报告、综述、动物实验等;因缺乏足够的信息而被排除在外的47篇文章;不满意干预组排除14篇;2例在其他试验中也有相同的数据(PROFILE1007和PROFILE1014)。图1描述了文章选择的过程,其中7个研究 [7] - [13] 的详细情况如表1所示。

Figure 1. Flow chart describing the article selection process
图1. 描述文章选择过程的流程图

Table 1. Main characteristics of the included studies
表1. 纳入研究的主要特点
3.2. 偏倚风险评估
如前所述,Cochrane协作网的风险偏倚工具用于质量评估。图2(a)和图2(b)描述了本Meta分析中纳入研究的质量评估。由于药物临床试验的特殊性,可能对患者有益,因此参与者的盲法往往难以实施,这就导致了高风险的绩效偏差。本Meta分析的发表偏倚如图2(c)所示。

Figure 2. Quality assessment of the included studies. (a) (b) Risk-of-bias assessment; (c) Funnel plot of publication bias
图2. 克唑替尼与化疗治疗的临床疗效对比分析。纳入研究的质量评估(a) (b) 偏见风险评估;(c) 发表偏倚漏斗图
3.3. 临床结果和PFS
共纳入6项研究来分析CR、PR、SD和PD。在图3中,(a)~(d)分别代表CR、PR、SD、PD。可以看出,在图3(a)和图3(b)中,克唑替尼组与化疗组相比有明显的优势,OR值和95% CI分别为0.17 (0.05~0.61)和0.25 (0.16~0.40)。图3(c)显示,两组SD无统计学异质性。图3(d)显示,化疗组PR的发生率明显高于克唑替尼组。CR (I2 = 14%)、PD (I2 = 18%)的异质性较小。PR存在中度异质性(I2 = 46%),SD异质性较大(I2 = 74%)。
共纳入3项研究进行PFS分析。在图4中,与化疗组相比,克唑替尼组的PFS明显更长。HR值和95% CI为0.45 (0.38~0.53)。异质性小(I2 = 0%)。在删除了一篇样本量较小的文献后,敏感性分析显示,异质性较小(I2 = 0%),OR值,95% CI为0.47 (0.39~0.57)。

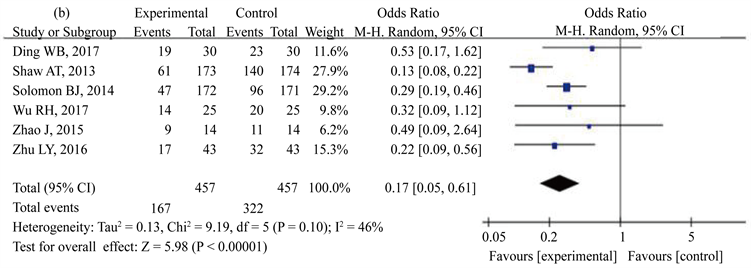


Figure 3. The clinical outcomes of crizotinib in the treatment of patients with advanced ALK positive NSCLC. (a) Complete remission (CR); (b) Partial remission (PR); (c) Stable disease (SD); (d) Progressive disease (PD)
图3. 克唑替尼治疗晚期ALK阳性NSCLC的临床疗效观察。(a) 完全缓解(CR);(b) 部分缓解(PR);(c) 稳定的疾病(SD);(d) 进步的疾病(PD)

Figure 4. The progression free survival (PFS) of crizotinib in the treatment of patients with advanced ALK positive NSCLC (HR value)
图4. 克唑替尼治疗晚期ALK阳性NSCLC的无进展生存期(PFS) (HR值)
3.4. ALK阳性NSCLC的ORR
图5为两组患者的ORR比较。所有研究均纳入ORR比较。克唑替尼组的ORR明显高于化疗组。OR值,95% CI为0.18 (0.13~0.24)。异质性较小(I2 = 14%)。在删除了一个小样本量的文档后,敏感性分析显示,异质性较小(I2 = 28%),OR值,95% CI为0.17 (0.12~0.25)。删除Solomon BJ的研究后,异质性变为最小(I2 = 0%)。本研究被认为是异质性的来源,可能是由于随访时间短、盲法缺失、样本量不合适等原因造成的。
3.5. 3/4级ADE的发生率
Zhu Q等人对克唑替尼的ADE进行了Meta分析,得出使用克唑替尼并不会导致严重冒险事件(SAEs)和脂肪冒险事件(FAEs)的增加 [14]。但纳入本荟萃分析的研究多为1期或2期临床试验,缺乏对照组。这项荟萃分析包括三项多中心研究,以比较两组患者3/4级ADE的发生率,以便我们能够更有说服力地评估克唑替尼与化疗相比的疗效和安全性。如图6所示,OR值与95% CI为0.91 (0.68~1.21)。异质性小(I2 = 0%)。在删除了一篇样本量较小的文献后,敏感性分析显示,异质性较小(I2 = 0%),OR值,95% CI为0.93 (0.66~1.31)。
3.6. 敏感性分析
如前所述,对HR、ORR和3/4级ADE的敏感性分析表明,本Meta分析的结果是稳定的。对CR、PR、PD的敏感性分析表明,删除Solomon BJ的研究后,异质性(I2)降低到一个可接受的水平(I2 cr = 0%; I2 pr = 45%; I2 pd = 0%),说明Meta分析对CR、PR、PD比较稳定。SD敏感性分析显示,异质性均大于50%,说明本Meta分析用于SD比较不太稳定,可能是由于缺乏研究、样本量不足等原因。发表偏倚对Meta分析结果影响不大。
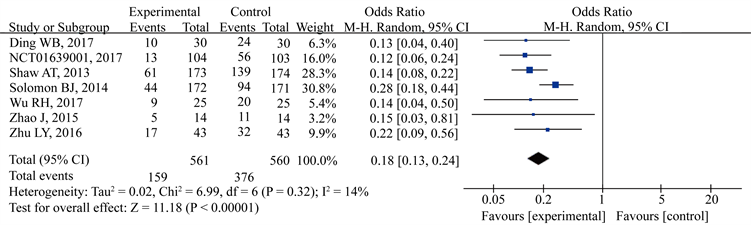
Figure 5. The objective response rate (ORR) of crizotinib in the treatment of patients with advanced ALK positive NSCLC
图5. 克唑替尼治疗晚期ALK阳性NSCLC的客观有效率(ORR)

Figure 6. The incidence of grade 3/4 adverse drug effect (ADE) of crizotinib in the treatment of patients with advanced ALK positive NSCLC
图6. 克唑替尼治疗晚期ALK阳性NSCLC 3/4级药物不良反应(ADE)的发生率
4. 讨论
本Meta分析的目的是评价克唑替尼治疗ALK阳性NSCLC的疗效和安全性。克唑替尼是第一代针对ALK基因的分子靶向药物,在临床上得到了广泛的应用。但到目前为止,还没有研究总结克唑替尼期3~4期临床试验的效果。
本研究纳入1121例患者。从本Meta分析结果不难看出,克唑替尼对ALK阳性NSCLC患者的疗效明显优于化疗。从生存数据来看,克唑替尼可显著提高PFS (ORhr = 0.45),使患者获益,但总体生存(OS)数据不足。因此,克唑替尼是否可以改善OS还需要进一步讨论。从临床结果来看,克唑替尼治疗的患者CR数量明显增加,PD数量明显减少。与化疗相比,克唑替尼可显著改善ALK阳性NSCLC的临床疗效。在安全性方面,与化疗相比,克唑替尼并没有显著增加ADE和3/4级ADE的发生率。
本Meta分析存在纳入研究不足、部分指标异质性较高等不足之处。但本Meta分析的主要指标结果稳定,具有一定的临床参考价值。
在ALK阳性NSCLC的临床治疗中,克唑替尼优于化疗。但耐药的存在成为克唑替尼面临的问题。Solomon BJ的研究表明,接受克唑替尼治疗的73% (65/89)患者在平均10.9个月后出现疾病进展 [8]。主要耐药机制如下:ALK基因耐药突变;信号转导途径激活;自噬;肿瘤异质性等。
5. 结论
综上所述,本Meta分析证实了克唑替尼治疗ALK阳性NSCLC的有效性和安全性。根据3期及4期临床试验结果,克唑替尼较化疗有明显优势,ADE耐受性良好。可作为晚期ALK阳性NSCLC患者的治疗选择。克唑替尼的长期不良反应需要进一步观察。