1. 引言
白及Bletilla striata (Thunb.) Reichb.f.为兰科白及属多年生草本植物,又名连及草、甘根等。白及叶形优美,花色艳丽,具有很高的观赏价值;白及更是重要的中药材之一,入药部位为干燥块茎,具有收敛止血、截疟、止痢、解毒、补虚等多种功效,多用于治疗咯血、吐血、崩漏下血、疟疾、痈肿、疮毒等症 [1]。
2015年版中国药典一部关于白及药材的质量控制标准中仅有理化鉴别、薄层色谱鉴别及水分、灰分检查等项目。在白及药材鉴别过程中发现,部分产地白及药材仅因其薄层色谱鉴别结果与白及对照药材色谱结果不一致而被判为不合格。指纹图谱能较全面地反映药材所含成分的相对关系与复杂性,是实现中药质量标准化的重要方法 [2];目前,有关白及药材的指纹图谱研究多采用高效液相色谱技术(high performance liquid chromatography, HPLC),分析时间长达940 min以上 [3] [4],而超高效液相色谱(ultra-high performance liquid chromatography, UPLC)相较于HPLC具有更短的分析时间、更高的分离效率及分析灵敏度 [5]。本研究拟建立多产地白及薄层色谱与白及超高效液相指纹图谱,结合相似度评价及聚类分析,旨在为白及药材鉴别、质量控制以及白及品种选育等方面奠定基础。
2. 材料
ACQUITY UPLC超高效液相色谱系统(美国Waters公司,包括二元溶剂管理器、样品管理器、ACQUITY UPLC TUV检测器、柱温箱、Empower3色谱工作站);薄层色谱数码成像系统(瑞士CAMMAG公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);ME403E/02电子天平(梅特勒–托利多上海有限公司,千分之一);Milli-Q IQ7000超纯水系统(美国Milli-pore公司);高效硅胶板(批号20180508,20 × 20 cm,青岛海洋化工有限公司);乙腈、甲酸均为色谱纯(美国默克公司);水为自制超纯水;其他试剂均为分析纯。
薄层层析和超高效液相供试样品为55个白及与5个华白及的干燥块茎,采自于浙江中医药大学种植基地内,原产地与种类详见表1,所有样品经浙江中医药大学丁志山教授鉴定,均为兰科白及属植物的干燥块茎。白及对照药材(中国食品药品检定研究院,批号121262-201706)。含有贝母兰宁(2,7-二羟基-4-甲氧基-9,10-二氢菲)、batatasin III (3,3’-二羟基-5-甲氧基联苄)、3’-甲氧基山药素的实验室自制混合对照品储备液。
注:1~55为白及,56~60为华白及。
3. 方法
3.1. 薄层色谱鉴别
供试品溶液制备参照中华人民共和国药典一部白及薄层色谱鉴别法:室温25℃下,取白及粉末1 g,加70%甲醇20 mL,40℃超声处理(功率350 W,频率53 Hz) 30 min,冷却至室温,滤过,滤液蒸干,残渣加水10 mL,超声10 min溶解,用20 mL乙醚振摇15 min,提取2次,合并乙醚液,挥至1 mL。对照药材溶液的制备同上。以环己烷–乙酸乙酯–甲醇(6:2.5:1)为展开剂;根据中华药典白及薄层鉴别法结合CAMMAG薄层色谱数码成像系统操作指南,在366 nm下观察供试品薄层色谱;在与对照药材色谱相应的位置上,观察是否显相同的棕红色斑点。
3.2. 基于UPLC的白及指纹图谱研究
3.2.1. 色谱条件
色谱柱为Waters ACQUITY UPLC BEH C18 (2.1 mm × 100 mm, 1.7 μm),检测波长:270 nm,柱温35℃,以乙腈和0.1%甲酸水为流动相,进行梯度洗脱,流速0.208 mL·min−1,进样量4 μL。
3.2.2. 供试品溶液制备
精密称取60产地白及粉末及对照药材粉末(过3号筛) 1.0 g,加入70%甲醇溶液20 mL,超声处理30 min (频率为50 MHz,功率为350 W),放冷,滤过,将滤液转移至25 mL容量瓶中,加甲醇稀释至刻度,摇匀。取定容好的供试品溶液100 μL,用70%甲醇稀释至8 mL,混匀,过0.22 μm滤膜,即得白及干粉质量浓度0.5 mg·mL−1的供试品溶液。
3.2.3. 混合对照品溶液制备
精密吸取0.01 mg·mL−1贝母兰宁、batatasin III和3'-甲氧基山药素储备液0.625 mL,置10 mL容量瓶中,加乙腈稀释至刻度,摇匀,制得0.000625 mg·mL−1的对照品溶液。
3.2.4. 方法学考察
精密度试验:取同一份供试品溶液(S4),按“3.2.1”项下色谱条件连续进样6次,测定色谱图,选取一个参比峰,计算各共有峰相对峰面积RSD。
稳定性试验:取同一份供试品溶液(S4),分别于0、4、8、16、24 h进样,测定色谱图,选取一个参比峰,计算各共有峰相对峰面积RSD。
重复性试验:取同一批白及样本(S4) 6份,按“3.2.2”项下方法制备供试品溶液,测定色谱图,测定色谱图,选取一个参比峰,计算各共有峰相对峰面积RSD。
3.2.5. 样品测定
取60批白及药材样品及白及对照药材,按3.2.2项下方法制备供试品溶液,在3.2.1项下的色谱条件下依次进样检测,将所有样本的指纹图谱数据导入“中药色谱指纹图谱相似度评价系统”(2004 A版),自动匹配后生成特征图谱;以白及对照药材为参照图谱,进行相似度评价。基于共有峰的相对峰面积,采用NTSYSpc2.1软件生成UPGMA聚类分析结果。
4. 结果
4.1. 薄层色谱鉴别
第3、7、13、17、20、30、33、34、38、41、43、49、50、54、60号白及的供试品色谱中,在与对照药材色谱相应的位置上,显相同的棕红色斑点,如图1所示。根据中国药典可鉴定以上白及药材为正品。
4.2. 基于UPLC的白及指纹图谱研究
4.2.1. 方法学考察
以贝母兰宁为参比峰,精密度、稳定性、重复性试验的结果显示,各共有峰相对峰面积RSD均<1.5%,表明精密度、重复性、供试品溶液稳定性较好,符合指纹图谱要求。
4.2.2. UPLC图谱建立
指纹图谱见图2,通过图谱比较,确定8个色谱峰为共有峰。第5个峰为贝母兰宁,分离度好且含量较高,以它为参照峰计算61份白及的共有峰相对保留时间。
4.2.3. 相似度评价
特征图谱见图3,相似度评价结果见表2。S28与白及对照药材图谱相似度最高,为0.994;S37与白及对照药材图谱相似度最低,为0.623。
4.2.4. 聚类分析
UPGMA聚类分析结果见图4。如图4虚线所示,在化学距离系数为3.81时,白及居群被分为4类,43号浙江衢州江山被单独聚为一类。分类与产地未见明显相关性。
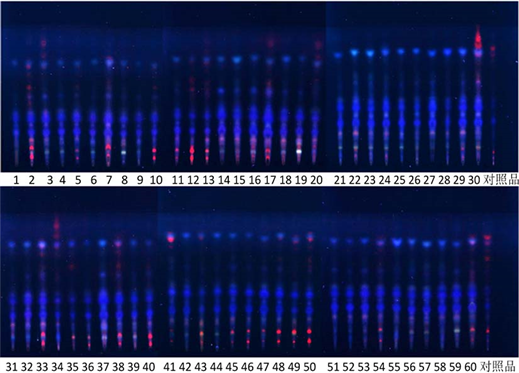
Figure 1. Thin layer chromatography of Bletilla striata
图1. 白及薄层色谱
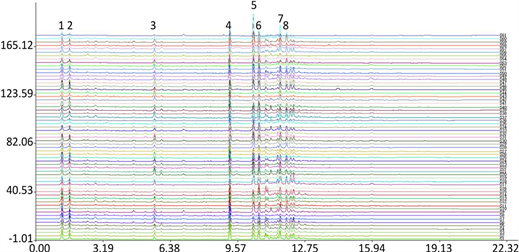
Figure 2. UPLC fingerprint of Bletilla striata
图2. 白及UPLC指纹图谱
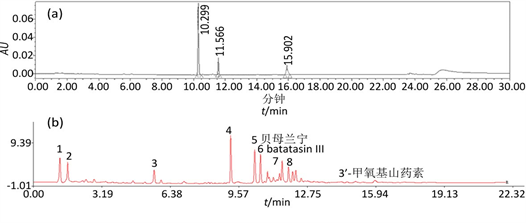 (a) 混合对照品溶液;(b) 白及特征图谱;从左至右分别为5.白及对照品贝母兰宁;6.batatasin III;3’-甲氧基山药素
(a) 混合对照品溶液;(b) 白及特征图谱;从左至右分别为5.白及对照品贝母兰宁;6.batatasin III;3’-甲氧基山药素
Figure 3. UPLC chromatogram of Bletilla striata
图3. 白及UPLC图

Table 2. Similarity evaluation results of 61 batches of Bletilla striata medicinal materials
表2. 61批白及药材样品相似度评价结果

Figure 4. UPGMA tree cluster diagram based on UPLC relative peak area
图4. 基于UPLC相对峰面积的UPGMA树状聚类图
5. 讨论
本研究以全国11省共60份白及属植物作为样本,测定了薄层色谱和超高效液相指纹图谱。薄层色谱直观反映了各产地白及的部分化学成分差异;液相色谱指纹图谱对白及化学成分的表征更具整体性,不同产地白及确定了8个共有峰,其指纹图谱相似度在0.623~0.994之间。
本研究的白及样本采自全国各地后统一种植于某同质园内,供试白及是野生采集白及的块茎繁殖而生,遗传物质未发生变化,故块茎中次生代谢产物的差异主要受遗传因素影响 [6]。基因决定中药材的化学成分表型,因此种质资源间遗传相似性与代谢物相似性存在一定的关联 [7]。研究显示不同产地白及的遗传聚类与地理分布相吻合 [8]。而本研究结果却显示同质园条件下基于化学成分的聚类与采集地不相关,甚至出现浙江衢州江山白及单独成为一类化学型的现象。这可能是白及植株从野外采集引种至同质园内,生境变迁、逆境胁迫引起表观遗传修饰基因 [9] [10] [11] [12],调控了遗传物质表达过程所致。以上猜测尚需通过限制性内切酶片段长度多态性、随机扩增多态性等DNA分子标记技术及甲基化敏感扩增多态性技术进行遗传与表观遗传学研究验证。
目前,中国药典对于包括白及在内的众多药材的质量评价仍沿用化学药物的质量控制模式 [13]。仅凭薄层色谱中在与对照药材相同位置处是否存在棕红色斑点来鉴别白及药材真伪,与中药本身的多成分复杂体系及中医的整体理念皆相违背,存在局限性。本研究结果显示,按照药典中薄层色谱鉴别标准,60份白及样品中仅15份鉴别为入药正品,正品率较低。而指纹图谱的相似度结果显示,经鉴定为正品的白及与对照药材的相似度为0.860~0.985不等;聚类分析结果中,第2、10、21、23、24、39、51号样品与白及对照药材化学距离较近,相似度为0.931~0.981不等,均未被鉴定为正品白及。可见,薄层鉴别结果与液相相似度评价、聚类分析结果并不一致。作者认为,薄层色谱上棕红色斑点的有无仅是差异的一个具体表现,并不能替代白及药材成分的全貌。文献报道白及的活性成分主要为多糖、联苄类、菲、多酚类 [14] [15] 等,而棕红色斑点对应的化学成分、药理活性尚无研究报道,无法评估其与白及药材质量的相关性。另外,5个华白及样品与对照药材相似度达0.940~0.982,化学成分较为接近,但药典仅将白及(紫花)纳入用药正品;是否可将紫花以外的其它白及属植物(华白及、小白及、黄花白及)收入药典标准,拓宽白及药材来源范围,值得进一步深入探究。以薄层色谱上的特定斑点作为鉴别依据不够充分,应增加基于液相色谱的化学评价标准,利用特征图谱和指纹图谱技术,并结合一评多测的白及多个活性成分定性定量测定,以加强对白及药材质量的整体控制。
基金项目
国家自然科学基金项目(81673672),国家中医药管理局中药饮片质量保障体系研究(201507002-1-11)。
参考文献