1. 引言
结直肠癌(Colorectal cancer, CRC)是世界上最常见的三大恶性肿瘤之一 [1]。近年来,随着我国人民的生活节奏加快以及饮食结构的改变,CRC发病率呈明显上升趋势,且年轻化 [2]。临床上常用血清标志物CEA、CA-199、CA-242联合检测作为对疾病的诊断,但是,此三种肿瘤标志物联检的灵敏度仅为33%~56%左右 [3]。因此,发现一种敏感性及特异性高的标志物显得尤为重要。MicroRNA (miRNA)是一类长18~24个核苷酸的非编码小分子单链RNA。miRNA通过完全或部分碱基配对与靶分子3′-非翻译区(3′-untranslated region, 3′-UTR)结合,降解或抑制mRNA的翻译,从而抑制靶基因的表达 [4]。miRNA在肿瘤的发生发展过程中起到调控靶基因的重要作用 [5]。PTEN是肿瘤抑制基因,具有脂质和蛋白双重磷酸活性,在细胞生长、增殖、生存、凋亡、血管生成、细胞迁移和侵袭等方面发挥重要作用 [6]。PTEN在肿瘤中表达下调或者发生缺失突变时,可激活PI3K/Akt信号通路,从而引起肿瘤的发生发展、侵袭和转移 [7]。
有研究提出miRNA不仅在肿瘤组织内稳定表达,而且能稳定存在于血清、血浆、全血中 [8] [9],可作为一种无创的肿瘤诊断标志物。Li等研究发现CRC患者血清和血浆miRNA-181的表达明显上调 [10],但是,其发病机制仍不明确。本文通过研究miRNA-181和PTEN与病理分期的相关性,为临床上治疗和预后监测提供实验依据。
2. 资料与方法
2.1. 研究对象
选取2017年1月至2019年6月在粤北人民医院胃肠外科住院并病理诊断证实为结直肠癌的患者120例,其中男68例,女52 例,年龄47~70岁,平均年龄55.6岁。所有的患者术前均未接受放射治疗、化学药物、免疫治疗。纳入标准:① 病理确诊为结直肠癌的患者;② 未经任何放疗、化疗等治疗的患者。排除标准:① 合并有其他恶性肿瘤病史;② 家族遗传性息肉病患者。根据美国癌症联合委员会(American Joint Committee on Cancer, AJCC)/国际抗癌联盟(the International Union Against Cancer, UICC)的结直肠癌TNM分期标准 [11]:I期10例,II期18例,III期48例,IV期44例;另取同期健康体检者100例作为对照,年龄45岁~65岁,平均年龄52.28岁,男50例,女50例。两组人群年龄差异无统计学意义。本研究经汕头大学医学院附属粤北人民医院伦理委员会批准,所有研究对象均签约知情同意书。
2.2. 试剂及仪器
总RNA提取试剂盒(货号19022511)、反转录试剂盒(货号S160112173047)及实时荧光定量PCR试剂盒(货号0000175157)购自上海生工生物工程股份有限公司。miRNA-181与内参U6上下游引物购自广州锐博生物有限公司(货号0000170405);PTEN表达检测用的引物和内参也需要说明。实时荧光定量PCR检测使用BIO-RAD CFX96型仪器(美国BIO-RAD公司)。
2.3. 实验方法
2.3.1. 标本采集
静脉采集各组外周血3 ml,EDTA抗凝,3000 r/min离心15 min,取血浆放入干净Eppendorf管中,在10℃ 13000 r/min离心5 min,去除细胞碎片,处理好的血浆于−80℃冰箱保存,以备用于RNA提取,该步骤在2 h内完成。
取结直肠原发肿瘤组织及癌旁正常肠粘膜组织(取材部位距离肿瘤边缘至少5 cm),离体10 min内放入液氮保存。取液氮保存结直肠组织约500 mg,研磨至极细碎末状,加入1 ml Trizol,用于提取总RNA。
2.3.2. 血浆总RNA提取
冻存的血浆标本复温,严格按照RNA提取试剂说明书提取血浆总RNA。使用紫外分光光度仪测定提取RNA的浓度及纯度,其A260/A280比值应在1.8~2.1之间,计算RNA浓度用于进一步实验。
2.3.3. 反转录反应
应用反转录试剂盒中的特异性反转录引物并按照说明书逐步合成cDNA,反转录体系20 µL,反转录条件:37℃ 15 min,85℃ 5 s,4℃保存反转录产物。
2.3.4. real-time PCR反应
实时荧光定量PCR反应体系和反应条件参照试剂盒说明书进行操作。
2.3.5. 结直肠癌细胞培养及转染
将人结直肠癌细胞株SW1116加入含10%胎牛血清的RPMI 1640培养液10 mL,800 r/min,4℃离心5 min,弃去上清液,重悬后将细胞加入RPMI 1640培养基中,置于37℃、5% CO2培养箱中培养,待细胞融合至80%~90%时传代。
四甲基偶氮唑盐(4-Methylcyclohexanone, MTT)法检测细胞增殖 [11]:分别以每孔103细胞密度将3组细胞接种于96孔培养板,以培养液为空白对照,分别培养1,2,3,4天。每孔加入5 mg/ml MTT 20 µl,37℃继续培养4 h后终止培养,弃去培养液,加入二甲基亚砜(DMSO),振荡、室温孵育10分钟后,测定波长493 nm处各孔吸光度(A)值。以时间为横坐标,以A值为纵坐标,绘制细胞生长曲线。
平板克隆形成实验:以100、200、400个细胞的密度分别将3组细胞接种于培养皿中,静止培养2周。当培养皿中出现肉眼可见的克隆时(≥50个细胞的为一个克隆),终止培养,弃去培养液。平板克隆形成率 = 形成克隆数/接种细胞数 × 100%。
2.4. 免疫组织化学结果的判断
PTEN试剂盒(含兔抗人PTEN多克隆抗体及二抗)购自上海钰博生物科技有限公司。免疫组织化学(SP法)染色严格按说明书,以PBS替代一抗作为阴性对照。免疫组化试剂购自福建迈新生物公司,澳林巴斯光学显微镜构自日本奥林巴斯(OLYMPUS)公司。PTEN以细胞核呈现棕黄色颗粒为阳性结果,免疫组织化学结果判定由两名中级职称以上病理医师负责诊断。
2.5. 统计学处理
运用SPSS17.0软件对数据进行分析,计量数据采用均数 ± 标准差表示,两组组间比较采用t检验,多组间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
3. 结果
3.1. 结直肠癌患者血浆中miRNA-181和PTEN的表达水平
经实时荧光定量PCR检测,结果显示结直肠癌患者血浆中miRNA-181明显增高,为3.28 ± 0.46,对照组为0.58 ± 0.23;PTEN明显下降,为0.26 ± 0.21,对照组为5.37 ± 1.34,通过t检验,差异具有统计学意义,分别为P = 0.01和P = 0.001,详见图1。
3.2. 结直肠癌组织中PTEN蛋白表达
结直肠癌患者组织中PTEN蛋白明显下降,阳性表达率明显降低,与癌旁正常组织(对照组)比较(见图2),36.67% vs 100%,比较差异有统计学意义(P < 0.001)。
3.3. 结直肠癌患者组织中miRNA-181和PTEN蛋白表达与病理特征及临床分期的关系
根据不同分期miRNA-181和PTEN值分别为T I:2.26 + 1.09和43%、T II:3.17 + 1.83和37%、T III:5.04 + 2.06和18%和T IV:7.38 + 2.45和11%。随着肿瘤分期恶性度的增加miRNA-181表达逐步升高,而PTEN蛋白表达逐步降低,各组间比较采用方差分析,T I期与T II期间、T III期间、T IV期间比较差异,具有统计学意义(P < 0.01和P < 0.001),结果详见表1。
 (a)为miRNA-181在结直肠癌患者血浆中的表达水平与对照组比较,*P < 0.01;(b)为PTEN在结直肠癌患者血浆中的表达水平与对照组比较,**P < 0.001。
(a)为miRNA-181在结直肠癌患者血浆中的表达水平与对照组比较,*P < 0.01;(b)为PTEN在结直肠癌患者血浆中的表达水平与对照组比较,**P < 0.001。
Figure 1. Expression of miRNA-181和PTEN in CRC patients and control group
图1. miRNA-181和PTEN在结直肠癌患者血浆中的表达水平。
 (a)为PTEN蛋白在癌旁对照组的组织中的表达(免疫组化,400×);(b)为PTEN蛋白在CRC组的组织中的表达(免疫组化,400×);(c)为两组的PTEN蛋白阳性表达量,***P = 0.00。
(a)为PTEN蛋白在癌旁对照组的组织中的表达(免疫组化,400×);(b)为PTEN蛋白在CRC组的组织中的表达(免疫组化,400×);(c)为两组的PTEN蛋白阳性表达量,***P = 0.00。
Figure 2. Expression of PTEN protein CRC patients and control group
图2. PTEN蛋白在结直肠癌组和癌旁对照组的组织中表达
3.4. miRNA-181和PTEN基因在结直肠癌患者血浆和癌组织中的相关分析
miRNA-181和PTEN基因在结直肠癌患者血浆中的表达之间存在着良好线性负相关的关系(r = −0.736, P = 0.05)。miRNA-181和PTEN基因在血浆的表达与在组织中蛋白的表达分别呈正相关,分别为r = 0.627和r = 0.714,P = 0.05。

Table 1. Relationship between miRNA-181 and PTEN protein in CRC tissue and clinicopathological characteristics TNM
表1. CRC组织中miRNA-181和PTEN蛋白表达与临床病理特征及TNM分期的相关性
注:检测结直肠癌组织miRNA-181的相对表达水平(
);检测结直肠癌组织PTEN蛋白阳性表达率用%来表示。
3.5. miRNA-181对CRC细胞株SW1116细胞增殖能力的影响
采用MTT法检测CRC细胞株SW1116细胞转染miRNA-181 mimic组和对照组,正如图3所示:转染miRNA-181 mimic组不同时间的细胞生长水平明显高于对照组,各组间比较差异有统计学意义(*P < 0.05, **P < 0.01, ***P < 0.001)。
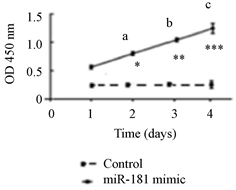 图3表示转染miRNA-181 mimic组不同时间的细胞生长水,各组间比较差异有统计学意义(a: *P < 0.05,b: **P < 0.01,c: ***P < 0.001)。
图3表示转染miRNA-181 mimic组不同时间的细胞生长水,各组间比较差异有统计学意义(a: *P < 0.05,b: **P < 0.01,c: ***P < 0.001)。
Figure 3. SW 1116 cells from CRC cell line of transforming the cell growth of the miRNA-181 mimic at different times were detected by MTT method
图3. 采用MTT法分别检测CRC细胞株SW 1116细胞在不同时间转染miRNA-181 mimic的细胞生长情况
细胞集落形成实验显示:在转染miRNA-181 mimic组的细胞克隆生长速度加快于对照组和转染PTEN基因组(图4(A)~(C)),转染miRNA-181 mimic组的细胞克隆形成率达到78%,明显高于对照组(19%),两组比较差异具有统计学意义(*P < 0.01),见图4(D)。
 (A) 表示阴性对照组(脂质体转染法,100×);(B) 表示miRNA-181 mimic转染组(脂质体转染法,100×);(C) 表示PTEN组(脂质体转染法,100×);(D):各组细胞克隆形成率比较,与miRNA-181 mimic转染组比较,a, *P = 0.01,b, *P = 0.01。
(A) 表示阴性对照组(脂质体转染法,100×);(B) 表示miRNA-181 mimic转染组(脂质体转染法,100×);(C) 表示PTEN组(脂质体转染法,100×);(D):各组细胞克隆形成率比较,与miRNA-181 mimic转染组比较,a, *P = 0.01,b, *P = 0.01。
Figure 4. Cell colony formation experiments showed SW 1116 cells Cell cloning growth rate in miRNA-181 mimic transfection group
图4. 细胞集落形成实验显示SW 1116细胞在miRNA-181 mimic转染组的细胞克隆生长速度
3.6. PTEN和miRNA-181 mimics转染对CRC细胞株SW1116细胞增殖能力的影响
采用MTT法检测CRC细胞株SW1116细胞转染PTEN组和miRNA-181mimic转染组的细胞生长情况,miRNA-181 mimic转染组的细胞生长水平明显高于PTEN组(*P < 0.01, **P < 0.001, ***P < 0.000) (见图4(B))。
在细胞集落形成实验中发现,图4(D)可见PTEN组抑制SW1116细胞增殖,细胞克隆生长明显落后于miRNA-181 mimic转染组,PTEN组细胞克隆生长率只有19%,而miRNA-181 mimic转染组的细胞克隆生长率达到78%,明显高于PTEN组,两组比较差异有统计学意义(*P < 0.01)。
4. 讨论
由于miRNA-181在多种恶性肿瘤组织中的表达具有促癌基因的活性,主要通过对下游靶分子转录后水平调控发挥生物效应 [12]。miRNA-181的表达与肺癌、肝癌等恶性肿瘤的发病有密切关系 [13],特别是miRNA-181在调控肿瘤细胞侵袭和迁移这一方面起到至关重要的作用。国外学者研究发现miRNA-181在CRC患者血浆中水平升高,肿瘤切除后水平明显下降 [14],但是目前CRC的发病机制仍未清楚。为了进一步研究miRNA-181在CRC中的作用机制,本研究采用实时荧光定量PCR技术检测CRC患者血浆和组织中miRNA-181的表达,发现血浆miRNA-181与CRC病理分期、淋巴结转移和远处转移有关,随着肿瘤恶性度的升高,miRNA-181表达逐步增高,尤其是在淋巴结转移的CRC中表达明显增高,其表达水平还与分化程度相关,低分化肿瘤组织中miRNA-181表达水平高于高分化者(见表1和图1)。同时还发现CRC患者血清中miRNA-181的表达与癌组织中的miRNA-181表达呈正相关(r = 0.627)。国外学者也发现miRNA-181表达水平与治愈率和生存率呈负相关 [14],上述的研究结果表明了血浆miRNA-181的表达水平在CRC的发展及恶性转化过程中发挥重要作用,可作为CRC患者预后评价的指标 [13] [14]。
miRNA通过与靶基因的结合共同发挥作用,实现对肿瘤发生发展的调控 [15]。miRNA-181以PTEN,RECK,TIMP-3,SPRY1、PI3K/AKT、Wnt/β-catenin等为作用的靶点,调节CRC细胞的生长及凋亡、侵袭和转移及耐药,认为PTEN 是miRNA-181的靶基因,miRNA-181高表达能促进恶性肿瘤细胞的侵袭和转移 [16]。国外Qing学者等 [17] 采用敲除PTEN基因发现增加CRC细胞的恶性程度,促进了CRC细胞的侵袭和转移。Rebersek等 [18] 研究结直肠癌患者的PTEN基因突变在肿瘤TI-TIII分期患者居多,且PTEN野生型患者的预后较好,中位生存期明显高于突变患者,肿瘤浸润深度是影响预后的独立危险因素。
PTEN基因是目前发现的具有磷酸激酶活性的抑癌基因,人类许多恶性肿瘤中存在着PTEN功能的失活,并与肿瘤进展有密切相关 [19]。我们采用免疫组织化学SP法检测结直肠癌组织PTEN蛋白的表达,发现与癌旁正常组织(对照组)比较差异有统计学意义(P = 0.001),提示PTEN蛋白表达下调在结直肠癌的发生过程中起到极为不良的事件。Lu等研究 [20] 发现环状RNA (circ-FBXW7)的上调,降低了PTEN的表达,诱导抑制肿瘤细胞的生长、增殖、迁移、侵袭。因此,PTEN蛋白的表达水平下调提示在一定的程度上促进细胞恶性转化和肿瘤转移。结合本研究结直肠癌临床病理资料分析发现,随着病情进展,结直肠癌组织细胞分化程度降低,PTEN蛋白的表达呈下降趋势,提示PTEN蛋白的表达直肠癌组织细胞分化相关。近期Salvatore等研究 [21] 表明PTEN下调上皮生长因子受体(epidermal growth factor receptor, EGFR)的活性,抑制PI3K-Akt通路的作用,通过改善细胞和细胞间质的相互作用,减弱肿瘤细胞的侵袭性。本研究结果也显示,有淋巴结转移组PTEN蛋白表达率(15%)明显低于淋巴结转移组(46%),P < 0.001。在T分期的I期→IV期CRC组织PTEN蛋白表达逐步下降(P < 0.001)。以上结果表明在高侵袭、高转移性的CRC组织中的表达明显降低或无表达,提示PTEN表达的下调可能是肿瘤的侵袭程度和转移增加的主要原因之一,促进CRC发展和转移的作用。本研究结果还显示PTEN基因在血浆的表达与免疫组织化学中PTEN蛋白的表达是一致的,呈正相关(r = 0.714,P = 0.05),两者分别在结直肠癌患者血浆和组织中的表达水平明显低于健康对照组,体现出PTEN基因和PTEN蛋白的表达水平越低、结直肠癌细胞增殖越活跃、分化程度越低,恶性程度就越高、并伴随着淋巴结及远处器官转移(见表1和图1)。因此,PTEN基因在一定程度上反映CRC细胞的侵袭和转移能力等生物学行为特征。总之,随着病情进展,患者的生存率下降,预示着患者预后极差,上述研究结果与文献报道基本一致 [22]。
对转染细胞的体外功能研究表明:miRNA-181可明显影响肿瘤细胞增殖能力导致细胞周期的变化,对肿瘤细胞的发展和进程起到促进作用 [23]。Cao等 [24] 报道采用双荧光素酶报告基因测试表示了miRNA-181能够与3′-UTR的VCAM-1结合调控白介素-17,通过转染非小细胞肺癌NSCLC的细胞株,促进了非小细胞肺癌细胞的增殖和迁移。本研究通过采用MTT法和细胞集落形成实验检测miRNA-181 mimic和PTEN在CRC细胞株SW1116的细胞生长和增殖能力水平,提示了miRNA-181有很强的促进CRC细胞株SW1116细胞的增殖能力(如图4),表明miRNA-181高表达和PTEN低表达均能够明显增加肿瘤细胞的迁移,这可能是由于miRNA-181高表达引起其作用于PTEN基因下调所致,导致增强肿瘤细胞的侵袭和迁移能力 [25]。本研究结果显示miRNA-181在结直肠癌患者血浆中的表达水平明显高于健康对照组;PTEN基因在结直肠癌患者血浆中的表达水平明显低于健康对照组。两者在结直肠癌患者血浆的表达呈负相关,表明miRNA-181可能在CRC的发展及恶化过程中发挥重要作用。
综上所述,血浆 miRNA-181表达水平与CRC病理分期有关,是CRC发生发展的重要因素,可作为一个重要的无创检测指标。miRNA-181的作用是通过调控PTEN基因参与结直肠癌的发生发展、侵袭和转移,为CRC的辅助诊断提供一个新的检测指标,也为结直肠癌基因治疗的一个新靶点 [26]。
基金项目
广东省重大科技专项资金项目(2013A022100011),广东省韶关市卫生计生科研项目(编号Y19021)。
NOTES
*通讯作者。